2024·广西·模拟预测
名校
解题方法
1 . 实验室用以下装置(夹持和水浴加热装置略)制备环己酮缩乙二醇。
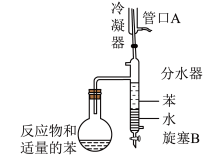

| A.以共沸体系带出水促使反应正向进行 |
| B.当观察到分水器中苯层液面高于支管口时,必须打开旋塞B将水放出 |
| C.管口A是冷凝水的进水口 |
| D.根据带出水的体积可估算反应进度 |
您最近一年使用:0次
2023-12-20更新
|
2150次组卷
|
8卷引用:福建省泉州市永春一中、培元中学、石光中学、季延中学2023-2024学年高三下学期第二次联合考试化学试题
福建省泉州市永春一中、培元中学、石光中学、季延中学2023-2024学年高三下学期第二次联合考试化学试题河南省漯河市高级中学2023-2024学年高三下学期3月月考化学试题(已下线)化学01(14+4模式)2024年1月“九省联考”考前化学猜想卷辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题(已下线)热点19 化学微型实验(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题
2 .  溶液中存在如下平衡:
溶液中存在如下平衡: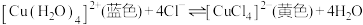 。已知蓝色与黄色的复合色为绿色,蓝色的
。已知蓝色与黄色的复合色为绿色,蓝色的 溶液加热后会变为绿色,下列说法正确的是
溶液加热后会变为绿色,下列说法正确的是
 溶液中存在如下平衡:
溶液中存在如下平衡: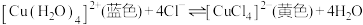 。已知蓝色与黄色的复合色为绿色,蓝色的
。已知蓝色与黄色的复合色为绿色,蓝色的 溶液加热后会变为绿色,下列说法正确的是
溶液加热后会变为绿色,下列说法正确的是| A.上述平衡的正反应为放热反应 |
B. 的空间构型为正四面体 的空间构型为正四面体 |
C.为研究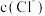 对平衡的影响,可向 对平衡的影响,可向 溶液中加入少量 溶液中加入少量 固体,充分搅拌后观察溶液颜色变化 固体,充分搅拌后观察溶液颜色变化 |
D.加热蒸干 溶液,最终会得到 溶液,最终会得到 固体 固体 |
您最近一年使用:0次
2022-12-09更新
|
1659次组卷
|
4卷引用:广东省六校联盟2022-2023学年高三上学期第三次联考化学试题
广东省六校联盟2022-2023学年高三上学期第三次联考化学试题广东省广州市第二中学等五校2022-2023学年高三上学期12月月考化学试题广东省六校2023届高三第三次联考化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第三章02练基础
名校
3 . 某同学进行如下实验:
①取少量稀盐酸放于试管中,投入光亮的铜片,无明显变化。
②向实验①的试管中通入足量的 ,铜片表面很快变暗,生成黑色同体,溶液逐渐变为棕色。
,铜片表面很快变暗,生成黑色同体,溶液逐渐变为棕色。
③若将稀盐酸换成稀硫酸重复实验①和②,均无明显变化。
资料: 是白色固体,难溶于水,能溶于盐酸,
是白色固体,难溶于水,能溶于盐酸,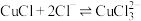 (棕色)
(棕色)
下列说法不正确 的是
①取少量稀盐酸放于试管中,投入光亮的铜片,无明显变化。
②向实验①的试管中通入足量的
 ,铜片表面很快变暗,生成黑色同体,溶液逐渐变为棕色。
,铜片表面很快变暗,生成黑色同体,溶液逐渐变为棕色。③若将稀盐酸换成稀硫酸重复实验①和②,均无明显变化。
资料:
 是白色固体,难溶于水,能溶于盐酸,
是白色固体,难溶于水,能溶于盐酸,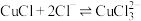 (棕色)
(棕色)下列说法
A.黑色固体不是 |
| B.将棕色溶液加水稀释,会产生白色沉淀 |
C.由实验①②能说明 增强了 增强了 的还原性 的还原性 |
D.上述过程中可能发生的反应: |
您最近一年使用:0次
2023-01-03更新
|
1022次组卷
|
7卷引用:北京师范大学附属实验中学2022-2023学年高二下学期3月月考化学试题
北京师范大学附属实验中学2022-2023学年高二下学期3月月考化学试题北京市第一七一中学2023-2024学年高三上学期10月考化学试题辽宁省东北育才学校2024届高三上学期高中学段联合考试化学试题湖北省襄阳市第五中学2023-2024学年高三上学期10月月考化学试题北京市海淀区2023届高三上学期期末考试化学试卷(已下线)北京市海淀区2022-2023学年高三上学期期末考试化学试卷(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(8-14)
名校
解题方法
4 . 高氯酸铵(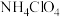 )受热或撞击可分解成
)受热或撞击可分解成 、
、 、
、 和
和 ,可用作火箭推进剂。一种以工业
,可用作火箭推进剂。一种以工业 (含少量的
(含少量的 和
和 )溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有
)溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有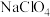 生成。
生成。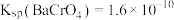 。
。
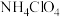 )受热或撞击可分解成
)受热或撞击可分解成 、
、 、
、 和
和 ,可用作火箭推进剂。一种以工业
,可用作火箭推进剂。一种以工业 (含少量的
(含少量的 和
和 )溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有
)溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有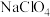 生成。
生成。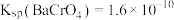 。
。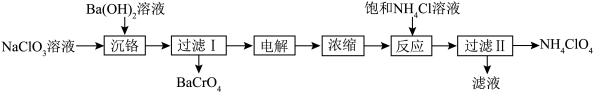
A.沉铬时加入 可以增加溶液的碱性,促进 可以增加溶液的碱性,促进 转化为 转化为 |
| B.电解时阴极附近溶液pH减小 |
C.加入饱和 溶液反应时可能有 溶液反应时可能有 生成 生成 |
D.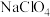 、 、 、 、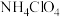 三种物质中, 三种物质中,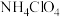 溶解度最大 溶解度最大 |
您最近一年使用:0次
2023-04-16更新
|
966次组卷
|
6卷引用:江苏省南通市通州区2022-2023学年高三下学期4月月考化学试题
名校
5 . 在容积为VL的恒温密闭容器中模拟工业合成氨。充入N2和H2的总物质的量为1mol,容器内各组分的物质的量分数与反应时间t的关系如图所示。下列说法不正确的是


| A.a表示N2物质的量分数的变化情况 |
B.0~t1min,v(H2)= mol·L-1·min-1 mol·L-1·min-1 |
| C.t2min时,NH3的分解速率小于其生成速率 |
| D.t3min时改变的条件可能为减小容器容积 |
您最近一年使用:0次
2022-02-26更新
|
2119次组卷
|
17卷引用:广东省深圳市第七高级中学2021-2022学年高三第七次月考化学试题
广东省深圳市第七高级中学2021-2022学年高三第七次月考化学试题辽宁省沈阳市第二中学2023-2024学年高二上学期10月阶段考试化学试题广东省深圳市普通高中2022届高三下学期第一次调研考试化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)(已下线)必刷卷01-2022年高考化学考前信息必刷卷(广东专用)(已下线)卷11 化学反应速率和平衡选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)湖南省常宁市第一中学2021-2022学年高三下学期期中考试化学试题(已下线)押广东卷化学第14题 化学反应速率与化学平衡-备战2022年高考化学临考题号押题天津市新华中学2022届高三下学期高考校一模(统练8)化学试题(已下线)2022年广东卷高考真题变式题(11-16)(已下线)专题13 化学反应速率与化学平衡-备战2023年高考化学母题题源解密(广东卷)河北省石家庄市第二中学2022届高三2.5模化学试题天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题广东省汕尾市华大实验学校2021-2022学年高三下学期第二次周考化学试题辽宁省沈阳市第二中学2023-2024学年高三上学期期中考试化学试题辽宁省沈阳市第二中学2023-2024学年高三上学期 期中化学试卷
6 . 一定条件下: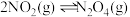
 。在测定
。在测定 的相对分子质量时,下列条件中,测定结果误差最小的是
的相对分子质量时,下列条件中,测定结果误差最小的是
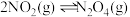
 。在测定
。在测定 的相对分子质量时,下列条件中,测定结果误差最小的是
的相对分子质量时,下列条件中,测定结果误差最小的是A.温度 、压强 、压强 | B.温度 、压强 、压强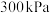 |
C.温度 、压强 、压强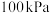 | D.温度 、压强 、压强 |
您最近一年使用:0次
2020-07-11更新
|
3803次组卷
|
56卷引用:河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(二)化学试题
河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(二)化学试题北京二中2020-2021学年高二上学期10月月考化学试题福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题浙江省吴兴高级中学高二 2021-2022学年上学期10月月考化学试题湖南省长沙市长郡中学2021-2022学年高三下学期月考考试(第六次)化学试题上海市川沙中学2021-2022学年高三下学期5月月考化学试题河北省石家庄市第十七中学2022-2023学年高二上学期10月月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题福建省福州高级中学2022-2023学年高二上学期学段考试化学试题黑龙江省海林市朝鲜族中学2023-2024学年高二上学期第二次月考化学试题陕西省兴平市南郊高级中学2023-2024学年高二上学期第一次质量检测化学试题天津市九十六中学2023-2024学年高三上学期12月月考化学试题2020年浙江省高考化学试卷(7月选考)(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编黑龙江省大庆市铁人中学2019-2020学年高一下学期期末考试化学试题海南省华中师范大学琼中附属中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】97湖北省咸宁市通城二中2020-2021学年度高二上学期期中考试化学试题河北省唐山市2020-2021学年高二上学期期末考试化学试题浙江省金华市金华十校2020-2021学年高二上学期调研考试化学试题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)【绍兴新东方】绍兴高中化学00007浙江省绍兴市上虞区2020-2021学年高二上学期期末教学质量调测化学试题(已下线)【浙江新东方】【2021.4.27】【温州】【高二上】【高中化学】【00197】(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)选择性必修1(SJ)专题2专题培优专练(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)河北正定中学2020-2021学年高二上学期开学考试化学试题(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题浙江省温州新力量联盟2021-2022学年高二上学期期中联考化学试题河南省濮阳市第一高级中学2021-2022学年高二上学期期中质量检测化学试题黑龙江省大庆实验中学2021-2022学年高二上学期期末考试化学试题陕西省宝鸡市渭滨区2021-2022学年高二上学期期末考试化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)天津市部分区2021-2022学年高三上学期期末考试化学试题广西柳州市第三中学2021-2022学年高二下学期期中考试化学试题(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)广东省深圳市华中师范大学龙岗附属中学2021-2022学年高二上学期期中考试化学试题(已下线)第七章 化学反应速率与化学平衡 第43讲 化学平衡移动原理及应用浙江省杭州第二中学2022-2023学年高二上学期期中考试化学(B卷)试题四川省凉山彝族自治州2022-2023学年高二上学期期末检测化学试题浙江省绍兴市柯桥区2022-2023学年高一下学期期末教学质量检测化学(实验班)试题作业(十二) 压强对化学平衡的影响 勒·夏特列原理广东省广州市第二中学2023-2024学年高二上学期期中考试化学试题福建省厦门市湖滨中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 实验室利用醋酸( )与双氧水(
)与双氧水( )在固体酸的催化下共热制备过氧乙酸(
)在固体酸的催化下共热制备过氧乙酸(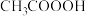 ,沸点
,沸点 )。实验过程中,逐滴滴入浓度为
)。实验过程中,逐滴滴入浓度为 的双氧水,温度维持在
的双氧水,温度维持在 ,待反应结束后分离反应器中的混合物,得到粗产品。下列说法错误的是
,待反应结束后分离反应器中的混合物,得到粗产品。下列说法错误的是
 )与双氧水(
)与双氧水( )在固体酸的催化下共热制备过氧乙酸(
)在固体酸的催化下共热制备过氧乙酸(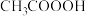 ,沸点
,沸点 )。实验过程中,逐滴滴入浓度为
)。实验过程中,逐滴滴入浓度为 的双氧水,温度维持在
的双氧水,温度维持在 ,待反应结束后分离反应器中的混合物,得到粗产品。下列说法错误的是
,待反应结束后分离反应器中的混合物,得到粗产品。下列说法错误的是A.逐滴滴入 的目的是提高双氧水的利用率 的目的是提高双氧水的利用率 |
B.温度维持在 的理由之一是防止 的理由之一是防止 分解 分解 |
C.使用磁力搅拌器的目的是为了提高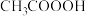 平衡产率 平衡产率 |
D.常压蒸馏可以分离提纯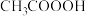 |
您最近一年使用:0次
2023-04-21更新
|
778次组卷
|
3卷引用:山东省烟台市第一中学2023-2024学年高三下学期4月份月考化学试题
解题方法
8 . 一定条件下,将 和
和 按物质的量为1∶3的投料比充入某刚性密闭容器中,发生反应:
按物质的量为1∶3的投料比充入某刚性密闭容器中,发生反应: ,测得
,测得 的物质的量浓度随反应时间的变化如图所示,下列说法正确的是
的物质的量浓度随反应时间的变化如图所示,下列说法正确的是

 和
和 按物质的量为1∶3的投料比充入某刚性密闭容器中,发生反应:
按物质的量为1∶3的投料比充入某刚性密闭容器中,发生反应: ,测得
,测得 的物质的量浓度随反应时间的变化如图所示,下列说法正确的是
的物质的量浓度随反应时间的变化如图所示,下列说法正确的是
A.0~5分钟,共放出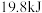 的热量 的热量 |
B. 和 和 的转化率相等时,反应达到平衡 的转化率相等时,反应达到平衡 |
C.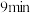 时,改变的外界条件可能是降温 时,改变的外界条件可能是降温 |
D.平衡常数 一定大于 一定大于 |
您最近一年使用:0次
2022-04-14更新
|
907次组卷
|
6卷引用:广东省松湖莞中、深大附中两校2023-2024学年高二上学期10月联考化学试题
广东省松湖莞中、深大附中两校2023-2024学年高二上学期10月联考化学试题广东省佛山市普通高中2022届高三教学质量检测(二)化学试题广东省佛山市2022届高三下学期4月第二次教学质量监测(二模)化学试题(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)押广东卷化学第14题 化学反应速率与化学平衡-备战2022年高考化学临考题号押题(已下线)专题13 化学反应速率与化学平衡-备战2023年高考化学母题题源解密(广东卷)
名校
解题方法
9 . 能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
II.2CH3OH(g) CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2
III.CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=___________ (用含△H1、△H2、△H3的代数表示)。
(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
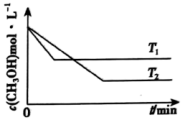
①△H___________ (填“>”“<”或“=”)0,说明理由___________ 。
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________ (填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为___________ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡___________ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1
III.CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为___________ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为___________ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1II.2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2III.CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3则3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
①△H
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1III.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为
您最近一年使用:0次
2021-07-02更新
|
1679次组卷
|
7卷引用:广西河池市九校2020-2021学年高二下学期第二次联考化学试题
广西河池市九校2020-2021学年高二下学期第二次联考化学试题重庆市缙云教育联盟2021-2022学年高三10月质量检测化学试题(已下线)第2章 化学反应速率和化学平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.2.3 影响化学平衡的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第二章 化学反应速率与化学平衡(B卷·能力提升练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)河南宏力学校2021-2022学年高二上学期期中考试化学试题浙江省杭师大附中2022-2023学年高二上学期期中考试 化学试题
10 . 氯化亚铜( )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下: 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是___________ 。
(2)步骤2是溶解过程,溶解时反应的离子方程式___________ 。
(3)步骤3为主反应, 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。___________ ;
②比较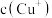 相对大小:A点
相对大小:A点___________ C点(填“>”、“<”或“=”);
③提高C点状态混合物中 沉淀率的措施是
沉淀率的措施是___________ ;
(4)步骤4进行的实验操作是___________ ;
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是___________ 。用乙醇洗涤的目的是___________ 。
(6)产品纯度测定:称取 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。
① 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是___________ 。
②产品中 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为___________ 。
 )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下:
 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
(2)步骤2是溶解过程,溶解时反应的离子方程式
(3)步骤3为主反应,
 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。
②比较
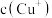 相对大小:A点
相对大小:A点③提高C点状态混合物中
 沉淀率的措施是
沉淀率的措施是(4)步骤4进行的实验操作是
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是
(6)产品纯度测定:称取
 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。①
 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是②产品中
 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为
您最近一年使用:0次
2023-05-31更新
|
709次组卷
|
7卷引用:湖南师范大学附属中学2024届高三上学期月考(二) 化学试题



