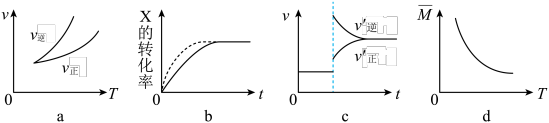
1 . 在密闭容器中进行反应: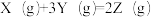 ,有关下列图像的说法错误的是
,有关下列图像的说法错误的是
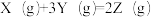 ,有关下列图像的说法错误的是
,有关下列图像的说法错误的是
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线可表示使用了催化剂 |
| C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
您最近一年使用:0次
2023-11-06更新
|
228次组卷
|
6卷引用:浙江省海盐第二高级中学2022-2023学年高二上学期10月第一阶段检测化学试题
名校
解题方法
2 . 利用CO2合成乙烯的反应原理为: ,往恒压密闭容器中按n(CO2)∶n(H2)=1∶3充入气体,在常压和催化剂作用下进行反应。测得温度对CO2平衡转化率和催化剂催化效率影响情况如图所示。下列说法不正确的是
,往恒压密闭容器中按n(CO2)∶n(H2)=1∶3充入气体,在常压和催化剂作用下进行反应。测得温度对CO2平衡转化率和催化剂催化效率影响情况如图所示。下列说法不正确的是

 ,往恒压密闭容器中按n(CO2)∶n(H2)=1∶3充入气体,在常压和催化剂作用下进行反应。测得温度对CO2平衡转化率和催化剂催化效率影响情况如图所示。下列说法不正确的是
,往恒压密闭容器中按n(CO2)∶n(H2)=1∶3充入气体,在常压和催化剂作用下进行反应。测得温度对CO2平衡转化率和催化剂催化效率影响情况如图所示。下列说法不正确的是
| A.该反应△H<0,平衡常数:KM>KN |
| B.反应速率有可能是(M)>(N) |
| C.温度越低,反应一定时间后CO2的转化率越高 |
| D.若投料比改为n(CO2)∶n(H2)=1∶4,可提高CO2的平衡转化率 |
您最近一年使用:0次
2023-09-17更新
|
212次组卷
|
2卷引用:浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
3 . 利用水煤气合成甲醇的反应原理为: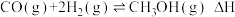 ,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是
,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是

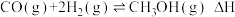 ,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是
,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是
| A.该反应△H<0 |
| B.图中压强的大小关系是a<b<c<d |
| C.CH3OH的体积分数越大,平衡常数越大 |
| D.恒温恒压时,往平衡体系中再充入1mol甲醇,重新平衡后甲醇的体积分数不变 |
您最近一年使用:0次
2023-09-17更新
|
411次组卷
|
4卷引用:浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题
浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题江西省宜春市宜丰中学创新部2023-2024学年高三上学期期中考试化学试题2024届河南省郑州市宇华实验学校高三一模化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
4 . 在一定条件下,某反应达到平衡时,平衡常数 。恒容时,若温度适当降低,D的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,D的浓度增加。下列说法正确的是
 。恒容时,若温度适当降低,D的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,D的浓度增加。下列说法正确的是| A.该反应的焓变为正值 | B.降低温度,平衡向正反应方向移动 |
C.若增大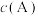 ,K值增大 ,K值增大 | D.若增大压强,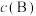 不变 不变 |
您最近一年使用:0次
解题方法
5 . 研究氮氧化物的性质具有重要的意义。
(1)NO可以催化 与
与 的反应:
的反应:
反应Ⅰ.
 kJ/mol
kJ/mol
反应Ⅱ.
 kJ/mol
kJ/mol
①下列说法正确的是:_____ 。
A.高温下有利于反应I的自发进行
B.反应Ⅱ的 对该反应的自发性影响不大
对该反应的自发性影响不大
C.恒温恒容下加入一定量 与
与 ,若容器内压强没有明显变化,说明不加催化剂时,
,若容器内压强没有明显变化,说明不加催化剂时, 与
与 的反应不能自发进行
的反应不能自发进行
D.NO催化下,一定量 与
与 反应一段时间后,升高温度,
反应一段时间后,升高温度, 的体积分数可能变大
的体积分数可能变大
②据报道,瑞典某工厂利用上述反应制取硫酸。在合成 时,向反应容器中适时通入冷激气(冷的原料气),其作用是
时,向反应容器中适时通入冷激气(冷的原料气),其作用是_____ 。
(2)密闭容器中加入一定量 和
和 ,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得
,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得 的体积分数随温度的变化如图所示:
的体积分数随温度的变化如图所示:
①由图可知,在M点之前,反应中 的体积分数随温度升高而减小,其原因为:
的体积分数随温度升高而减小,其原因为:_____ 。
②250℃和常压下,等物质的量的 和
和 反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平
反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平 的转化率平衡常数
的转化率平衡常数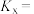
_____ 。( 是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中
是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中 的比例,使平衡时
的比例,使平衡时 的产率为90%。则
的产率为90%。则 和
和 的投料比(即起始时加入的物质的量之比)为
的投料比(即起始时加入的物质的量之比)为_____ 。
(3)在一定温度下,一定量 分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
(4)以固体催化剂催化CO还原NO生成 和
和 气体,反应历程如下(*表示吸附态),
气体,反应历程如下(*表示吸附态),
请补充完整。
化学吸附: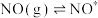 ;
;
表面反应: ;
;_____ :
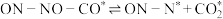 ;
;_____ 。
脱附: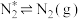 ;
;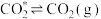
(1)NO可以催化
 与
与 的反应:
的反应:反应Ⅰ.

 kJ/mol
kJ/mol反应Ⅱ.

 kJ/mol
kJ/mol①下列说法正确的是:
A.高温下有利于反应I的自发进行
B.反应Ⅱ的
 对该反应的自发性影响不大
对该反应的自发性影响不大C.恒温恒容下加入一定量
 与
与 ,若容器内压强没有明显变化,说明不加催化剂时,
,若容器内压强没有明显变化,说明不加催化剂时, 与
与 的反应不能自发进行
的反应不能自发进行D.NO催化下,一定量
 与
与 反应一段时间后,升高温度,
反应一段时间后,升高温度, 的体积分数可能变大
的体积分数可能变大②据报道,瑞典某工厂利用上述反应制取硫酸。在合成
 时,向反应容器中适时通入冷激气(冷的原料气),其作用是
时,向反应容器中适时通入冷激气(冷的原料气),其作用是(2)密闭容器中加入一定量
 和
和 ,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得
,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得 的体积分数随温度的变化如图所示:
的体积分数随温度的变化如图所示:
①由图可知,在M点之前,反应中
 的体积分数随温度升高而减小,其原因为:
的体积分数随温度升高而减小,其原因为:②250℃和常压下,等物质的量的
 和
和 反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平
反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平 的转化率平衡常数
的转化率平衡常数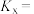
 是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中
是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中 的比例,使平衡时
的比例,使平衡时 的产率为90%。则
的产率为90%。则 和
和 的投料比(即起始时加入的物质的量之比)为
的投料比(即起始时加入的物质的量之比)为(3)在一定温度下,一定量
 分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
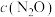 /mol·L /mol·L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
A.增大压强, 分解速率增大 分解速率增大 |
B.增大容器的体积,该分解反应平衡右移,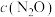 变小 变小 |
C.减小 的浓度,该分解反应速率减小 的浓度,该分解反应速率减小 |
| D.升高温度,容器内气体的压强一定变大 |
(4)以固体催化剂催化CO还原NO生成
 和
和 气体,反应历程如下(*表示吸附态),
气体,反应历程如下(*表示吸附态),请补充完整。
化学吸附:
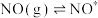 ;
;表面反应:
 ;
;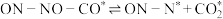 ;
;脱附:
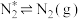 ;
;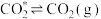
您最近一年使用:0次
解题方法
6 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向溴水中滴加丙烯醛( ),橙黄色褪去 ),橙黄色褪去 | 丙烯醛分子中含有碳碳双键 |
| B | 将Ag粉加到HI溶液中,生成无色气体和黄色沉淀 |  与 与 形成沉淀,促进Ag和 形成沉淀,促进Ag和 反应 反应 |
| C | 向碳酸钠溶液中滴加浓盐酸,将生成的气体通入硅酸钠溶液,有白色胶状沉淀产生 | C非金属性强于Si |
| D | 将某固体加水溶解,滴加少量NaOH溶液,加热,没有产生使湿润红色石蕊试纸变蓝的气体 | 固体中不存在 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
21-22高二·浙江·期中
解题方法
7 . CH3COOH是食醋的主要成分,用化学反应原理可以研究其性质。
(1)气态CH3COOH中存在平衡2CH3COOH (CH3COOH)2 △H<0, 若要准确测定CH3COOH的相对分子质量,应选用的条件是___________。
(CH3COOH)2 △H<0, 若要准确测定CH3COOH的相对分子质量,应选用的条件是___________。
(2)用滴定法可以测定食醋中醋酸的含量,用酸式滴定管取10.00mL这种市售食醋,置于已知烧杯中称得其质量为12.50g,再稀释至100mL,滴定时每次取20.00 mL于锥形瓶中,选用的标准溶液是0.1125 mol/LNaOH溶液滴定至终点,平均每次消耗NaOH溶液20.00mL。
①该实验中的指示剂应选择___________ (填“酚酞”、“甲基橙”或“石蕊”),滴定终点的现象为___________ 。
②该食醋中CH3COOH的质量分数为___________ (CH3COOH的相对分子质量为60,结果保留三位有效数字)。
③滴定过程中下列操作会导致测定的CH3COOH的质量分数偏小的是(其它操作均正确)___________ 。
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分无气泡,在滴定终点读数时发现气泡
C.达到滴定终点时,俯视溶液凹液面最低点读数
D.滴定过程中,部分NaOH溶液滴到锥形瓶外
(1)气态CH3COOH中存在平衡2CH3COOH
 (CH3COOH)2 △H<0, 若要准确测定CH3COOH的相对分子质量,应选用的条件是___________。
(CH3COOH)2 △H<0, 若要准确测定CH3COOH的相对分子质量,应选用的条件是___________。| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
①该实验中的指示剂应选择
②该食醋中CH3COOH的质量分数为
③滴定过程中下列操作会导致测定的CH3COOH的质量分数偏小的是(其它操作均正确)
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分无气泡,在滴定终点读数时发现气泡
C.达到滴定终点时,俯视溶液凹液面最低点读数
D.滴定过程中,部分NaOH溶液滴到锥形瓶外
您最近一年使用:0次
8 . 下列事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照条件下颜色变浅,溶液的pH会减小 |
| B.打开可乐瓶盖后看到有大量气泡逸出 |
| C.500℃左右比室温更有利于合成NH3 |
| D.实验室可用向浓氨水中加入一定量的氢氧化钠固体来快速制取氨气 |
您最近一年使用:0次
9 . 工业合成氨是20世纪的伟大成就之一,但化肥的过度使用、硝酸工业废气和动车尾气的排放,给水体和大气带来了一定程度的污染,需要进行综合处理。
Ⅰ.合成氨
(1)工业合成氨反应为:
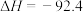 kJ·mol
kJ·mol ,下列说法正确的是_______。
,下列说法正确的是_______。
(2)一种电化学合成氨的原理如图所示。产生 的电极反应式是
的电极反应式是_______ 。
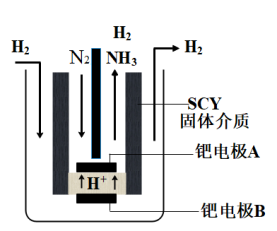
Ⅱ.含氮污染的处理
(3)水体中氨氮处理:在微生物作用下,废水中 经两步反应被氧化成
经两步反应被氧化成 :
:
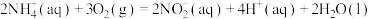
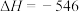 kJ·mol
kJ·mol
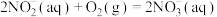
 kJ·mol
kJ·mol
则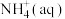 全部氧化成
全部氧化成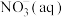 的热化学方程式是
的热化学方程式是_______ 。
(4)大气中NO处理:电解NaCl溶液(调节起始pH约为9)获得NaClO溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
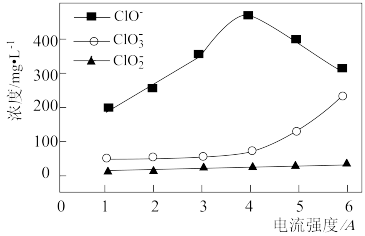
①用电解所得NaClO溶液氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是_______ 。
Ⅰ.合成氨
(1)工业合成氨反应为:

 kJ·mol
kJ·mol ,下列说法正确的是_______。
,下列说法正确的是_______。| A.采用高温以提高反应的平衡转化率 |
B.采用高压以加快反应速率,提高 的产量 的产量 |
C.为提高 转化率,可适当增大 转化率,可适当增大 的浓度 的浓度 |
D.生产过程中将 液化分离,有利于氨的合成 液化分离,有利于氨的合成 |
 的电极反应式是
的电极反应式是
Ⅱ.含氮污染的处理
(3)水体中氨氮处理:在微生物作用下,废水中
 经两步反应被氧化成
经两步反应被氧化成 :
: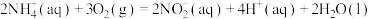
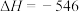 kJ·mol
kJ·mol
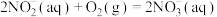
 kJ·mol
kJ·mol
则
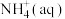 全部氧化成
全部氧化成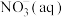 的热化学方程式是
的热化学方程式是(4)大气中NO处理:电解NaCl溶液(调节起始pH约为9)获得NaClO溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。

①用电解所得NaClO溶液氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是
您最近一年使用:0次
2023-01-11更新
|
359次组卷
|
2卷引用:浙江省杭州市学军中学2022-2023学年高二上学期期末考试化学试题
2022·浙江·模拟预测
10 . 为更早实现“碳达峰”“碳中和”,彰显中国作为大国的责任与担当, 的资源化利用成为近年来的重点研究方向。
的资源化利用成为近年来的重点研究方向。
利用 氧化丙烷脱氢制取丙烯有以下相关反应。
氧化丙烷脱氢制取丙烯有以下相关反应。
反应 :逆水煤气转换:
:逆水煤气转换:
反应II:丙烷在无氧条件下直接脱氢:
反应III: 氧化丙烷脱氢:
氧化丙烷脱氢:
已知: 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ;
;
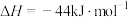 。
。
(1)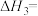
___________ 。
(2)下列说法不正确的是___________(填序号)。
(3) 氧化丙烷脱氢制取丙烯可采用铬的氧化物作为催化剂,反应机理如图甲所示,请在图乙上画出反应过程能量的变化趋势图
氧化丙烷脱氢制取丙烯可采用铬的氧化物作为催化剂,反应机理如图甲所示,请在图乙上画出反应过程能量的变化趋势图___________ 。

(4) 加氢时除发生反应I外,还可产生
加氢时除发生反应I外,还可产生 ,具体反应如下:
,具体反应如下:
反应IV、

在相同容积的密闭容器中按 通入
通入 和
和 ,分别在0.1MPa和1MPa下进行反应。分析温度对平衡体系中
,分别在0.1MPa和1MPa下进行反应。分析温度对平衡体系中 、CO、
、CO、 的影响,设这三种气体物质的量分数之和为1,其中CO和
的影响,设这三种气体物质的量分数之和为1,其中CO和 的物质的量分数与温度变化关系如图丙所示。
的物质的量分数与温度变化关系如图丙所示。

①表示0.1MPa时 物质的量分数随着温度变化关系的曲线是
物质的量分数随着温度变化关系的曲线是___________ (填序号)。
②N点低于M点的原因是___________ 。
③590℃时反应IV的平衡常数 为
为___________ [结果保留3位有效数字,对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作 ,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡体系中B的物质的量分数]。
,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡体系中B的物质的量分数]。
 的资源化利用成为近年来的重点研究方向。
的资源化利用成为近年来的重点研究方向。利用
 氧化丙烷脱氢制取丙烯有以下相关反应。
氧化丙烷脱氢制取丙烯有以下相关反应。反应
 :逆水煤气转换:
:逆水煤气转换:
反应II:丙烷在无氧条件下直接脱氢:

反应III:
 氧化丙烷脱氢:
氧化丙烷脱氢:
已知:
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ;
;
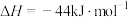 。
。(1)
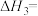
(2)下列说法不正确的是___________(填序号)。
A.反应I的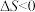 |
| B.选择合适的催化剂可提高丙烯的选择性和平衡产率 |
| C.恒温恒压下通入水蒸气有利于增大丙烷的转化率 |
| D.为得到更多的丙烯,实际生产中反应温度越高越好 |
 氧化丙烷脱氢制取丙烯可采用铬的氧化物作为催化剂,反应机理如图甲所示,请在图乙上画出反应过程能量的变化趋势图
氧化丙烷脱氢制取丙烯可采用铬的氧化物作为催化剂,反应机理如图甲所示,请在图乙上画出反应过程能量的变化趋势图
(4)
 加氢时除发生反应I外,还可产生
加氢时除发生反应I外,还可产生 ,具体反应如下:
,具体反应如下:反应IV、


在相同容积的密闭容器中按
 通入
通入 和
和 ,分别在0.1MPa和1MPa下进行反应。分析温度对平衡体系中
,分别在0.1MPa和1MPa下进行反应。分析温度对平衡体系中 、CO、
、CO、 的影响,设这三种气体物质的量分数之和为1,其中CO和
的影响,设这三种气体物质的量分数之和为1,其中CO和 的物质的量分数与温度变化关系如图丙所示。
的物质的量分数与温度变化关系如图丙所示。
①表示0.1MPa时
 物质的量分数随着温度变化关系的曲线是
物质的量分数随着温度变化关系的曲线是②N点低于M点的原因是
③590℃时反应IV的平衡常数
 为
为 ,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡体系中B的物质的量分数]。
,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡体系中B的物质的量分数]。
您最近一年使用:0次



