解题方法
1 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知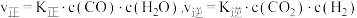 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数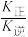 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知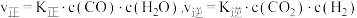 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数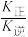 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
解题方法
2 . 草酸亚铁晶体( FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。

(1)装置D的名称为___________ ,作用是_________________________________ 。
(2)按照气流从左到右的方向,上述装置的连接顺序为a→_____________ →d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。
(3)能证明分解产物中存在CO的现象是_____________________ 。
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:

(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为__________ 。
Ⅲ.文献表明:相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论进行以下实验。
)的还原性强于Fe2+。为检验这一结论进行以下实验。
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3− Fe3++ 3C2O
Fe3++ 3C2O K=6.3×10−21
K=6.3×10−21
通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱
的还原性强弱
(5)取实验中的少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红。加硫酸后溶液变红的原因是__________________________________ 。
(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是_____________ 。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。

(1)装置D的名称为
(2)按照气流从左到右的方向,上述装置的连接顺序为a→
(3)能证明分解产物中存在CO的现象是
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:

(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为
Ⅲ.文献表明:相同条件下,草酸根(C2O
 )的还原性强于Fe2+。为检验这一结论进行以下实验。
)的还原性强于Fe2+。为检验这一结论进行以下实验。资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3−
 Fe3++ 3C2O
Fe3++ 3C2O K=6.3×10−21
K=6.3×10−21通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱
的还原性强弱| 操作 | 现象 |
| 在避光处,向10mL0.5mol∙L-1FeCl3溶液中缓慢加入0.5mol∙L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到翠绿色溶液和翠绿色晶体 |
(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是
您最近一年使用:0次
名校
解题方法
3 . 在一定温度下的密闭容器中发生反应: xA + yB zC,平衡时测得A的浓度为0.50 mol·L−1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.20 mol·L−1。下列判断不正确的是
zC,平衡时测得A的浓度为0.50 mol·L−1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.20 mol·L−1。下列判断不正确的是
 zC,平衡时测得A的浓度为0.50 mol·L−1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.20 mol·L−1。下列判断不正确的是
zC,平衡时测得A的浓度为0.50 mol·L−1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.20 mol·L−1。下列判断不正确的是| A.B的转化率降低 | B.平衡向正反应方向移动 |
| C.x+y<z | D.C的物质的量分数增大 |
您最近一年使用:0次
2023-08-08更新
|
175次组卷
|
2卷引用:福建省泉州市南安市侨光中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
4 . 氨性硫代硫酸盐浸金是一种高效的黄金浸取工艺。
(1)金可在硫代硫酸钠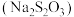 溶液中缓慢溶解:
溶液中缓慢溶解: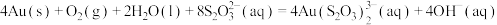 。
。
① 含Au
含Au 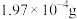 金矿中,加入
金矿中,加入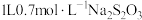 溶液,10小时后,金的浸出率为0.1%,则浸出过程
溶液,10小时后,金的浸出率为0.1%,则浸出过程 的平均消耗速率为
的平均消耗速率为___________  。
。
②为提高金的浸出速率,可采取的措施为___________ 。
(2) 可催化金在
可催化金在 溶液中的溶解,其电化学催化腐蚀过程如图所示。
溶液中的溶解,其电化学催化腐蚀过程如图所示。
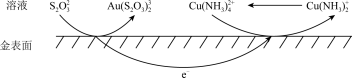
①负极的电极反应式为___________ 。
②正极可能的催化过程如下:
a.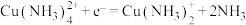
b.___________
③反应温度对金的浸出率影响如图所示。分析50℃时金浸出率最高的原因是___________ 。

(3)为研究浸金过程 与
与 的反应,进行如下实验:向
的反应,进行如下实验:向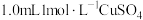 溶液中加入
溶液中加入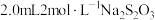 溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
ⅰ.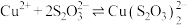 (绿色)
(绿色) 
ⅱ.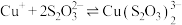 (无色)
(无色) 
ⅲ.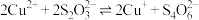

由实验现象可推测:反应ⅰ的速率___________ 反应ⅲ的速率(填“>”或“<”)、
___________  。
。
(4)若采用 催化硫代硫酸盐浸金,催化效果较
催化硫代硫酸盐浸金,催化效果较 差的原因是
差的原因是___________ 。
(1)金可在硫代硫酸钠
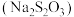 溶液中缓慢溶解:
溶液中缓慢溶解: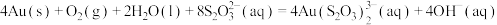 。
。①
 含Au
含Au 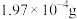 金矿中,加入
金矿中,加入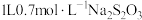 溶液,10小时后,金的浸出率为0.1%,则浸出过程
溶液,10小时后,金的浸出率为0.1%,则浸出过程 的平均消耗速率为
的平均消耗速率为 。
。②为提高金的浸出速率,可采取的措施为
(2)
 可催化金在
可催化金在 溶液中的溶解,其电化学催化腐蚀过程如图所示。
溶液中的溶解,其电化学催化腐蚀过程如图所示。
①负极的电极反应式为
②正极可能的催化过程如下:
a.
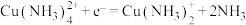
b.
③反应温度对金的浸出率影响如图所示。分析50℃时金浸出率最高的原因是

(3)为研究浸金过程
 与
与 的反应,进行如下实验:向
的反应,进行如下实验:向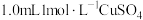 溶液中加入
溶液中加入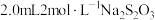 溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:ⅰ.
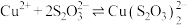 (绿色)
(绿色) 
ⅱ.
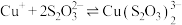 (无色)
(无色) 
ⅲ.
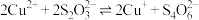

由实验现象可推测:反应ⅰ的速率

 。
。(4)若采用
 催化硫代硫酸盐浸金,催化效果较
催化硫代硫酸盐浸金,催化效果较 差的原因是
差的原因是
您最近一年使用:0次
2023-08-05更新
|
271次组卷
|
5卷引用:福建省厦门市2021-2022学年高二上学期期末质量检测化学试题
名校
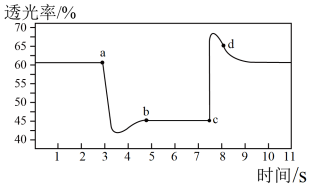
5 . 已知反应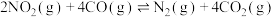
 。将一定量的
。将一定量的 与
与 充入装有催化剂的注射器中并密封。改变注射器活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是
充入装有催化剂的注射器中并密封。改变注射器活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是
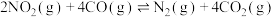
 。将一定量的
。将一定量的 与
与 充入装有催化剂的注射器中并密封。改变注射器活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是
充入装有催化剂的注射器中并密封。改变注射器活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是
| A.a点的操作是快速压缩注射器 |
B.若考虑体系温度变化,且没有能量损失则平衡常数: |
C.d点:v(正) (逆) (逆) |
| D.若在c点将温度降低,其透光率将增大 |
您最近一年使用:0次
名校
6 . 有一个处于平衡状态的反应:X(g)+3Y(g)  2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
① 低温 ②高温 ③高压 ④低压 ⑤加催化剂 ⑥除去Z
 2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是
2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是① 低温 ②高温 ③高压 ④低压 ⑤加催化剂 ⑥除去Z
| A.①④⑥ | B.②③⑤ | C.①③⑥ | D.②③⑥ |
您最近一年使用:0次
2022-12-21更新
|
203次组卷
|
2卷引用:福建省泉州市永春第一中学2022-2023学年高二上学期期末考试化学试题
7 . 光气又称碳酰氯,有剧毒,可发生反应COCl2(g) CO(g)+Cl2(g)。在一密闭容器中发生该反应,达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,下列说法正确的是
CO(g)+Cl2(g)。在一密闭容器中发生该反应,达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,下列说法正确的是
 CO(g)+Cl2(g)。在一密闭容器中发生该反应,达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,下列说法正确的是
CO(g)+Cl2(g)。在一密闭容器中发生该反应,达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,下列说法正确的是| A.平衡向逆反应方向移动 | B.Cl2的质量分数减小 |
| C.COCl2的平衡转化率减小 | D.反应的平衡常数不变 |
您最近一年使用:0次
名校
8 . 某种工业废水中含有一定量的Cr2O 和CrO
和CrO ,它们易被人体吸收积累而导致肝癌。
,它们易被人体吸收积累而导致肝癌。
I、污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
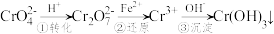
(1)已知第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
①Cr2O 中Cr的化合价是
中Cr的化合价是___________ 。
②常温下,向平衡体系加入氢氧化钠溶液至pH=12,此时溶液显___________ 色。
(2)第②步发生反应的离子方程式为___________ 。
(3)已知反应FeCl3+3KSCN⇌3KCl+Fe(SCN)3的离子方程式为Fe3++3SCN- Fe(SCN)3,往平衡体系中加少量的KSCN固体,平衡向
Fe(SCN)3,往平衡体系中加少量的KSCN固体,平衡向___________ 方向移动(填“逆反应”、“正反应”或“不移动”);往平衡体系中加少量的KCl固体,平衡向___________ 方向移动(填同上)。
II、取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,充分反应后滴入几滴淀粉作指示剂。
步骤Ⅲ:用0.1000mol·L-1的Na2S2O3溶液测定上面产生的碘单质。(I2+2Na2S2O3=2NaI+Na2S4O6)当溶液由蓝色变无色时为滴定终点,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL废水经酸化后,含有Cr2O 的物质的量为
的物质的量为___________ mol。
 和CrO
和CrO ,它们易被人体吸收积累而导致肝癌。
,它们易被人体吸收积累而导致肝癌。I、污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
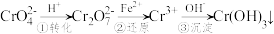
(1)已知第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O①Cr2O
 中Cr的化合价是
中Cr的化合价是②常温下,向平衡体系加入氢氧化钠溶液至pH=12,此时溶液显
(2)第②步发生反应的离子方程式为
(3)已知反应FeCl3+3KSCN⇌3KCl+Fe(SCN)3的离子方程式为Fe3++3SCN-
 Fe(SCN)3,往平衡体系中加少量的KSCN固体,平衡向
Fe(SCN)3,往平衡体系中加少量的KSCN固体,平衡向II、取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,充分反应后滴入几滴淀粉作指示剂。
步骤Ⅲ:用0.1000mol·L-1的Na2S2O3溶液测定上面产生的碘单质。(I2+2Na2S2O3=2NaI+Na2S4O6)当溶液由蓝色变无色时为滴定终点,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL废水经酸化后,含有Cr2O
 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
9 . 节能减排已经成为全社会的共识,有一种思路是将一氧化碳(CO)转化成可燃物质甲醇,甲醇汽油能减少有害气体(CO)排放。现有一种利用煤气化过程中生成的CO和H2来制备甲醇的方案,其反应原理为:CO(g)+2H2(g) CH3OH(g)。请根据下列图示回答问题:
CH3OH(g)。请根据下列图示回答问题:
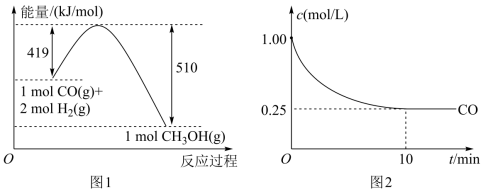
(1)根据(图1),写出此反应的热化学方程式___________ 。下列关于此反应的说法中,正确的是___________ (填字母)
A.任何条件都能自发进行 B.高温条件能够自发进行
C.任何条件都不自发进行 D.低温条件能够自发进行
(2)现进行如下实验,在体积为1L的密闭容器中,充入1
 和3
和3
 ,测得
,测得 的浓度随时间变化如(图2)所示,从反应开始到平衡,
的浓度随时间变化如(图2)所示,从反应开始到平衡, 的平均反应速率
的平均反应速率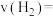
___________ 
(3)恒容条件下,上述反应达到平衡后,以下措施中能使 增大的有___________。
增大的有___________。
(4)已知在常温常压下:化学反应①②的平衡常数分别为 ,
,
①2CH3OH(l)+O2(g) CO2(g)+4H2(g) K1
CO2(g)+4H2(g) K1
②2CO(g)+O2(g) CO2(g) K2
CO2(g) K2
则CO(g)+2H2(g) CH3OH(l)的
CH3OH(l)的
___________ (用含有K1,K2的代数式表达)
 CH3OH(g)。请根据下列图示回答问题:
CH3OH(g)。请根据下列图示回答问题:
(1)根据(图1),写出此反应的热化学方程式
A.任何条件都能自发进行 B.高温条件能够自发进行
C.任何条件都不自发进行 D.低温条件能够自发进行
(2)现进行如下实验,在体积为1L的密闭容器中,充入1

 和3
和3
 ,测得
,测得 的浓度随时间变化如(图2)所示,从反应开始到平衡,
的浓度随时间变化如(图2)所示,从反应开始到平衡, 的平均反应速率
的平均反应速率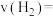

(3)恒容条件下,上述反应达到平衡后,以下措施中能使
 增大的有___________。
增大的有___________。| A.升高温度 | B.充入 气 气 |
C.再充入1  和3 和3  | D.使用催化剂 |
 ,
,
①2CH3OH(l)+O2(g)
 CO2(g)+4H2(g) K1
CO2(g)+4H2(g) K1②2CO(g)+O2(g)
 CO2(g) K2
CO2(g) K2则CO(g)+2H2(g)
 CH3OH(l)的
CH3OH(l)的
您最近一年使用:0次
名校
10 . 为探究外界条件对反应: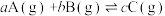 ΔH的影响,以A和B的物质的量之比为a:b开始反应,通过实验得到不同条件下反应达到平衡时A的物质的量分数随温度、压强的变化如图所示。下列判断正确的是
ΔH的影响,以A和B的物质的量之比为a:b开始反应,通过实验得到不同条件下反应达到平衡时A的物质的量分数随温度、压强的变化如图所示。下列判断正确的是

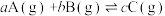 ΔH的影响,以A和B的物质的量之比为a:b开始反应,通过实验得到不同条件下反应达到平衡时A的物质的量分数随温度、压强的变化如图所示。下列判断正确的是
ΔH的影响,以A和B的物质的量之比为a:b开始反应,通过实验得到不同条件下反应达到平衡时A的物质的量分数随温度、压强的变化如图所示。下列判断正确的是
| A.a+b>c |
| B.平衡后增大容器体积,反应会放出热量 |
| C.升高温度,正,逆反应速率都增大,平衡常数也增大 |
| D.平衡后再充入amol A,平衡正向移动,再次达到平衡后,A的物质的量分数减小 |
您最近一年使用:0次
2022-11-14更新
|
176次组卷
|
4卷引用:福建省永泰县城关中学2022-2023学年高二上学期期中考试化学试题



