1 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,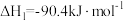 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,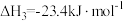 ;
;
Ⅳ. ,
,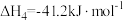 ;
;
请回答下列问题:
(1)

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化; 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数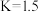 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,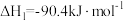 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,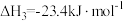 ;
;Ⅳ.
 ,
,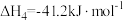 ;
;请回答下列问题:
(1)


(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: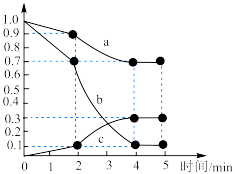
 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
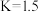 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  | 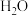 |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
解题方法
2 . 苯甲酸甲酯是一种无色透明油状液体,具有浓郁的冬青油香气,用于配制香水、香精,也可用作有机合成中间体、溶剂等。某实验小组以苯甲酸和甲醇为原料模拟工业合成苯甲酸甲酯,步骤如下:
Ⅰ.制备:向100mL如图所示的装置A中加入磁力搅拌子,然 后依次加入6.1 g苯甲酸、10 mL 95%甲醇、20 mL苯,微热将苯甲酸全部融化后,加入2.5克固体氯化铝催化剂。按如图所示组装好仪器,并预先在分水器内加入水至略低于支管口,加热回流4 h,直至反应基本完成。
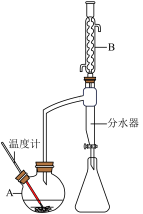
实验过程中分水器得到的液体会分层,需多次开启分水器活塞将下层液体放出。
Ⅱ.分离提纯:待反应液冷却至室温后过滤掉氯化铝,将液体倒入盛有冷水的烧杯中,再经过一系列分离提纯操作,最后蒸馏收集196~199°C馏分,得到5.0 g产品。
可能用到的数据如下:
请回答下列问题:
(1)苯甲酸的沸点高于苯甲酸甲酯的原因为___________ 。
(2)加料时,n(甲醇):n(苯甲酸)约为5:1,甲醇过量的原因是____________ ;但醇酸比超过5:1时,醇酸比的增加对产率影响不大,原因是___________ 。
(3)该实验的温度控制在85°C,应采取的加热方式为___________ 。
(4)实验中需多次将分水器中下层液体放出,其目的是___________ ,判断反应已经完成的标志是___________ 。
(5)步骤Ⅱ中,“一系列分离提纯操作”过程中用到的试剂包括a.无水氯化钙,b.饱和食盐水,c.5% Na2CO3溶液。按操作先后顺序应依次加入___________ (填字母),加入饱和食盐水的作用是___________ 。
(6)传统制法用浓硫酸催化,浓硫酸催化具有活性高,价格低廉的优点,但现代工艺多以固体氯化铝作催化剂。这样改进最主要的原因是___________ 。
Ⅰ.制备:向100mL如图所示的装置A中加入磁力搅拌子,然 后依次加入6.1 g苯甲酸、10 mL 95%甲醇、20 mL苯,微热将苯甲酸全部融化后,加入2.5克固体氯化铝催化剂。按如图所示组装好仪器,并预先在分水器内加入水至略低于支管口,加热回流4 h,直至反应基本完成。

实验过程中分水器得到的液体会分层,需多次开启分水器活塞将下层液体放出。
Ⅱ.分离提纯:待反应液冷却至室温后过滤掉氯化铝,将液体倒入盛有冷水的烧杯中,再经过一系列分离提纯操作,最后蒸馏收集196~199°C馏分,得到5.0 g产品。
可能用到的数据如下:
| 有机物名称 | 相对分子质量 | 密度/(g· cm-3) | 沸点/°C | 溶解性 |
| 苯甲酸 | 122 | 1.26 | 249 | 微溶于水,易溶于乙醇 |
| 甲醇 | 32 | 0.79 | 64.8 | 易溶于水 |
| 苯甲酸甲酯 | 136 | 1.08 | 198 | 难溶于水、易溶于乙醇 |
| 苯 | 78 | 0.88 | 80.1 | 难溶于水 |
(1)苯甲酸的沸点高于苯甲酸甲酯的原因为
(2)加料时,n(甲醇):n(苯甲酸)约为5:1,甲醇过量的原因是
(3)该实验的温度控制在85°C,应采取的加热方式为
(4)实验中需多次将分水器中下层液体放出,其目的是
(5)步骤Ⅱ中,“一系列分离提纯操作”过程中用到的试剂包括a.无水氯化钙,b.饱和食盐水,c.5% Na2CO3溶液。按操作先后顺序应依次加入
(6)传统制法用浓硫酸催化,浓硫酸催化具有活性高,价格低廉的优点,但现代工艺多以固体氯化铝作催化剂。这样改进最主要的原因是
您最近一年使用:0次
3 . 下列实验装置或操作能达到相应实验目的的是


| A.图I:铁制品上镀铜 |
| B.图Ⅱ:蒸发CuSO4溶液制得CuSO4·5H2O |
| C.图Ⅲ:增大反应物浓度使平衡正向移动 |
| D.图Ⅳ:测定H2C2O4溶液浓度 |
您最近一年使用:0次
名校
4 . 根据下列实验操作,能够得到相应实验现象或结论的是
| 选项 | 实验操作 | 实验现象或结论 |
| A | 用注射器吸入 由 由 和 和 组的混合气体,向外拉动注射器活塞至气体体积为原来的2倍 组的混合气体,向外拉动注射器活塞至气体体积为原来的2倍 | 减小容器压强,反应 的平衡逆向移动,气体颜色变深 的平衡逆向移动,气体颜色变深 |
| B | 分别向体积为20mL浓度为1mol/L和 的 的 溶液中加入2g锌粉,比较收集相同体积的 溶液中加入2g锌粉,比较收集相同体积的 所需的时间 所需的时间 | 反应物浓度越大,收集相同体积的 所需的时间越短,反应速率越快 所需的时间越短,反应速率越快 |
| C | 向盛有 5% 5% 溶液的甲、乙试管中分别滴加5滴等浓度的 溶液的甲、乙试管中分别滴加5滴等浓度的 和 和 溶液,对比气泡产生的速率 溶液,对比气泡产生的速率 | 若甲试管中产生气泡的速率更快,则 的催化效果比 的催化效果比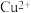 的好 的好 |
| D | 向滴加了KSCN(aq)的 溶液中加入少量KCl固体 溶液中加入少量KCl固体 | 平衡逆向移动,溶液颜色变浅 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-14更新
|
212次组卷
|
4卷引用:山西省榆次第一中学校2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
5 . 在恒压、NO和O2的起始浓度一定的条件下, 催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
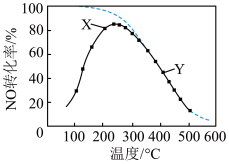
| A.反应2NO(g)+O2(g)=2NO2(g)的 ΔH>0 |
| B.图中X点所示条件下,延长反应时间能提高NO转化率 |
| C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率 |
| D.380℃下,c起始(O2)=5.0 ×10-4 mol·L-1, NO平衡转化率为50%,则平衡常数K<2000 |
您最近一年使用:0次
2021-06-20更新
|
437次组卷
|
11卷引用:山西省晋中市平遥县第二中学校2021-2022学年高二上学期期中考试化学试题
山西省晋中市平遥县第二中学校2021-2022学年高二上学期期中考试化学试题江苏省镇江中学2020-2021学年高二上学期期末考试化学试题(已下线)【镇江新东方】高二下期中21高二期中校级联考江苏省扬州市江都区大桥高级中学2020-2021学年高二下学期学情检测(二)化学试题贵州省毕节市金沙县第一中学2021-2022学年高二上学期期中考试化学试题河南省范县第一中学2021-2022学年高二上学期期中检测化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题福建省宁德第一中学2022-2023学年高二上学期第二次月考化学试题河北省石家庄市河北正定中学2024届高三上学期第二次月考化学试题福建省厦门市第一中学2021-2022学年高二上学期 期中考试化学试卷江苏省南京市第一中学2023-2024学年高一下学期期中考试化学试卷
10-11高二下·江苏南京·期中
名校
6 . 下列对化学平衡移动的分析中,不正确 的是
①已达平衡的反应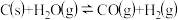 ,当增加反应物的物质的量时,平衡一定向正反应方向移动
,当增加反应物的物质的量时,平衡一定向正反应方向移动
②已达平衡的反应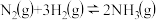 ,当增大
,当增大 的浓度时,平衡向正反应方向移动,
的浓度时,平衡向正反应方向移动, 的转化率一定升高
的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
①已达平衡的反应
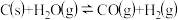 ,当增加反应物的物质的量时,平衡一定向正反应方向移动
,当增加反应物的物质的量时,平衡一定向正反应方向移动②已达平衡的反应
 ,当增大
,当增大 的浓度时,平衡向正反应方向移动,
的浓度时,平衡向正反应方向移动, 的转化率一定升高
的转化率一定升高③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
您最近一年使用:0次
2021-11-19更新
|
439次组卷
|
71卷引用:山西省寿阳县第一中学2020—2021学年高二上学期第二次月考化学试题
山西省寿阳县第一中学2020—2021学年高二上学期第二次月考化学试题(已下线)2010—2011学年江苏省南京六中高二下学期期中考试化学试题(已下线)2010-2011年云南省玉溪一中高二下学期期末考试化学试卷(已下线)2011-2012学年浙江省浙东北三校高二下学期期中联考化学试卷(已下线)2012-2013学年江苏省江都区丁沟中学高二下学期期中考试化学试卷(已下线)2013-2014学年贵州省册亨县民族中学高二上学期期末考试化学试卷(已下线)2014-2015学年甘肃省兰州一中高二上学期期中考试化学卷2014-2015学年山西省曲沃中学校高二上学期期中化学试卷2014-2015吉林省松原市扶余县一中高二上学期期末化学试卷2015-2016学年河南省鄢陵高级中学高二上学期第二次月考化学试卷2015-2016学年江西省上高二中高二上二次月考化学试卷2015-2016学年江西省上高二中高二上第二次月考化学试卷2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷2015-2016学年广东省深圳市明德外语学校高二上学期期中理化学试卷2015-2016学年浙江省杭州二中高二上学期期末化学试卷2015-2016学年四川省彭州中学高二下2月月考化学试卷2015-2016学年河北省邢台一中高一下期中化学试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷2016-2017学年四川省成都外国语学校高二上10月月考化学试卷2017届黑龙江省哈尔滨市第六中学高三上学期期中考试化学试卷2016-2017学年甘肃省兰州一中高二上期中理化学试卷2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷甘肃省临夏中学2016-2017学年高二上学期期末考试化学试题河北省张家口市第一中学2016-2017学年高一(衔接班)下学期期末考试(理)化学试题陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题山西省运城市康杰中学2017-2018学年高二上学期第一次月考化学试题河南省中原名校(即豫南九校)2017-2018学年高二上学期第一次联考化学试题山西省太原市小店区2017—2018学年高二化学上学期10月月考试题山西大学附属中学2017-2018学年高二上学期10月模块诊断化学试题陕西煤铜川市炭建设公司第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】四川省棠湖中学2018-2019学年高二上学期期中考试理综-化学试题【全国百强校】海南省海南中学2017-2018学年高二(理)上学期期末考试化学试题西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题湖北省孝感高级中学2019-2020学年高二9月调研化学试题江西省宜春市上高二中2019-2020学年高二上学期第二次月考化学试题河南省南阳市第一中学2019-2020学年高二上学期第四次月考化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题西藏自治区日喀则市南木林高级中学2019-2020学年高二上学期期中化学试题湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题云南省文山马关实验高级中学2019-2020学年高二期末考试化学试题河南省周口市扶沟县包屯高中2019---2020学年高二上期期末考试化学试题湖北省黄石市2018-2019学年高二上学期期末质量监测考试化学试题辽宁省大连市庄河市高级中学2019-2020学年高二下学期5月网上月考化学试题宁夏石嘴山市第三中学2019-2020学年高一下学期期中考试化学试题陕西省咸阳市实验中学2019-2020学年高二上学期第二次月考化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高二上学期开学考试化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 教材帮四川省宜宾翠屏棠湖学校2020-2021学年高二上学期10月月考化学试题甘肃省庄浪县第一中学2020-2021学年高二上学期第二学段考试化学试题湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题内蒙古呼和浩特市第十六中学2020-2021学年高二上学期第一次质量检测化学试题广东实验中学附属天河学校2020--2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(2)】【化学】青海省北外附属西宁新华联国际学校2020-2021学年高二上学期期末考试化学试题甘肃省民勤县第四中学2020-2021学年高二下学期开学考试化学试题陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题黑龙江嫩江市高级中学等八校2021-2022学年高二上学期9月联合考试化学试题河北省保定市定州市2021-2022学年高二上学期期中考试化学试题广东省高州市校际2021-2022学年高二11月联考化学试题江西省吉安市永新中学2021-2022学年高二上学期期中考试化学(理科)试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题四川省广安代市中学校2021-2022学年上学期高二第三次月考化学试题福建省建瓯市芝华中学2021-2022学年高二上学期期中考试化学试题天津市第二十五中学2022-2023 学年高二上学期期末阶段测试化学试题天津市和平区2017-2018学年高二上学期期中质量调查化学试题重庆市荣昌永荣中学校2021-2022学年高二上学期期中考试化学试题作业(八) 浓度、压强对化学平衡的影响第2课时 温度、浓度对化学平衡的影响
名校
7 . 室温下,向3 mL0.1 mol/L稀盐酸中加入1 mL0.1mol/L氯化钴溶液发生反应: ,平衡时溶液呈浅紫色。下列说法不正确的是
,平衡时溶液呈浅紫色。下列说法不正确的是
 ,平衡时溶液呈浅紫色。下列说法不正确的是
,平衡时溶液呈浅紫色。下列说法不正确的是| A.加热,溶液会逐渐变成蓝色 |
| B.向溶液中加AgNO3,如果生成白色沉淀.说明该反应存在限度 |
| C.加入少量水,平衡会逆向移动 |
| D.加入NaCl固体,平衡右移,但平衡常数不变 |
您最近一年使用:0次
2020-10-24更新
|
770次组卷
|
5卷引用:山西省介休市第十中学2022-2023学年高二上学期 期中考试化学试题
8 . 从下列事实,找出不能用勒夏特列原理解释的是 ( )
A.在溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅 HBr+HBrO,当加入NaOH溶液后颜色变浅 |
B.反应CO+NO2 CO2+NO △ H<0,升高温度使平衡向逆方向移动 CO2+NO △ H<0,升高温度使平衡向逆方向移动 |
C.对2HI H2+I2 H2+I2 平衡体系增加压强使颜色变深 平衡体系增加压强使颜色变深 |
D.合成氨反应:N2+3H2  2NH3 △H<0,为使氨的产率提高,理论上应采取低温 2NH3 △H<0,为使氨的产率提高,理论上应采取低温 |
您最近一年使用:0次
9 . 某温度下,反应N2(g)+3H2(g)⇌2NH3(g);△H<0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时, 与原平衡相比变小了,则改变条件的可能有
与原平衡相比变小了,则改变条件的可能有
 与原平衡相比变小了,则改变条件的可能有
与原平衡相比变小了,则改变条件的可能有| A.保持容器的容积不变,升高了温度 |
| B.保持容器压强和温度不变,向容器内补充了Ar(g) |
| C.保持容器容积和温度不变,向容器内补充了N2 |
| D.保持容器容积和温度不变,液化分离走部分NH3 |
您最近一年使用:0次
2018-11-12更新
|
93次组卷
|
2卷引用:山西省晋中市平遥综合职业技术学校2020-2021学年高二上学期10月月考化学试题
名校
10 . 已知反应:2NO2(红棕色) N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小 ),如图2。下列说法不正确 的是
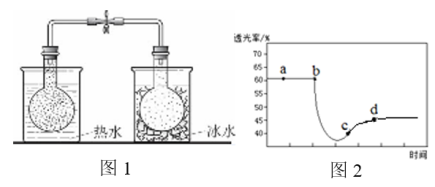
 N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验:实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(

| A.图1现象说明该反应为放热反应 |
| B.图2中b点的操作是压缩注射器 |
| C.c点:v(正)>v(逆) |
| D.若没有能量损失,考查体系温度变化,则T(d)<T(c) |
您最近一年使用:0次
2018-09-10更新
|
284次组卷
|
5卷引用:山西省晋中市祁县中学校2019-2020学年高二上学期10月月考化学试题



