解题方法
1 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 向 溶液中滴加过量氯水,再加入淀粉 溶液中滴加过量氯水,再加入淀粉 溶液 溶液 | 先变橙色,后变蓝色 | 氧化性: |
| B | 检验铁锈中是否含有二价铁 | 将铁锈溶于浓盐酸,滴入 溶液,紫色褪去 溶液,紫色褪去 | 铁锈中含有二价铁 |
| C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向 溶液中缓慢滴加硫酸溶液,黄色变为橙红色 溶液中缓慢滴加硫酸溶液,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022高三·全国·专题练习
2 . 某温度下,反应CH2=CH2(g)+H2O(g) CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
 CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是A.增大压强,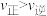 ,平衡常数增大 ,平衡常数增大 |
B.加入催化剂,平衡时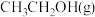 的浓度增大 的浓度增大 |
C.恒容下,充入一定量的 ,平衡向正反应方向移动 ,平衡向正反应方向移动 |
D.恒容下,充入一定量的 , , 的平衡转化率增大 的平衡转化率增大 |
您最近一年使用:0次
2022-07-04更新
|
9511次组卷
|
31卷引用:专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编
(已下线)专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)四川省成都市树德中学2022-2023学年高二上学期10月月考化学试题四川省宜宾市叙州区第一中学校2022-2023学年高二上学期第一学月考试化学试题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题七 化学反应速率与平衡天津市和平区2022-2023学年高二上学期期末质量调查化学试卷天津市和平区2022-2023学年高二上学期期末质量检测化学试题 宁夏六盘山高级中学2022-2023学年高三上学期期末考试化学试题(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省长沙市第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)专题卷11 化学反应速率与化学平衡归因分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)第13练 化学反应速率与化学平衡的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)广东省广州市第六十五中学2022-2023学年高三上学期1月月考化学试题河南省驻马店市2022-2023学年高二下学期期末考试化学试题章末检测卷(二) 化学反应速率与化学平衡(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第二章 化学反应速率与化学平衡 第二节 化学平衡 第3课时 影响化学平衡的因素(已下线)考点3 化学平衡常数及转化率的计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期第一次月考化学试题(已下线)题型13 化学平衡常数的计算及应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题1-14新疆石河子第一中学2022-2023学年高二10月月考化学试题重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题
3 . 水溶液中的离子反应与平衡在生活中应用广泛。下列说法不正确的是
A.已知人体体液中存在如下平衡:CO2+H2O H2CO3 H2CO3 H++HCO H++HCO ,当静脉滴注大量生理盐水时,平衡向右移动,体液的pH增大 ,当静脉滴注大量生理盐水时,平衡向右移动,体液的pH增大 |
B.牙齿表面覆盖的牙釉质存在如下平衡:Ca5(PO4)3OH(s) 5Ca2+(ag)+3PO 5Ca2+(ag)+3PO (aq)+OH-(aq),牙齿上残余的糖会发酵产生H+,加快牙釉质的酸蚀 (aq)+OH-(aq),牙齿上残余的糖会发酵产生H+,加快牙釉质的酸蚀 |
| C.用100mL0.01mol/L硫酸洗涤BaSO4沉淀,与用等体积的蒸馏水洗涤相比,BaSO4损失更多 |
| D.人们洗发时所用的洗发液的pH约为7.5,洗净后再使用具有保护头发、调节pH功能的护发素 |
您最近一年使用:0次
名校
4 . 某小组同学用乙醛进行银镜反应实验时,补充做了以下实验。
已知[Ag(NH3)2]+ Ag++2NH3
Ag++2NH3

下列关于该实验的分析不正确的是
已知[Ag(NH3)2]+
 Ag++2NH3
Ag++2NH3
下列关于该实验的分析不正确的是
| A.实验①无需加热,说明碱性条件有利于银氨溶液与乙醛的反应 |
B.实验①加入NaOH后,溶液中c( )增大 )增大 |
| C.实验表明,乙醛还原的是二氨合银离子中的银元素 |
| D.对比实验①和②知,形成二氨合银离子后银元素的氧化性降低 |
您最近一年使用:0次
名校
解题方法
5 . 实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是____ 。
(2)写出C中制备NaHSO3的离子方程式____ 。
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
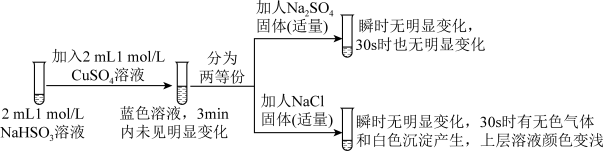
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO 的还原性
的还原性
b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_____ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
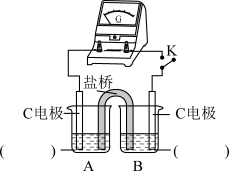
ⅰ.补全电化学装置示意图____ 。
ⅱ.写出B中的电极反应方程式____ 。
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,____ ,使HSO 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+ HAuCl4
HAuCl4
(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:____ 。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO
 的还原性
的还原性b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 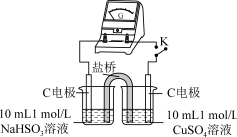 | 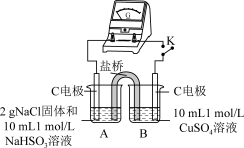 |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

ⅰ.补全电化学装置示意图
ⅱ.写出B中的电极反应方程式
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+
 HAuCl4
HAuCl4(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:
您最近一年使用:0次
名校
解题方法
6 . 某研究小组学生探究硫酸铁溶液与铜粉的反应,回答下列问题:
(1)由 固体配制
固体配制 溶液,下列图示仪器中不需要用到的有
溶液,下列图示仪器中不需要用到的有_______ (写名称)。

(2)研究小组设计如表实验,并记录实验现象:
【资料】ⅰ. 与
与 可发生氧化还原反应,也可发生配位反应生成
可发生氧化还原反应,也可发生配位反应生成 。
。
ⅱ.淡黄色、可溶的 ,与
,与 共存时溶液显绿色。
共存时溶液显绿色。
ⅲ.硫氰 的性质与卤素单质相似。
的性质与卤素单质相似。
①步骤1溶液呈浅蓝绿色时,发生反应的离子方程式是_______ 。
②经x射线衍射实验检测,步骤3中白色不溶物为CuSCN,同时有液态硫氰 生成,该反应的离子方程式是
生成,该反应的离子方程式是_______ 。
(3)某同学针对步骤4中溶液颜色变红且白色浑浊物增多的现象,提出大胆假设:当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。并做实验验证该假设:
。并做实验验证该假设:
③操作1中现象产生的可能原因是_______ 。
④操作2主要目的是_______ 。
⑤由操作3可知该同学的假设正确。操作3中 被氧化为
被氧化为 反应的离子方程式是
反应的离子方程式是_______ ,已知该反应的平衡常数 ,请用平衡移动原理解释实验1中步骤4出现相关现象的原因
,请用平衡移动原理解释实验1中步骤4出现相关现象的原因_______ 。
⑥由实验可知,影响氧化还原反应发生的因素有_______ 。
(1)由
 固体配制
固体配制 溶液,下列图示仪器中不需要用到的有
溶液,下列图示仪器中不需要用到的有
(2)研究小组设计如表实验,并记录实验现象:
| 实验1 | 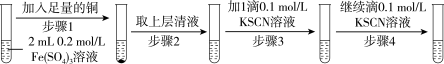 |
| 现象 | 步骤1:振荡试管后,溶液颜色呈浅蓝绿色 步骤3:溶液颜色变红,振荡试管,红色消失,并有白色沉淀产生 步骤4:溶液颜色变红,振荡试管,红色消失,白色沉淀增多 |
 与
与 可发生氧化还原反应,也可发生配位反应生成
可发生氧化还原反应,也可发生配位反应生成 。
。ⅱ.淡黄色、可溶的
 ,与
,与 共存时溶液显绿色。
共存时溶液显绿色。ⅲ.硫氰
 的性质与卤素单质相似。
的性质与卤素单质相似。①步骤1溶液呈浅蓝绿色时,发生反应的离子方程式是
②经x射线衍射实验检测,步骤3中白色不溶物为CuSCN,同时有液态硫氰
 生成,该反应的离子方程式是
生成,该反应的离子方程式是(3)某同学针对步骤4中溶液颜色变红且白色浑浊物增多的现象,提出大胆假设:当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。并做实验验证该假设:
。并做实验验证该假设:| 实验2 | 操作1 | 操作2 | 操作3 |
 | 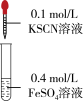 |  | |
| 现象 | 几分钟后,溶液颜色完全呈绿色。久置,溶液绿色变浅,试管底部有白色不溶物。 | 始终未见溶液颜色变红。 | 溶液颜色立刻变红,产生白色浑浊,振荡后红色消失。 |
④操作2主要目的是
⑤由操作3可知该同学的假设正确。操作3中
 被氧化为
被氧化为 反应的离子方程式是
反应的离子方程式是 ,请用平衡移动原理解释实验1中步骤4出现相关现象的原因
,请用平衡移动原理解释实验1中步骤4出现相关现象的原因⑥由实验可知,影响氧化还原反应发生的因素有
您最近一年使用:0次
2022-05-19更新
|
455次组卷
|
4卷引用:押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)
(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)江西省赣州市2021-2022学年高三下学期3月摸底考试理综化学试题 福建省泉州第五中学2021-2022学年学高三下学期化学期中考试化学试题
名校
7 . 已知反应:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
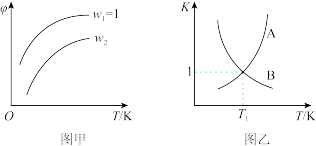
 CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
| A.图甲中W2>1 |
| B.图乙中,A线表示逆反应的平衡常数 |
| C.温度为T1,W=2时,Cl2的转化率为50% |
| D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强增大 |
您最近一年使用:0次
2022-05-18更新
|
1101次组卷
|
25卷引用:湖北省黄冈市2018届高三上学期元月调研考试理综化学试题
湖北省黄冈市2018届高三上学期元月调研考试理综化学试题(已下线)2019年9月27日 《每日一题》2020年高考一轮复习-化学平衡常数和转化率(已下线)专题7.3 化学平衡常数 化学反应进行的方向(练)-《2020年高考一轮复习讲练测》鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)安徽省舒城中学2021-2022学年高二上学期第二次月考化学试题山东省实验中学2021-2022学年高三上学期第二次诊断考试化学试题安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)河南省实验中学2021-2022学年高三上学期期末考试化学试题陕西宝鸡市眉县槐芽中学2022-2023学年高二上学期期中考试化学试题(已下线)第七章 化学反应速率与化学平衡 第42练 化学平衡常数及转化率的计算河北省衡水中学2023届高三下学期第五次综合素养测评化学试题(已下线)考点23 化学平衡常数(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第三次月考化学试题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)湖北省恩施咸丰春晖学校2021-2022学年高二上学期第一次月考化学试题广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题湖南省张家界市2023届高三下学期模拟考试化学试题安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题江西省宜春市丰城中学2023-2024学年高二下学期开学考试化学试题
8 . 某温度下,改变0.1mol/L 溶液的pH时,各种含铬元素粒子及
溶液的pH时,各种含铬元素粒子及 浓度变化如图所示(已知
浓度变化如图所示(已知 a是二元酸),下列有关说法正确的是
a是二元酸),下列有关说法正确的是

 溶液的pH时,各种含铬元素粒子及
溶液的pH时,各种含铬元素粒子及 浓度变化如图所示(已知
浓度变化如图所示(已知 a是二元酸),下列有关说法正确的是
a是二元酸),下列有关说法正确的是
A.该温度下的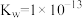 |
B.溶液中存在平衡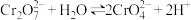 ,且该温度下此反应的平衡常数 ,且该温度下此反应的平衡常数 |
C.E点溶液中存在: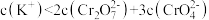 |
D.向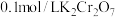 溶液中,加入一定量NaOH固体,溶液橙色加深 溶液中,加入一定量NaOH固体,溶液橙色加深 |
您最近一年使用:0次
名校
9 . 为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如图所示。

查阅资料,平衡I:Cu(OH)2+4NH3⇌[Cu(NH3)4]2++2OH-;
平衡II:Cu(OH)2+2OH-⇌[Cu(OH)4]2−
下列说法不正确 的是

| 项目 | 废水水质 | 排放标准 |
| pH | 1.0 | 6~9 |
| Cu2+/mg∙L-1 | 72 | ≤0.5 |
NH /mg∙L-1 /mg∙L-1 | 2632 | ≤15 |
平衡II:Cu(OH)2+2OH-⇌[Cu(OH)4]2−
下列说法
| A.废水中Cu2+处理的最佳pH约为9 |
| B.b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,上层清液中铜元素含量上升 |
| C.c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,上层清液中铜元素含量下降 |
| D.d点以后,随c(OH-)增加,上层清液中铜元素含量可能上升 |
您最近一年使用:0次
2022-05-02更新
|
308次组卷
|
5卷引用:北京市首都师大附中2021-2022学年高二下学期期中考试化学试题
北京市首都师大附中2021-2022学年高二下学期期中考试化学试题(已下线)卷01 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市北京师范大学附属中学2022-2023学年高二上学期期中考试化学试题北京市第十一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
10 . 10mL0.1mol•L-1KI溶液与5mL0.1mol•L-1FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq)⇌2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是
| A.加入少量氯化钾固体,平衡不移动 |
| B.加适量水稀释,平衡正向移动 |
| C.经过CCl4多次萃取分离后,向水溶液中滴加KSCN溶液,若溶液出现血红色,证明该反应是可逆反应 |
D.该反应的平衡常数K=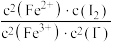 |
您最近一年使用:0次
2022-04-01更新
|
494次组卷
|
12卷引用:第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测
(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)课时3影响化学平衡的因素随堂练习浙江省2021届高三下学期3月联考化学试题(已下线)浙江省“超级全能生”2021年3月高考选考科目联考化学试题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)



