2023·江苏连云港·模拟预测
名校
1 . 下列物质性质与用途具有对应关系的是
| A.FeS具有氧化性,可用于制取硫酸 |
B. 不溶于水,可以作半导体材料 不溶于水,可以作半导体材料 |
C. 具有还原性,可用于漂白某些有色物质 具有还原性,可用于漂白某些有色物质 |
D. 具有难挥发性,可用于制取挥发性酸 具有难挥发性,可用于制取挥发性酸 |
您最近半年使用:0次
2023高三·全国·专题练习
解题方法
2 . 钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
一种从该钒精矿中提取五氧化二钒的流程如下:
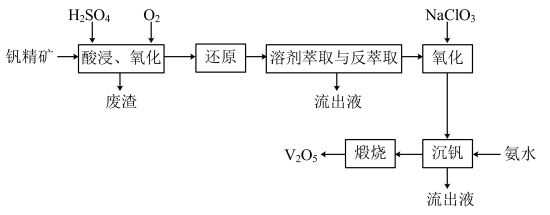
(1)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用___________ (填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是___________
(2)“溶剂萃取与反萃取”可表示为:VO2++(HR2PO4)2(O) (VOR2PO4)2(O)+2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈
(VOR2PO4)2(O)+2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈___________ 性(填“酸”“碱”或“中”)。
| 物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
| 质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |

(1)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用
(2)“溶剂萃取与反萃取”可表示为:VO2++(HR2PO4)2(O)
 (VOR2PO4)2(O)+2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈
(VOR2PO4)2(O)+2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈
您最近半年使用:0次
解题方法
3 . 工业上以铬铁矿(主要成分为 ,含Al、Si氧化物等杂质)为主要原料制备红矾钠
,含Al、Si氧化物等杂质)为主要原料制备红矾钠 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:

(1) 中Fe元素的化合价
中Fe元素的化合价___________ ,焙烧的目的是将 转化为
转化为 并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是___________ 。
(2)滤渣2的成分___________ (填化学式)滤渣提纯后的用途___________ 。
(3)加入 酸化的作用是
酸化的作用是___________ (结合化学用语简述)。
(4)蒸发结晶时,过度蒸发将导致___________
(5)该小组用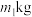 铬铁矿(
铬铁矿( 的质量分数60%)制备
的质量分数60%)制备 ,最终得到产品
,最终得到产品 ,产率为
,产率为___________ (列出计算式)
 ,含Al、Si氧化物等杂质)为主要原料制备红矾钠
,含Al、Si氧化物等杂质)为主要原料制备红矾钠 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:
(1)
 中Fe元素的化合价
中Fe元素的化合价 转化为
转化为 并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是(2)滤渣2的成分
(3)加入
 酸化的作用是
酸化的作用是(4)蒸发结晶时,过度蒸发将导致
(5)该小组用
 铬铁矿(
铬铁矿( 的质量分数60%)制备
的质量分数60%)制备 ,最终得到产品
,最终得到产品 ,产率为
,产率为
您最近半年使用:0次
4 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
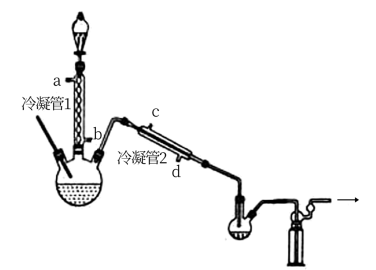
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2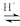
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
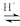
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近半年使用:0次
名校
解题方法
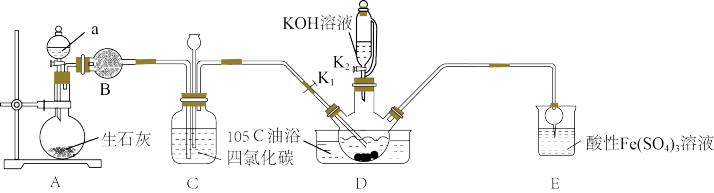
5 . 硫氰酸钾(KSCN),是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
已知:① 不溶于
不溶于 和
和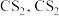 不溶于水且密度比水大;
不溶于水且密度比水大;
②D中三颈烧瓶内盛放 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃时易分解,
在高于170℃时易分解, 在高于25℃时即分解。
在高于25℃时即分解。
回答下列问题:
(1)试剂a是____ ,装置D中盛装KOH溶液的仪器名称是_______ 。
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是___ 。
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是___ 。
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经___ (填操作名称)、减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰酸钾晶体。
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因___ 。
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:____ 。

已知:①
 不溶于
不溶于 和
和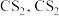 不溶于水且密度比水大;
不溶于水且密度比水大;②D中三颈烧瓶内盛放
 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃时易分解,
在高于170℃时易分解, 在高于25℃时即分解。
在高于25℃时即分解。回答下列问题:
(1)试剂a是
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:
您最近半年使用:0次
2021-03-11更新
|
1364次组卷
|
7卷引用:辽宁省葫芦岛市2021届高三第二次模拟考试化学试题
辽宁省葫芦岛市2021届高三第二次模拟考试化学试题(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)山东省潍坊市2021届高三第一次模拟考试化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)福建省厦门外国语学校2021届高三5月高考适应性考试化学试题(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】
21-22高三上·云南普洱·期末
名校
解题方法
6 . 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。

(1)还原沉淀法是处理含Cr2O 和CrO
和CrO 工业废水的一种常用方法,其工艺流程为:CrO
工业废水的一种常用方法,其工艺流程为:CrO
 Cr2O
Cr2O
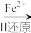 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第Ⅰ步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
①若平衡体系的pH=0,该溶液显___________ 色。
②根据2CrO +2H+
+2H+ Cr2O
Cr2O +H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为___________ ,图中右侧电极连接电源的___________ 极,其电极反应式为___________ 。
③第Ⅱ步反应的离子方程式:___________ 。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4=□Cr2(SO4)3+□CH3COOH+□_______

(1)还原沉淀法是处理含Cr2O
 和CrO
和CrO 工业废水的一种常用方法,其工艺流程为:CrO
工业废水的一种常用方法,其工艺流程为:CrO
 Cr2O
Cr2O
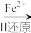 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓其中第Ⅰ步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O①若平衡体系的pH=0,该溶液显
②根据2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为③第Ⅱ步反应的离子方程式:
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4=□Cr2(SO4)3+□CH3COOH+□
您最近半年使用:0次
名校
解题方法
7 . 钒及其化合物在工业上有许多用途。从废钒(主要成分V2O3、V2O5、Fe2O3、FeO、SiO2)中提取五氧化二钒的一种工艺流程如图。

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中V2O3转化为VO2+,反应的离子方程式为_______ ,若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为_____________ 。
(2)萃取前用“铁粉”对浸出液进行处理,主要目的是_________ ,为检验处理后的浸出液中是否含有Fe3+,可选用的化学试剂是______ (填试剂名称)。
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R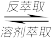 VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用____
a.NaCl b.NaOH c.H2SO4
(4)反萃取后的水层中加KClO3,使VO2+变为VO ,ClO
,ClO 变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为
变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为_________ mol。
(5)已知NH4VO3难溶于水,Ksp=3.0×10﹣8,向10mL 0.2mol•L﹣1 NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为_______________ (溶液中某离子浓度≤1×10﹣5mol•L﹣1时,认为该离子沉淀完全)。

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中V2O3转化为VO2+,反应的离子方程式为
(2)萃取前用“铁粉”对浸出液进行处理,主要目的是
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R
 VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用a.NaCl b.NaOH c.H2SO4
(4)反萃取后的水层中加KClO3,使VO2+变为VO
 ,ClO
,ClO 变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为
变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为(5)已知NH4VO3难溶于水,Ksp=3.0×10﹣8,向10mL 0.2mol•L﹣1 NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为
您最近半年使用:0次
名校
8 . 碳酸二甲酯【CO(OCH3)2】是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成:CO2+2CH3OH→CO(OCH3)2+H2O。某研究小组在某温度下,在0.1L恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。下列说法不正确的是


| A.在该温度下,最佳反应时间是10h |
| B.4~10h内碳酸二甲酯的平均反应速率是7.5×10-4mol·L-1·h-1 |
| C.向反应体系中添加催化剂,一定能提高反应的TON |
| D.该合成方法可以利用廉价的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面具有重要意义 |
您最近半年使用:0次
2019-02-05更新
|
567次组卷
|
4卷引用:(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第3节 化学反应的快慢和限度 第1课时 化学反应的快慢
(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第3节 化学反应的快慢和限度 第1课时 化学反应的快慢【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99
9 . 铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I.还原沉淀法是处理含CrO42-和Cr2O72-工业废水的一种常用方法,其工艺流程如下:
其中,第I步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系中,pH=0时溶液呈______ 色。
(2)以石墨为电极,电解Na2CrO4制备Na2CrO7的装置如图所示,a极的名称是_______ ;第I步中b极直接相连一极的反应式为_______________ 。
(3)第II步的离子方程式为______________ ;向第II步反应后的溶液中加入一定量烧碱,若溶液中c(Fe3+)=2.0×10-12mol/L,则溶液中c(Cr3+)=_______ mol/L。
(已知:Ksp[Fe(OH)3]=4.0×10-38mol/L,Ksp[Cr(OH)3]=6.0×10-31mol/L)
II.探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛然反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:a CrO3+bC2H5OH+cH2SO4=d Cr2(SO4)3+eCH3COOH+fR
b:c:f=_________ 。
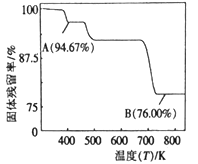
(5)CrO3的热稳定性差,加热时逐步分解,其固体残解率随温度的变化如图所示。B点时生成固体的化学式为______ 。( )。
)。
I.还原沉淀法是处理含CrO42-和Cr2O72-工业废水的一种常用方法,其工艺流程如下:

其中,第I步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)若平衡体系中,pH=0时溶液呈
(2)以石墨为电极,电解Na2CrO4制备Na2CrO7的装置如图所示,a极的名称是

(3)第II步的离子方程式为
(已知:Ksp[Fe(OH)3]=4.0×10-38mol/L,Ksp[Cr(OH)3]=6.0×10-31mol/L)
II.探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛然反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:a CrO3+bC2H5OH+cH2SO4=d Cr2(SO4)3+eCH3COOH+fR
b:c:f=
(5)CrO3的热稳定性差,加热时逐步分解,其固体残解率随温度的变化如图所示。B点时生成固体的化学式为
 )。
)。
您最近半年使用:0次
解题方法
10 . 化学反应原理在工业生产中有广泛的应用。
(1)工业合成氨气的氢气主要来自天然气与水的反应, 但这种原料气中含有CO杂质,工业生产中通过下列反应来实现原料气中CO的除去。
CO(g)+H2O(g) CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取
CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取_____ 措施可提高CO的转化率。在容积为2L的容器中发生上述反应,其中c(CO2)与反应时间(t)的关系如图甲所示,在t0时刻将容器体积扩大至4L,在图甲中画出t0时刻后。c(CO2)与反应时间(t)的变化曲线_____ 。
(2)氨气的重要用途是合成尿素. 当加料比n(NH3)/n(CO2)=4时,CO2的转化率变化如图乙所示,a点v(CO2)逆______ 点v(CO2)正(填“大于”、“小于”或“等于”)。NH3的平衡转化率是______ 。
(3)某科研小组利用CO和H2在密闭容器中反应合成甲醇的实验,容器的开始体积是VL,实验中向容器中加入CO nmol, H22nmol,在一定的压强和催化剂的作用下反应:CO (g)+ 2H2(g) CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
①上述合成甲醇的反应是______ (填 “吸热”或“放热”)反应,图象中的压强p1、p2、p3的大小关系是_______ 。
②由图象分析压强p1温度是100℃时合成甲醇反应的平衡常数K=_______ 。
③在压强是p1温度是100℃的条件下,开始若向容器中加入CO 2nmol,H24nmol,反应达到平衡时CO的转化率_____ (填“变大”、“变小”或“不变”),平衡时CO的物质的量_____ (填“大于”、“小于”或“等于”)nmol
(1)工业合成氨气的氢气主要来自天然气与水的反应, 但这种原料气中含有CO杂质,工业生产中通过下列反应来实现原料气中CO的除去。
CO(g)+H2O(g)
 CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取
CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取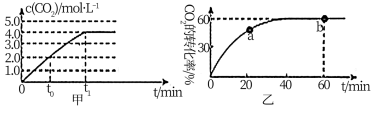
(2)氨气的重要用途是合成尿素. 当加料比n(NH3)/n(CO2)=4时,CO2的转化率变化如图乙所示,a点v(CO2)逆
(3)某科研小组利用CO和H2在密闭容器中反应合成甲醇的实验,容器的开始体积是VL,实验中向容器中加入CO nmol, H22nmol,在一定的压强和催化剂的作用下反应:CO (g)+ 2H2(g)
 CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。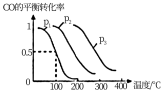
①上述合成甲醇的反应是
②由图象分析压强p1温度是100℃时合成甲醇反应的平衡常数K=
③在压强是p1温度是100℃的条件下,开始若向容器中加入CO 2nmol,H24nmol,反应达到平衡时CO的转化率
您最近半年使用:0次



