1 . 下列有关说法正确的是
| A.电器设备着火时,可使用二氧化碳灭火器,不可使用泡沫灭火器 |
| B.制备Fe(OH)3胶体时,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| C.分离硝酸钾和氯化钠的固体混合物( 物质的量之比为1:1)的流程:溶解→蒸发浓缩→趁热过滤→KNO3 固体→滤液冷却结晶→减压过滤得NaCl |
| D.在中和热的测定实验中,将氢氧化钠和盐酸混合后,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
您最近一年使用:0次
2 . 下列有关化学平衡的说法正确的是
A.对于恒温密闭容器中进行的反应N2(g)+3H2(g) 2NH3(g),若N2的体积分数保持不变,则一定说明反应已达到平衡状态 2NH3(g),若N2的体积分数保持不变,则一定说明反应已达到平衡状态 |
| B.一定温度下,将2.0g CaCO3固体置于1L恒容密闭容器中充分反应后,c(CO2)=0.0125mol/L,若保持温度不变,将容器体积扩大至2L,达到新平衡后c(CO2)=0.01mol/L |
C.反应:CH4(g)+H2O(g) CO(g)+3H2(g) ∆H>0,在其它条件不变的情况下,升高温度、减小容器体积、增大水蒸气的浓度均能提高CH4的平衡转化率 CO(g)+3H2(g) ∆H>0,在其它条件不变的情况下,升高温度、减小容器体积、增大水蒸气的浓度均能提高CH4的平衡转化率 |
D.一定温度下,恒容密闭容器中充入一定量NO2发生反应:2NO2 N2O4达到平衡后,再向容器中充入一定量的NO2并达到新的平衡,则NO2体积分数先增大后减小,但比原平衡小 N2O4达到平衡后,再向容器中充入一定量的NO2并达到新的平衡,则NO2体积分数先增大后减小,但比原平衡小 |
您最近一年使用:0次
3 . 丙烯酸是非常重要的化工原料之一,可用甘油催化转化如下:甘油(C3H8O3)→丙烯醛(C3H4O)→丙烯酸(C3H4O2)。
已知:反应I:C3H8O3(g) C3H4O(g)+2H2O(g) △H1>0 Ea1(活化能)
C3H4O(g)+2H2O(g) △H1>0 Ea1(活化能)
反应II:2C3H4O(g)+O2(g) 2C3H4O2(g) △H2<0 Ea2(活化能)
2C3H4O2(g) △H2<0 Ea2(活化能)
甘油常压沸点为290℃,工业生产选择反应温度为300℃常压下进行。下列说法不正确 的是
已知:反应I:C3H8O3(g)
 C3H4O(g)+2H2O(g) △H1>0 Ea1(活化能)
C3H4O(g)+2H2O(g) △H1>0 Ea1(活化能)反应II:2C3H4O(g)+O2(g)
 2C3H4O2(g) △H2<0 Ea2(活化能)
2C3H4O2(g) △H2<0 Ea2(活化能)甘油常压沸点为290℃,工业生产选择反应温度为300℃常压下进行。下列说法
| A.当H2O的体积分数保持不变,说明反应达到平衡状态 |
| B.固体催化剂一定时,增加其表面积可提高化学反应速率,增大甘油的平衡转化率 |
| C.丙烯醛有毒,为了工业生产安全可选择能大幅降低Ea2且对Ea1几乎无影响的催化剂 |
| D.若改变条件增大反应II的平衡常数,反应II一定向正反应方向移动,且平衡移动过程中逆反应速率先减小后增加 |
您最近一年使用:0次
解题方法
4 . 研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
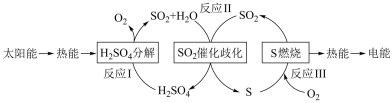
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为________ 。
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___

A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
归纳出分离 H2的次数对 HI 转化率的影响________ 。第 2 次平衡时 I2的物质的量为 n(I2)=_____ mol;
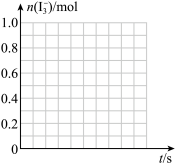
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌ (aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中 的物质的量 n( I3- )随反应时间 t 变化的曲线图
的物质的量 n( I3- )随反应时间 t 变化的曲线图____ 。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:

①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是

A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
| 达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
| n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2的次数对 HI 转化率的影响
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌
 (aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中 的物质的量 n( I3- )随反应时间 t 变化的曲线图
的物质的量 n( I3- )随反应时间 t 变化的曲线图
您最近一年使用:0次
名校
5 . K2Cr2O7溶液中存在平衡: 。用K2Cr2O7溶液进行下列实验。下列说法错误的是
。用K2Cr2O7溶液进行下列实验。下列说法错误的是

 。用K2Cr2O7溶液进行下列实验。下列说法错误的是
。用K2Cr2O7溶液进行下列实验。下列说法错误的是
A.①中 和 和 浓度相等说明反应达平衡 浓度相等说明反应达平衡 |
| B.①中溶液橙色加深,③中溶液变黄 |
C.②中 被C2H5OH还原为Cr3+ 被C2H5OH还原为Cr3+ |
| D.若向④中加入70%H2SO4溶液至过量,溶液变为绿色 |
您最近一年使用:0次
2021-06-11更新
|
307次组卷
|
4卷引用:07-2023新东方高二上期中考化学
07-2023新东方高二上期中考化学天津市北辰区2021届高三一模考试化学试题(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江西省吉安市第一中学2021-2022学年度高二上学期开学考试化学试题
6 . T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:
 ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
下列说法不正确 的是

 ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
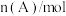 | 0.80 | 0.60 | 0.48 |  |  |
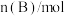 | 0.00 | 0.20 | 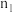 | 0.40 | 0.40 |
| A.该反应在30min时已达到平衡 |
B.反应在前20min的平均速率为 |
C.保持其他条件不变,升高温度,平衡时, ,则 ,则 |
| D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正 |
您最近一年使用:0次
解题方法
7 . H2S催化分解过程中通入CO2、CH4会发生如下反应,下列说法不正确 的是
A.CH4(g)+CO2(g) 2H2(g)+2CO(g)压缩容器体积,平衡转化率将增大 2H2(g)+2CO(g)压缩容器体积,平衡转化率将增大 |
B.H2S(g)+CO2(g) H2O(g)+COS(g)通入CO2,将促进反应的进行 H2O(g)+COS(g)通入CO2,将促进反应的进行 |
C.已知2H2S(g)+CH4(g) 4H2(g)+CS2(g) △H>0,则该反应在高温下易自发 4H2(g)+CS2(g) △H>0,则该反应在高温下易自发 |
D.2H2S(g) 2H2(g)+S(g) △H>0 2H2(g)+S(g) △H>0 |
您最近一年使用:0次
8 . 一定条件下,在容积恒定的密闭容器中,加入2molCH4和2molH2O,发生如下反应:CH4(g)+H2O(g) CO(g)+3H2(g),ΔH=akJ·mol−1(a>0)。下列说法不正确的是( )
CO(g)+3H2(g),ΔH=akJ·mol−1(a>0)。下列说法不正确的是( )
 CO(g)+3H2(g),ΔH=akJ·mol−1(a>0)。下列说法不正确的是( )
CO(g)+3H2(g),ΔH=akJ·mol−1(a>0)。下列说法不正确的是( )| A.当容器内H2的物质的量n(H2)=3mol时,反应放出热量akJ |
| B.当CH4与H2的反应速率3v正(CH4)=v逆(H2)时,反应达到化学平衡状态 |
| C.若保持温度不变,当容器内气压不再变化时,反应达到化学平衡状态 |
| D.反应达到化学平衡状态后,再加入1molH2O,CH4的体积分数φ(CH4)将减小 |
您最近一年使用:0次
解题方法
9 . 硫化氢分解制取氢气和硫磺的反应原理为2H2S(g) S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
下列说法不正确 的是
 S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:| n/mol t/min | n(H2S) | n(S2) | n(H2) |
| 0 | 2.0 | 0 | 0 |
| 2 | 1.0 | ||
| 4 | 0.8 | ||
| 6 | 0.6 |
| A.0~2min 生成H2的平均反应速率为0.25 mol·L-1·min-1 |
| B.上述反应的平衡常数K=0.675 |
| C.3分钟时,H2S的分解率一定小于60% |
| D.平衡后,向容器中通入少量O2,平衡正向移动 |
您最近一年使用:0次
21-22高二上·浙江·期中
10 . 下列有关实验说法,不正确的是
| A.在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在隔热的容器中快速混合,并不断搅拌,用温度计测量混合液的最高温度 |
| B.利用锥形瓶、气球、碳酸氢钠粉末和不同浓度的盐酸进行实验,观察气球膨胀的快慢以说明浓度对反应速率的影响 |
| C.观察滴定管刻度读数时,应在装液或放液后立即读数,且精确到小数点后两位 |
D.增大H+浓度,平衡2 +2H+⇌ +2H+⇌ +H2O向右移动,溶液的颜色由黄色变为橙色 +H2O向右移动,溶液的颜色由黄色变为橙色 |
您最近一年使用:0次



