名校
1 . Ⅰ.实验室用如图所示简易量热计进行中和热的测定实验,请回答。
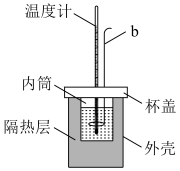
(1)图中仪器b的名称是_______ ;
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式_______ ;
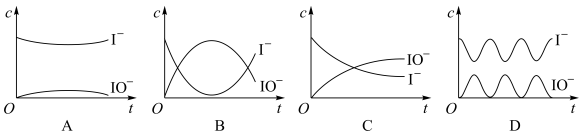
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为_______ ,决定总反应速率的是第_______ 步基元反应。
(4)反应过程中I-和IO-的浓度变化趋势为_______ 。
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g) S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
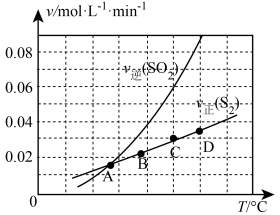
(5)A、B、C、D四点对应的状态中,达到平衡状态的有_______ (填字母)。
(6)该反应的△H_______ 0(填>、<或=)。
(7)下列措施能够增大SO2平衡转化率的是_______。

(1)图中仪器b的名称是
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①H2O2+I-→H2O+IO-
②H2O2+IO-→H2O+O2+I-
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为
(4)反应过程中I-和IO-的浓度变化趋势为

Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g)
 S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
(5)A、B、C、D四点对应的状态中,达到平衡状态的有
(6)该反应的△H
(7)下列措施能够增大SO2平衡转化率的是_______。
| A.降温 | B.增加C(s)的量 |
| C.减小容器体积 | D.恒压通入一定量SO2 |
您最近半年使用:0次
名校
2 . 下列实验操作、现象、结论均正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入适量KCl固体 Fe(SCN)3+3KCl中加入适量KCl固体 | 溶液的颜色变浅 | 平衡逆向移动 |
| B | 对平衡体系2NO2(g) N2O4(g)压缩体积,增大压强 N2O4(g)压缩体积,增大压强 | 混合气体的颜色变深 | 平衡逆向移动 |
| C | 2mL0.1mol•L-1K2Cr2O7溶液中存在:Cr2O (橙色)+H2O (橙色)+H2O 2CrO 2CrO (黄色)+2H+,向其中滴加5~10滴6mol•L-1NaOH溶液 (黄色)+2H+,向其中滴加5~10滴6mol•L-1NaOH溶液 | 溶液变为橙色 | 平衡逆向移动 |
| D | 分别取5mL0.5mol·L-1H2SO4溶液和5mL0.1mol·L-1H2SO4溶液于两支试管中,然后同时加入5mL0.1mol·L-1Na2S2O3溶液 | 两支试管中的溶液都变浑浊,前者先变浑浊 | 增大H2SO4浓度,可以加快反应速率 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 氯化硫酰(SO2Cl2)常用作氧化剂,它是一种无色液体,熔点:-54.1℃,沸点:69.1℃,可用干燥的SO2和Cl2在活性炭作催化剂的条件下制取:SO2(g)+Cl2(g)⇌SO2Cl2(l) ΔH=-97.3kJ·mol-1。下列有关SO2Cl2制取的说法正确的是
| A.该反应在高温下能自发进行 |
| B.使用活性炭作催化剂能缩短该反应达平衡的时间 |
| C.化学平衡发生移动,该反应平衡常数必发生变化 |
| D.使SO2Cl2液化从平衡体系中分离,能加快正反应速率,增大Cl2转化率 |
您最近半年使用:0次
名校
4 . 研究表明,通过碘循环系统(如图)可以吸收工业废气中的SO2制备一种重要的化工原料A,同时完成氢能源再生。下列说法不正确的是( )


| A.A为硫酸 |
| B.I2在整个循环系统中做催化剂 |
| C.该系统发生的总反应为:2H2O+SO2+I2=H2SO4+2HI |
| D.不断分离出H2,有利于HI的分解 |
您最近半年使用:0次



