1 . 二氧化铈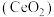 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成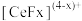 ,也能与
,也能与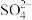 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)氧化焙烧中氧化的目的是_______ 。
(2)“萃取”时存在反应: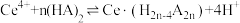 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比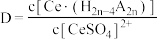 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因:_______ 。 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:_______ 。
(4)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于_______ 时, 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)
(5)“氧化”步骤中氧化剂与还原剂物质的量之比为_______ 。
(6) 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式_______ 。
(7)氧化铈 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率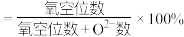 )
) 点原子的分数坐标为
点原子的分数坐标为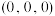 ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
② 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为_______ 。
③ 晶体的密度为
晶体的密度为_______ (只需列出表达式)。
④若掺杂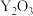 后得到
后得到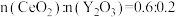 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为_______ 。
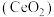 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: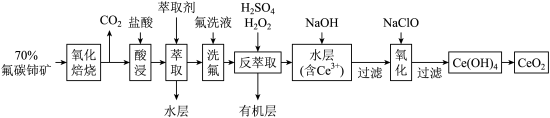
 能与
能与 结合成
结合成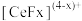 ,也能与
,也能与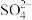 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)氧化焙烧中氧化的目的是
(2)“萃取”时存在反应:
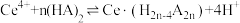 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比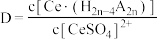 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因: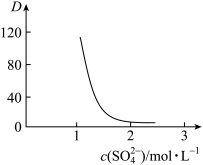
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(4)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)(5)“氧化”步骤中氧化剂与还原剂物质的量之比为
(6)
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式(7)氧化铈
 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂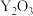 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率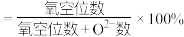 )
)
 点原子的分数坐标为
点原子的分数坐标为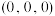 ,则
,则 点原子的分数坐标为
点原子的分数坐标为②
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为③
 晶体的密度为
晶体的密度为④若掺杂
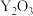 后得到
后得到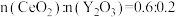 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近半年使用:0次
名校
2 . 下列有关实验探究方案设计合理的是
| 选项 | 实验方案 | 实验目的 |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,观察气体产生的速率 | 比较Cu2+和Fe3+的催化效果 |
| B | 先将注射器充满NO2气体,然后将活塞往里推,压缩体积,观察注射器内气体颜色先变深后变浅 | 验证压强对平衡的影响 |
| C | 在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL1mol·L-1和40mL18mol·L-1的硫酸,比较两者收集10mL氢气所用的时间
| 探究硫酸浓度对反应速率的影响 |
| D | 在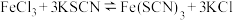 平衡体系中加入KCl晶体,观察并比较实验现象 平衡体系中加入KCl晶体,观察并比较实验现象 | 探究离子浓度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
3 . 石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并利用。
(1)热分解法: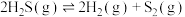
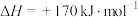 ,工业上,通常在等温、等用条件下将
,工业上,通常在等温、等用条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会___________ (填“增大”、“减小”或“不变”)。
(2)氧化法: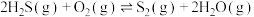
已知: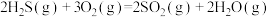
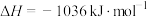
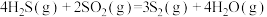
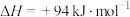
无催化剂条件下,混合加热 与
与 ,探究相同时间内
,探究相同时间内 (g)产率影响因素。
(g)产率影响因素。
①用氧化法处理 ,若生成1mol
,若生成1mol  (g),放出热量为
(g),放出热量为___________ kJ。
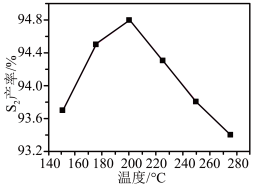
②其他条件相同时, 产率随温度的变化如图所示。随着温度升高,
产率随温度的变化如图所示。随着温度升高, (g)产率先增大后减小,原因是
(g)产率先增大后减小,原因是___________ 。
③其他条件相同时, (g)产率随
(g)产率随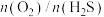 值的变化如图所示。
值的变化如图所示。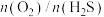 值过高不利于提高
值过高不利于提高 (g)产率,可能的原因是
(g)产率,可能的原因是___________ 。
(3)微电池法:利用电化学原理去除天然气中的 ,装置如图所示,总反应是:
,装置如图所示,总反应是: 。
。
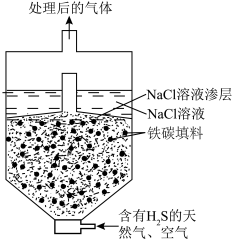
①写出负极的电极反应式___________ 。
②一段时间后,单位时间内 的去除率降低,其可能的原因是
的去除率降低,其可能的原因是___________ 。
(4)硫酸钙吸收法:如图为 反应体系在不同温度、不同
反应体系在不同温度、不同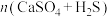 物质的量比的物相变化图。
物质的量比的物相变化图。
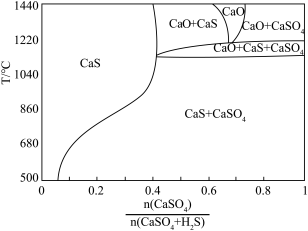
①用斜线在图中画出 可以完全转化并且有CaO生成的区域
可以完全转化并且有CaO生成的区域___________ 。
②若不通入 ,简述
,简述 随温度升高分解的规律
随温度升高分解的规律___________ 。
(1)热分解法:
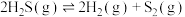
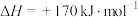 ,工业上,通常在等温、等用条件下将
,工业上,通常在等温、等用条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会(2)氧化法:
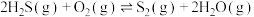
已知:
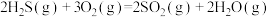
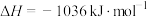
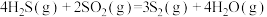
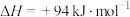
无催化剂条件下,混合加热
 与
与 ,探究相同时间内
,探究相同时间内 (g)产率影响因素。
(g)产率影响因素。①用氧化法处理
 ,若生成1mol
,若生成1mol  (g),放出热量为
(g),放出热量为②其他条件相同时,
 产率随温度的变化如图所示。随着温度升高,
产率随温度的变化如图所示。随着温度升高, (g)产率先增大后减小,原因是
(g)产率先增大后减小,原因是
③其他条件相同时,
 (g)产率随
(g)产率随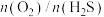 值的变化如图所示。
值的变化如图所示。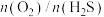 值过高不利于提高
值过高不利于提高 (g)产率,可能的原因是
(g)产率,可能的原因是
(3)微电池法:利用电化学原理去除天然气中的
 ,装置如图所示,总反应是:
,装置如图所示,总反应是: 。
。
①写出负极的电极反应式
②一段时间后,单位时间内
 的去除率降低,其可能的原因是
的去除率降低,其可能的原因是(4)硫酸钙吸收法:如图为
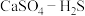 反应体系在不同温度、不同
反应体系在不同温度、不同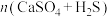 物质的量比的物相变化图。
物质的量比的物相变化图。
①用斜线在图中画出
 可以完全转化并且有CaO生成的区域
可以完全转化并且有CaO生成的区域②若不通入
 ,简述
,简述 随温度升高分解的规律
随温度升高分解的规律
您最近半年使用:0次
解题方法
4 . 利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比
2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
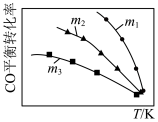
 2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比
2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.若m=2,反应达平衡时,NO的转化率为40%,则N2的体积分数为15.4% |
B.该反应的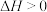 |
C.投料比: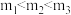 |
| D.汽车排气管中的催化剂可提高NO的平衡转化率 |
您最近半年使用:0次
5 . 在2L恒容密闭容器中充入2mol X和1mol Y发生反应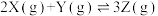
 ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断错误的是
,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断错误的是

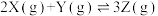
 ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断错误的是
,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断错误的是
| A.Q点时,Y的转化率最大 |
| B.W点X的正反应速率小于M点X的正反应速率 |
| C.升高温度,平衡向左移动,平衡常数减小 |
| D.平衡时充入Y,达到新平衡时Y的转化率比原平衡时大 |
您最近半年使用:0次
解题方法
6 . 回答下列问题。
(1)工业合成氨的反应: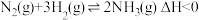 ,分别在
,分别在 、
、 温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
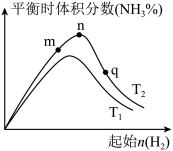
①比较在m、n、q三点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是___________ 点。
② 条件下,在
条件下,在 的密闭容器中,充入
的密闭容器中,充入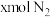 和
和 时,
时,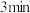 达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):
达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):
___________ ;该反应的平衡常数的值
___________ 。
③图像中
___________  (填“高于”、“低于”、“等于”或“无法确定”)。
(填“高于”、“低于”、“等于”或“无法确定”)。
(2)一定温度下,在密闭容器中将等物质的量的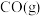 和
和 混合,采用适当的催化剂进行反应
混合,采用适当的催化剂进行反应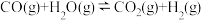 ,已知此温度下,该反应的平衡常数
,已知此温度下,该反应的平衡常数 ,则平衡时体系中
,则平衡时体系中 的物质的量分数为
的物质的量分数为___________  。
。
(1)工业合成氨的反应:
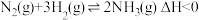 ,分别在
,分别在 、
、 温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
①比较在m、n、q三点所处的平衡状态中,反应物
 的转化率最高的是
的转化率最高的是②
 条件下,在
条件下,在 的密闭容器中,充入
的密闭容器中,充入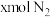 和
和 时,
时,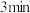 达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):
达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):

③图像中

 (填“高于”、“低于”、“等于”或“无法确定”)。
(填“高于”、“低于”、“等于”或“无法确定”)。(2)一定温度下,在密闭容器中将等物质的量的
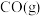 和
和 混合,采用适当的催化剂进行反应
混合,采用适当的催化剂进行反应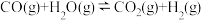 ,已知此温度下,该反应的平衡常数
,已知此温度下,该反应的平衡常数 ,则平衡时体系中
,则平衡时体系中 的物质的量分数为
的物质的量分数为 。
。
您最近半年使用:0次
7 . 下列事实不能 用勒夏特列原理来解释的是
| A.实验室中常用排饱和食盐水的方法收集Cl2 |
| B.鼓入过量空气有利于SO2转化为SO3 |
| C.开启啤酒瓶后,压强变小,瓶中立刻泛起大量泡沫 |
| D.煅烧硫铁矿时先将矿石粉碎 |
您最近半年使用:0次
名校
8 . 下述反应可制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
 MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是| A.恒温时,增大压强平衡逆向移动,平衡常数减小 |
| B.容积不变时,升高温度,混合气体的平均相对分子质量减小 |
| C.恒温恒容时,分离出部分CO2气体可提高MgSO4的转化率 |
D.恒温恒容时,冲入CO气体,达到新平衡时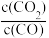 增大 增大 |
您最近半年使用:0次
解题方法
9 . 某学习小组欲利用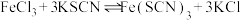 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变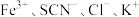 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是___________ (填A或B)。原因是:___________ 。
(2)取 溶液X,加入5滴
溶液X,加入5滴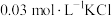 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:①___________ 对平衡产生了影响;②不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.为了探究KCl对 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
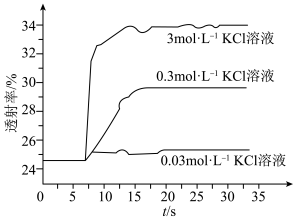
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响___________ 移动(填“正向、逆向或不”)。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:___________ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:
a.溶液中的 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②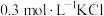 溶液、③
溶液、③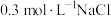 溶液、④
溶液、④ 溶液、⑤
溶液、⑤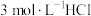 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
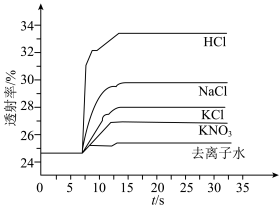
上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是___________ 。盐效应影响较大的阳离子是___________ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)已知 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:___________ 。
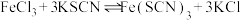 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
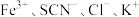 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是(2)取
 溶液X,加入5滴
溶液X,加入5滴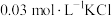 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:① 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.为了探究KCl对
 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。 猜想②:
 产生的影响。
产生的影响。 猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:a.溶液中的
 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取
 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②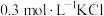 溶液、③
溶液、③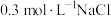 溶液、④
溶液、④ 溶液、⑤
溶液、⑤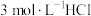 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)已知
 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:
您最近半年使用:0次
10 . 下列说法正确的是
A. 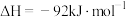 ,升温加快反应速率,平衡往正向移动 ,升温加快反应速率,平衡往正向移动 |
B.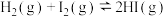 ,平衡体系加压后颜色变深 ,平衡体系加压后颜色变深 |
C.恒温恒压下,向 平衡体系中充入氦气,平衡往正向移动 平衡体系中充入氦气,平衡往正向移动 |
D. ,平衡体系中水加稀释,平衡往正向移动 ,平衡体系中水加稀释,平衡往正向移动 |
您最近半年使用:0次




