名校
1 . 合成氨所需的H2可由反应CO(g)+H2O(g)=CO2(g)+H2(g) ∆H<0提供,下列措施中,能提高CO转化率的是
| A.增大水蒸气浓度 | B.升高温度 | C.增大CO浓度 | D.增大压强 |
您最近一年使用:0次
2023-11-08更新
|
426次组卷
|
5卷引用:四川省达州外国语学校2023-2024学年高二上学期12月月考化学试题
2 . 目前,常用三元催化将汽车尾气中NO和CO转化为CO2和N2。在密闭容器中模拟进行如下反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
(1)增加CO的浓度,平衡向_______ 移动,该反应的平衡常数K_______ 。
(2)保持反应容器压强和温度不变,通入He,平衡向_______ 移动,该化学反应速率_______ ,该反应的△H_______ 。
(3)在一定温度下,缩小反应容器体积,平衡向_______ 移动,NO(g)的转化率_______ 。
(4)使用相同质量的同种催化剂,增大催化剂的比表面积,平衡_______ 移动,该化学反应速率将_______ 。
 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。(1)增加CO的浓度,平衡向
(2)保持反应容器压强和温度不变,通入He,平衡向
(3)在一定温度下,缩小反应容器体积,平衡向
(4)使用相同质量的同种催化剂,增大催化剂的比表面积,平衡
您最近一年使用:0次
2023-11-05更新
|
262次组卷
|
2卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
3 . 下列事实对应的原因或结论错误的是
| 选项 | 事实 | 原因或结论 |
| A | 实验室测定中和反应热时,用浓硫酸替代稀盐酸,其数值偏高 | 浓硫酸溶于水会放热 |
| B | 将CO中毒者移到新鲜空气处 | 使平衡COHb+O2⇌O2Hb+CO正向移动(Hb代表血红蛋白) |
| C | 工业上由SO2和O2反应制备SO3在常压条件进行 | 常压下SO2已经有较大的转化率 |
| D | 工业制备K的原理是:KCl(l)+Na(l)⇌NaCl(l)+K(g) | 金属活泼性:Na>K |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-03更新
|
130次组卷
|
2卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
4 . CH3COOH+CH3CH2OH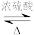 CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
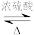 CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是| A.让乙醇过量,能提高乙酸的转化率 |
| B.合理调节乙醇、乙酸、浓硫酸的比例,能有效节约成本 |
| C.反应过程中适当提高加热温度,既能提高反应速率,又能提高酯的平衡产率 |
| D.加入的浓硫酸能吸收反应过程中产生的水,使平衡正向移动 |
您最近一年使用:0次
2023-11-03更新
|
154次组卷
|
3卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
5 . 在密闭容器中进行如下反应: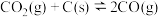
 ,达到平衡后,若改变下列条件,则指定物质的浓度、速率、平衡如何变化。
,达到平衡后,若改变下列条件,则指定物质的浓度、速率、平衡如何变化。
(1)增加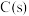 的量,则平衡
的量,则平衡___________ (填“逆移”“正移”或“不移”,下同),
___________ (填“增大”“减小”或“不变”,下同)。
(2)恒温条件,增大反应容器的容积,则平衡___________ ,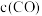
___________ (填“增大”“减小”或“不变”,下同)
(3)保持反应容器的容积和温度不变,通入He气,则平衡___________ ,
___________ 。
(4)保持反应容器的压强不变,通入Ar气,则平衡___________ ,
___________ 。
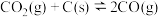
 ,达到平衡后,若改变下列条件,则指定物质的浓度、速率、平衡如何变化。
,达到平衡后,若改变下列条件,则指定物质的浓度、速率、平衡如何变化。(1)增加
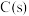 的量,则平衡
的量,则平衡
(2)恒温条件,增大反应容器的容积,则平衡
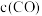
(3)保持反应容器的容积和温度不变,通入He气,则平衡

(4)保持反应容器的压强不变,通入Ar气,则平衡

您最近一年使用:0次
名校
6 . 一定温度下,反应 在密闭容器中达到平衡,下列说法正确的是
在密闭容器中达到平衡,下列说法正确的是
 在密闭容器中达到平衡,下列说法正确的是
在密闭容器中达到平衡,下列说法正确的是A.增大压强, ,平衡常数增大 ,平衡常数增大 |
B.加入催化剂,平衡时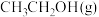 的浓度增大 的浓度增大 |
C.恒容下,充入一定量的 ,平衡向正反应方向移动 ,平衡向正反应方向移动 |
D.恒容下,充入一定量的 , , 的平衡转化率增大, 的平衡转化率增大, 的平衡转化率减小 的平衡转化率减小 |
您最近一年使用:0次
名校
7 . 根据下列实验操作,其现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向一密闭容器充入NO2,保持温度不变,扩大容器体积 | 容器中气体颜色先变浅后变深 | 平衡2NO2(g) N2O4(g)先正向移动再逆向移动 N2O4(g)先正向移动再逆向移动 |
| B | 向2mL5%H2O2溶液中分别滴加5滴等浓度的FeCl3和KMnO4溶液 | 加入KMnO4溶液的反应更剧烈 | KMnO4比FeCl3催化效果好 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 玻璃球中红棕色加深 | 反应2NO2(g) N2O4(g)的△H<0 N2O4(g)的△H<0 |
| D | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液红色变浅 | 增大生成物浓度,平衡逆向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-17更新
|
395次组卷
|
3卷引用:四川省眉山市仁寿县文宫中学 汪洋中学2023-2024学年高二上学期11月期中联考化学试题
名校
解题方法
8 . 下列事实不能用勒夏特列原理解释的是
| A.Fe(SCN)3溶液中加入少量固体KSCN后颜色变深 |
| B.把食品存放在冰箱里可延长保质期 |
| C.合成氨反应,为提高原料的转化率,理论上应采取降低温度的措施 |
| D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 |
您最近一年使用:0次
2023-10-17更新
|
501次组卷
|
7卷引用:四川省成都外国语学校2023-2024学年高二上学期11月期中考试化学试题
9 . 由 -羟基丁酸
-羟基丁酸 生成
生成 -丁内酯的反应如下:
-丁内酯的反应如下: 时,水溶液中
时,水溶液中 -羟基丁酸的初始浓度为
-羟基丁酸的初始浓度为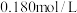 ,随着反应的进行,测得
,随着反应的进行,测得 -丁内酯的浓度随时间的变化如下表所示:
-丁内酯的浓度随时间的变化如下表所示:
下列说法不正确的是
 -羟基丁酸
-羟基丁酸 生成
生成 -丁内酯的反应如下:
-丁内酯的反应如下: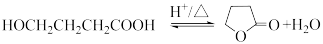
 时,水溶液中
时,水溶液中 -羟基丁酸的初始浓度为
-羟基丁酸的初始浓度为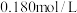 ,随着反应的进行,测得
,随着反应的进行,测得 -丁内酯的浓度随时间的变化如下表所示:
-丁内酯的浓度随时间的变化如下表所示: | 21 | 50 | 80 | 100 | 120 | 160 | 220 |  |
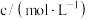 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
A.在50~80 内,以 内,以 -丁内酯的浓度变化表示的反应速率为 -丁内酯的浓度变化表示的反应速率为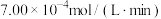 |
B.在 时,该反应的平衡常数 时,该反应的平衡常数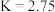 |
C.若将 -羟基丁酸的初始浓度降低,体系中水含量增多,平衡逆向移动, -羟基丁酸的初始浓度降低,体系中水含量增多,平衡逆向移动, -羟基丁酸的平衡转化率减小 -羟基丁酸的平衡转化率减小 |
D.将反应溶剂更换为非水溶剂并通过共沸回流的方式移除体系中的水分,有助于提高 -丁内酯的平衡产率 -丁内酯的平衡产率 |
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.分别取40mL0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:
(1)本实验除烧杯、量筒外还缺少的玻璃仪器名称为___________ 。
(2)若某同学通过该实验测定出中和热 偏大,请分析可能的原因是
偏大,请分析可能的原因是___________ (填序号)。
A.用量筒量取盐酸时仰视读数
B.分多次将NaOH溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.为探究化学反应速率的影响因素,设计的实验方案如下表:(已知KI溶液、 溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
(3)写出混合溶液中滴入H2O2溶液反应的离子方程式为___________ 。
(4)表中的V=___________ mL,t1、t2、t3由小到大的顺序为___________ 。
(5)某同学研究浓度对化学平衡的影响。他向5mL 0.1mol/L K2Cr2O7溶液中加入几滴5mol/L NaOH溶液溶液颜色变化为___________ 。
 。请回答下列问题:
。请回答下列问题:(1)本实验除烧杯、量筒外还缺少的玻璃仪器名称为
(2)若某同学通过该实验测定出中和热
 偏大,请分析可能的原因是
偏大,请分析可能的原因是A.用量筒量取盐酸时仰视读数
B.分多次将NaOH溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.为探究化学反应速率的影响因素,设计的实验方案如下表:(已知KI溶液、
 溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)| 向烧杯中加入的试剂及用量/mL | |||||||
| 0.1mol/L KI溶液 | 0.1mol/L H2O2溶液 | 0.1mol/L H2SO4溶液 | 淀粉溶液 | H2O | 时间/s | ||
| ① | 25℃ | 20.0 | 10.0 | 5.0 | 1.0 | 0.0 | t1 |
| ② | 40℃ | 20.0 | 10.0 | 5.0 | 1.0 | 0.0 | t2 |
| ③ | 25℃ | 20.0 | 5.0 | 5.0 | 1.0 | V | t3 |
(4)表中的V=
(5)某同学研究浓度对化学平衡的影响。他向5mL 0.1mol/L K2Cr2O7溶液中加入几滴5mol/L NaOH溶液溶液颜色变化为
您最近一年使用:0次
2023-10-10更新
|
120次组卷
|
2卷引用:四川省宜宾市第四中学校2023-2024学年高二上学期12月月考化学试题



