9-10高二下·江西·期中
名校
1 . 有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
您最近一年使用:0次
2022-11-09更新
|
940次组卷
|
65卷引用:河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题
河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题(已下线)09~10年江西四校高二下学期期中联考化学卷(已下线)2011届黑龙江省哈六中高三上学期期中考试化学试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期末考试化学试卷(已下线)2012-2013学年黑龙江省庆安三中高二上学期期中考试化学试卷(已下线)2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(已下线)2014年高中化学人教版选修四模块质量检测练习卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(已下线)2014-2015学年河南周口市沈丘县县直高级中学高二上第一次月考化学2015-2016学年河北省望都中学高二上学期第二次月考化学试卷2015-2016学年甘肃省张掖二中高二上学期10月月考化学试卷2015-2016学年海南省嘉积中学高二上12月段考化学试卷2015-2016学年四川阆中中学校高二下第一次段考化学试卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2015-2016学年甘肃省白银市靖远一中高二上期中化学试卷2016-2017学年湖南省长沙一中高一上月考三化学试卷天津市武清区2017-2018学年高二上学期期中考试化学试题河北省唐山一中2017-2018学年高二上学期期中考试化学试题山东省日照黄海高级中学2017-2018学年高二上学期期中考试(理)化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2017-2018学年高一下学期期末考试化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二上学期10月月考化学试题【全国百强校】陕西省西安市第一中学2018-2019学年高二上学期10月月考化学试题湖北省利川市第五中学2018-2019学年高二上学期期中模拟考试化学试题广东省揭阳市揭西县河婆中学2018-2019学年高二上学期期末化学试题宁夏长庆高级中学2019-2020学年高二上学期第一次月考化学试题四川省北大附中成都为明学校2019-2020学年高二9月月考化学试题山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2019-2020学年高二上学期期中考试化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题海南省海口市第四中学2019-2020学年高二上学期期末考试化学试题吉林省长春市第七中学2020-2021学年高二上学期第一次月考化学试题海南省琼山中学2019-2020学年高二上学期期末考试化学试题黑龙江省大庆中学2020-2021学年高二10月月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时2 反应条件对化学平衡的影响甘肃省庆阳市第六中学2020-2021学年高二上学期期中考试化学(理)试题广西壮族自治区贺州市平桂高级中学(贺州市第五高级中学)2020-2021学年高二上学期第一次月考化学试题浙江省台州市七校联盟2019-2020学年高二上学期期中联考化学试题重庆市沙坪坝区重庆市第七中学2020-2021高二上学期中考试化学试题宁夏海原第一中学2020-2021学年高二上学期第二次月考化学试题湖北省老河口市一中2020-2021学年高二12月阶段性考试化学试题广东省雷州市第二中学2020-2021学年高二上学期期中考试化学试题内蒙古自治区土默特左旗第三中学2020-2021学年高二上学期期末考试化学试题内蒙古集宁新世纪中学2020-2021学年高二上学期期中考试化学试题新疆阿克苏地区新和县实验中学2020-2021学年高二下学期期末考试化学试题广东省广州市北师大附中为明学校2021-2022学年高二10月月考化学试题云南省弥勒市第二中学2020-2021学年高二下学期期中考试化学试题(已下线)2.2.3 影响化学平衡的因素(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题河北省衡水市武强中学2021-2022学年高二上学期第三次月考化学试题(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山东省潍坊瀚声学校2021-2022学年高一下学期4月月考化学试题福建省永安市第九中学2022-2023学年高二上学期期中考试化学(选考)试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高二上学期第一次月考化学试题广东省揭阳普宁市普师高级中学2021-2022学年高二上学期期中考试化学试题天津市第八中学2021-2022学年高二上学期12月月考化学试题山东省滕州市第五中学2022-2023学年高一下学期5月月考化学试题陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题安徽省合肥市肥东县综合高中2022-2023学年高二上学期11月期中考试化学试题陕西省渭南市蒲城县蒲城中学2023-2024学年高二上学期期中考试化学试题天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题
2 . “碳中和”是我国的战略目标。促进CO2的转化中的一个反应是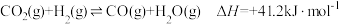 。下列对该反应的说法正确的是
。下列对该反应的说法正确的是
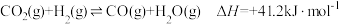 。下列对该反应的说法正确的是
。下列对该反应的说法正确的是| A.在绝热容器中进行该反应,气体的温度将会升高 |
| B.加入催化剂可以降低反应的活化能,使∆H减小 |
| C.缩小反应体系的体积,可以增大CO的平衡浓度 |
| D.在恒容容器中再充入一定量的CO2,平衡正向移动,CO2的平衡转化率增大 |
您最近一年使用:0次
2022-06-29更新
|
254次组卷
|
2卷引用:河南省南阳市六校2021-2022学年高二下学期6月联考化学试题
名校
解题方法
3 . 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
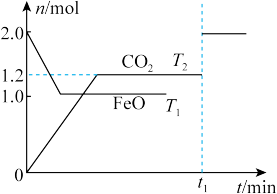
| A.平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 |
| B.平衡时,其他条件不变,取出适当铁可提高CO的转化率 |
| C.该反应的△H<0,K1<K2=1.5 |
| D.当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
您最近一年使用:0次
2020-12-05更新
|
109次组卷
|
3卷引用:河南省南阳市第一中学校2021-2022学年高二上学期第二次月考化学试题
4 . 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)。污染跟冬季燃煤密切相关,SO2.CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=-242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________ 。
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g) CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
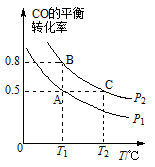
①下列说法不能判断该反应达到化学平衡状态的是____ (填字母)。
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____ PB(填“>”“<”或“=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=________ L。
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图: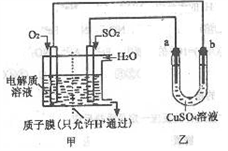
①该电池的负极反应:___________________ ;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重____ g。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=-242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g)
 CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重
您最近一年使用:0次
5 . 在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X (g) +Y (g) 2Z (g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2Z (g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:

下列说法正确的是
 2Z (g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2Z (g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
下列说法正确的是
| A.反应前2 min的平均速率v(Z) =2.0×l0—3mol.L—l·min—l |
| B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正) |
| C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,C (Z) =0.24 mol·L—l |
| D.该温度下此反应的平衡常数:K=l. 44 |
您最近一年使用:0次



