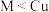名校
1 . 在373K时,把0.5molN2O4气体通入体积为5L 的恒容密闭容器中,发生反应: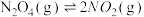 立即出现红棕色。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是
立即出现红棕色。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是
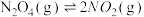 立即出现红棕色。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是
立即出现红棕色。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是| A.前60秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s) |
B.在 60秒时,  物质的量为0.2mol 物质的量为0.2mol |
| C.在平衡时体系内含N2O4的物质的量为0.2mol |
| D.60秒时,再充入一定量N2O4则可提高N2O4的转化率 |
您最近一年使用:0次
名校
2 . 下列实验中,能达到实验目的是
| A | B | C | D |
| 实现将反应Cu+2Fe3+=Cu2++2Fe2+的化学能转变为电能 | 验证非金属性强弱:Cl>C>Si | 证明:相同温度下的溶解度:Mg(OH)2>Fe(OH)3 | 探究浓度对化学平衡的影响规律: +H2O +H2O 2 2 +2H+ +2H+ |
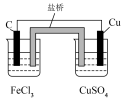 |  | 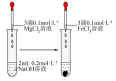 | 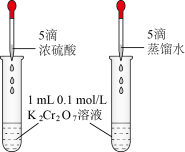 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 根据下列实验操作和实验现象,能够得出相应结论的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向 溶液中加入少量铁粉 溶液中加入少量铁粉 | 溶液红色变浅 | 减小 ,使反应 ,使反应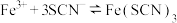 平衡逆向移动 平衡逆向移动 |
B | 将金属M片和Cu片与稀硫酸构成原电池 | Cu片上产生气泡,M片不断变小 | 金属活动性: |
C | 常温下,用pH计分别测定等物质的量浓度的 与 与 溶液的pH 溶液的pH |
| 证明非金属性: |
D | 向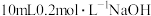 溶液中滴加2滴 溶液中滴加2滴 的 的 溶液,再滴加2滴 溶液,再滴加2滴 的 的 溶液 溶液 | 先生成白色沉淀,后生成红褐色沉淀 | 相同温度 : : |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 下列事实不能用勒夏特列原理解释的是
| A.25℃时,纯水pH=7;100℃时,纯水的pH<7 |
B.实验室用过氧化氢制取氧气时,常常加入 固体 固体 |
| C.实验室常用排饱和食盐水的方法收集氯气 |
| D.新制的氯水在光照条件下颜色变浅 |
您最近一年使用:0次
名校
解题方法
5 . I:室温下,通过下列实验探究 溶液的性质。
溶液的性质。
依据实验操作和现象,回答下列问题:
(1)向0.1mol/L 溶液滴入酚酞溶液,观察到的现象是
溶液滴入酚酞溶液,观察到的现象是___________ ,原因___________ (用离子方程式表示)。
(2)实验3中随 的不断通入,溶液中
的不断通入,溶液中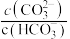
___________ (填减小、不变或增大)。
(3)常温下, 均为12的
均为12的 溶液与NaOH溶液中水电离出的
溶液与NaOH溶液中水电离出的 之比为
之比为___________ 。
Ⅱ:① 溶液②
溶液② 溶液③
溶液③ 溶液④
溶液④ 气体⑤碘水⑥氨水⑦
气体⑤碘水⑥氨水⑦ 溶液
溶液
(4)向②中通入足量④,发生反应的离子方程式为___________ 。
(5)为得到浓度较大的⑤,实验室在配制时,常加入 ,溶液中存在如下平衡:
,溶液中存在如下平衡: ,向⑤中加入一定量的①,该平衡将
,向⑤中加入一定量的①,该平衡将___________ (填“正向”或“逆向”)移动。
Ⅲ:
(6)泡沫灭火器原理(用离子方程式表示):___________
(7)配置 溶液为什么要将
溶液为什么要将 固体溶解在浓盐酸中(用离子方程式表示):
固体溶解在浓盐酸中(用离子方程式表示):___________
(8)加热蒸干 为什么得不到
为什么得不到 原理(用化学方程式表示):
原理(用化学方程式表示):___________
 溶液的性质。
溶液的性质。| 实验 | 实验操作和现象 |
| 1 | 用 试纸测定0.1mol/L 试纸测定0.1mol/L 溶液的 溶液的 ,测得 ,测得 约为12 约为12 |
| 2 | 向0.1mol/L 溶液中加入过量0.2mol/L 溶液中加入过量0.2mol/L 溶液,产生白色沉淀 溶液,产生白色沉淀 |
| 3 | 向0.1mol/L 溶液中通入过量 溶液中通入过量 ,测得溶液 ,测得溶液 约为8 约为8 |
| 4 | 向0.1mol/L 溶液中滴加几滴0.05mol/L 溶液中滴加几滴0.05mol/L ,观察不到实验现象 ,观察不到实验现象 |
(1)向0.1mol/L
 溶液滴入酚酞溶液,观察到的现象是
溶液滴入酚酞溶液,观察到的现象是(2)实验3中随
 的不断通入,溶液中
的不断通入,溶液中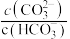
(3)常温下,
 均为12的
均为12的 溶液与NaOH溶液中水电离出的
溶液与NaOH溶液中水电离出的 之比为
之比为Ⅱ:①
 溶液②
溶液② 溶液③
溶液③ 溶液④
溶液④ 气体⑤碘水⑥氨水⑦
气体⑤碘水⑥氨水⑦ 溶液
溶液(4)向②中通入足量④,发生反应的离子方程式为
(5)为得到浓度较大的⑤,实验室在配制时,常加入
 ,溶液中存在如下平衡:
,溶液中存在如下平衡: ,向⑤中加入一定量的①,该平衡将
,向⑤中加入一定量的①,该平衡将Ⅲ:
(6)泡沫灭火器原理(用离子方程式表示):
(7)配置
 溶液为什么要将
溶液为什么要将 固体溶解在浓盐酸中(用离子方程式表示):
固体溶解在浓盐酸中(用离子方程式表示):(8)加热蒸干
 为什么得不到
为什么得不到 原理(用化学方程式表示):
原理(用化学方程式表示):
您最近一年使用:0次
6 . 下列实验中,由实验现象得到的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 室温下,用 试纸测浓度均为 试纸测浓度均为 的 的 和 和 溶液的 溶液的 | 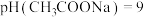 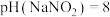 |  的酸性比 的酸性比 的弱 的弱 |
| B | 将 氨水稀释成 氨水稀释成 |  由11.1变成10.6 由11.1变成10.6 | 稀释后 的电离程度减小 的电离程度减小 |
| C | 向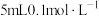 的 的 溶液中先滴加5滴 溶液中先滴加5滴 溶液,再滴加5滴 溶液,再滴加5滴 溶液 溶液 | 先产生白色沉淀,后白色沉淀变为黄色沉淀 |  |
| D | 往 溶液中滴加 溶液中滴加 溶液,再加入少量 溶液,再加入少量 固体 固体 | 溶液先变成红色,后无明显变化 |  与 与 的反应不可逆 的反应不可逆 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 利用下列实验装置不能达到实验目的的是
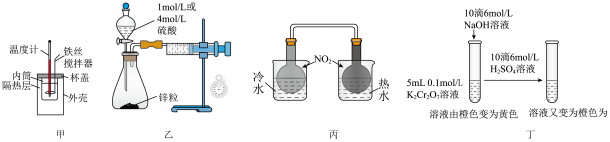

| A.用甲装置准确测定中和热 |
| B.用乙装置测定不同浓度硫酸与锌粒反应速率 |
| C.用丙装置证明温度对平衡移动的影响 |
| D.用丁装置研究溶液的酸碱性对平衡移动的影响 |
您最近一年使用:0次
名校
解题方法
8 . 表中实验操作、现象与结论对应关系均正确的
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取2mL0.lmol/LAgNO3溶液,先后滴加3滴0.lmol/LNaCl溶液和6滴0.lmol/LKI溶液,观察沉淀情况 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)大于Ksp(AgI) |
| B | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY弱 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测定pH=3.2 | NaHSO3溶液呈酸性,证明 在水中的电离程度大于水解程度 在水中的电离程度大于水解程度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.高铁电池:高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,并且以其为主体的高铁电池研制也在进行中。如图所示是高铁电池的模拟实验装置。___________ 。
(2)盐桥中盛有饱和 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动。
(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有:___________ 。
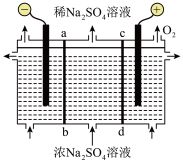
利用如图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜,可进行烧碱与硫酸的制备。___________ ,ab为___________ (填“阴”或“阳”)离子交换膜。阳极对应的电极反应式:___________ 。
Ⅲ.碱性银锌二次航空电池为价格昂贵的高能电池。
该电池的总反应为: ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下: ___________ (填“正极”或“负极”)。
(6)以 溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
反应(ⅰ)锌电极板的溶解:
反应(ⅱ)锌电极板上 的析出:
的析出:
放电时,析出的 会覆盖在锌电极板表面,影响电池使用效果。用浓
会覆盖在锌电极板表面,影响电池使用效果。用浓 溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:___________ 。
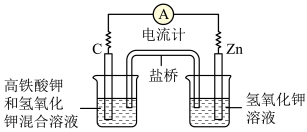
(2)盐桥中盛有饱和
 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有:

利用如图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜,可进行烧碱与硫酸的制备。
Ⅲ.碱性银锌二次航空电池为价格昂贵的高能电池。
该电池的总反应为:
 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下: 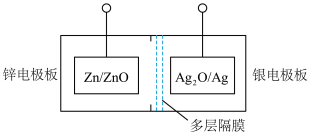
(6)以
 溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:反应(ⅰ)锌电极板的溶解:

反应(ⅱ)锌电极板上
 的析出:
的析出:
放电时,析出的
 会覆盖在锌电极板表面,影响电池使用效果。用浓
会覆盖在锌电极板表面,影响电池使用效果。用浓 溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
您最近一年使用:0次
10 . 铜盐是五颜六色的。某学习小组发现固体 (白色)、固体
(白色)、固体 (棕黄色)、固体
(棕黄色)、固体 (深褐色)。
(深褐色)。 和
和 溶液呈蓝色,
溶液呈蓝色, 溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
【查阅资料】
1.固体铜盐的颜色与阴离子极化能力有关,随化学键共价性增强,吸收光的能量下降,因此颜色加深。
2.在 溶液中存在如下平衡:
溶液中存在如下平衡:

【提出假设】
1.铜盐的颜色不同与离子种类有关。
2. 溶液呈绿色的原因是溶液中既有黄色的
溶液呈绿色的原因是溶液中既有黄色的 ,又有蓝色的
,又有蓝色的 ,根据光学原理蓝色和黄色的混合色为绿色。
,根据光学原理蓝色和黄色的混合色为绿色。
【设计方案】
回答下列问题:
(1)解释 的颜色深于
的颜色深于 的原因
的原因___________ 。
(2)配制 溶液的方法是
溶液的方法是___________ 。
(3)根据表中信息,补充试剂和数据:饱和___________ 、a=___________ 。
(4)实验4和5中溶液颜色差异的原因___________ (用平衡移动原理解释)。
(5)以上实验说明影响 溶液颜色的因素主要有
溶液颜色的因素主要有___________ 。(答两点即可)
【实验结论】假设1,2成立。
(6) 溶液呈现不同颜色的根本原因与
溶液呈现不同颜色的根本原因与 、
、 和
和___________ 微粒(写结构式)的浓度有关。
 (白色)、固体
(白色)、固体 (棕黄色)、固体
(棕黄色)、固体 (深褐色)。
(深褐色)。 和
和 溶液呈蓝色,
溶液呈蓝色, 溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。【查阅资料】
1.固体铜盐的颜色与阴离子极化能力有关,随化学键共价性增强,吸收光的能量下降,因此颜色加深。
2.在
 溶液中存在如下平衡:
溶液中存在如下平衡:
【提出假设】
1.铜盐的颜色不同与离子种类有关。
2.
 溶液呈绿色的原因是溶液中既有黄色的
溶液呈绿色的原因是溶液中既有黄色的 ,又有蓝色的
,又有蓝色的 ,根据光学原理蓝色和黄色的混合色为绿色。
,根据光学原理蓝色和黄色的混合色为绿色。【设计方案】
| 序号 | 温度/℃ | V( 氯化铜)/mL 氯化铜)/mL | V(饱和硫酸铜)/mL | V(饱和___________)/mL | V(饱和氯化钠)/mL | V(水)/mL | 溶液颜色 |
| 1 | 25 | 4.0 | 无色 | ||||
| 2 | 25 | 4.0 | 无色 | ||||
| 3 | 25 | 4.0 | 蓝色 | ||||
| 4 | 25 | 4.0 | 绿色 | ||||
| 5 | 25 | 2.0 | a | 蓝绿色 | |||
| 6 | 25 | 2.0 | 2.0 | 蓝绿色 | |||
| 7 | 25 | 2.0 | 2.0 | 黄绿色 | |||
| 8 | 50 | 4.0 | 黄绿色 |
(1)解释
 的颜色深于
的颜色深于 的原因
的原因(2)配制
 溶液的方法是
溶液的方法是(3)根据表中信息,补充试剂和数据:饱和
(4)实验4和5中溶液颜色差异的原因
(5)以上实验说明影响
 溶液颜色的因素主要有
溶液颜色的因素主要有【实验结论】假设1,2成立。
(6)
 溶液呈现不同颜色的根本原因与
溶液呈现不同颜色的根本原因与 、
、 和
和
您最近一年使用:0次
2024-01-13更新
|
633次组卷
|
4卷引用:辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题