解题方法
1 . 某班同学用如下实验探究 、
、 的性质,回答下列问题:
的性质,回答下列问题:
(1)分别取一定量 、
、 固体,均配制成0.1 mol⋅L-1的溶液。在
固体,均配制成0.1 mol⋅L-1的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是___________ (用化学方程式表示)。
(2)甲组同学取2 mL 0.1 mol⋅L-1 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用 酸化至
酸化至 ),溶液颜色变红。甲组同学通过上述实验分析
),溶液颜色变红。甲组同学通过上述实验分析 具有
具有___________ (填“氧化”或“还原”)性。 与KSCN溶液反应的离子方程式为
与KSCN溶液反应的离子方程式为___________ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL 溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___________ 。同时乙组同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,用过量
可发生反应,生成无色的配合物。为证实该性质,用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,用于验证
,用于验证 与
与 发生反应,进行a和b两组实验:
发生反应,进行a和b两组实验:

 的制备离子方程式为
的制备离子方程式为___________ ,实验b的目的是___________ ,从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是___________ 。
(4)丙同学设计实验进一步证明 可与
可与 反应,进行d和c的对照实验。
反应,进行d和c的对照实验。
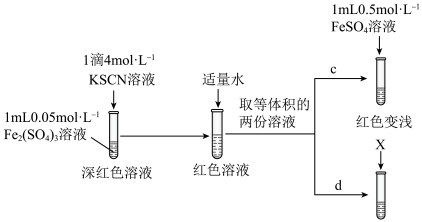
①X为___________ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是___________ 。
③实验中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,___________ 。
 、
、 的性质,回答下列问题:
的性质,回答下列问题:(1)分别取一定量
 、
、 固体,均配制成0.1 mol⋅L-1的溶液。在
固体,均配制成0.1 mol⋅L-1的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是(2)甲组同学取2 mL 0.1 mol⋅L-1
 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用 酸化至
酸化至 ),溶液颜色变红。甲组同学通过上述实验分析
),溶液颜色变红。甲组同学通过上述实验分析 具有
具有 与KSCN溶液反应的离子方程式为
与KSCN溶液反应的离子方程式为(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL
 溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 与
与 可发生反应,生成无色的配合物。为证实该性质,用过量
可发生反应,生成无色的配合物。为证实该性质,用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,用于验证
,用于验证 与
与 发生反应,进行a和b两组实验:
发生反应,进行a和b两组实验:
 的制备离子方程式为
的制备离子方程式为(4)丙同学设计实验进一步证明
 可与
可与 反应,进行d和c的对照实验。
反应,进行d和c的对照实验。
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是③实验中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近半年使用:0次
名校
解题方法
2 . 下列实验操作及现象、结论都正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 分别测浓度均为0.1mol·L-1的CH3COONH4和NaHCO3溶液的pH,后者大于前者 | Kh(CH3COO-)<Kh(HCO ) ) |
| B | 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 | 铁锈中含有二价铁 |
| C | FeCl3+3KSCN Fe(SCN)3+3KCl在平衡体系中加入KCl晶体,溶液颜色不变 Fe(SCN)3+3KCl在平衡体系中加入KCl晶体,溶液颜色不变 | 加入少量KCl晶体,不会影响该化学平衡 |
| D | 向溶液中滴加少量NaOH稀溶液,将湿润的红色石蕊试纸靠近试管口,观察石蕊试纸变蓝 | 原溶液中含有NH |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
3 . 金属铂(Pt)对气体(特别是H2、O2和CO)具有较强的吸附能力。因此常用来做电极材料,从某废旧电极材料(主要含有Pt、C、Al2O3、MgO)中回收Pt的一种工艺流程如图所示。
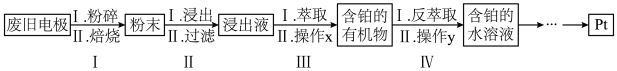
回答下列问题:
(1)过程Ⅰ中“焙烧”之前将废旧电极“粉碎”的目的是___________ 。
(2)实验人员采用三种不同的浸出液分别研究过程Ⅱ中Pt的浸出率。所用浸出液甲、乙、丙分别是HCl-H2SO4-NaClO3、HCI-NaClO3和HCl-H2O2。
①将浸出液为乙时的离子方程式补充完整:_____________
3Pt+___________Cl-+___________ +___________=3[PtCl6]2-+___________H2O
+___________=3[PtCl6]2-+___________H2O
②当NaClO3或H2O2作为氧化剂浸出等量Pt时,n(NaClO3):n(H2O2)=___________ 。
③c(H+)相同、浸出时间相同时,甲、乙、丙三种浸出液对Pt的浸出率如下表。[注:c(NaClO3)按照②中的物质的量关系换算成c(H2O2)计]。
a.以HCl-NaClO3为例,说明当其中氧化剂浓度大于0.2mol/L时,Pt的浸出率降低的原因:随着c(NaClO3)增大,其氧化性增强,部分 被
被___________ 还原而消耗。
b.氧化剂浓度均为0.2mol/L时,甲中Pt的浸出率最低的可能原因:由于三种浸出液中的c(H+)均相同,
(3)过程Ⅲ中萃取剂(R3N)的萃取机理如下(O表示有机体系,A表示水溶液体系)。
ⅰ.R3N(O)+ +
+
 R3NHCl(O)。
R3NHCl(O)。
ⅱ.2R3NHCl(O)+
 (R3NH)2[PtCl6](O)+2
(R3NH)2[PtCl6](O)+2
①分离操作x是___________ 。
②“反萃取”时向含Pt的有机物中加入NaOH溶液,可使[PtCl6]2-进入水溶液体系,反应的离子方程式是___________ 。

回答下列问题:
(1)过程Ⅰ中“焙烧”之前将废旧电极“粉碎”的目的是
(2)实验人员采用三种不同的浸出液分别研究过程Ⅱ中Pt的浸出率。所用浸出液甲、乙、丙分别是HCl-H2SO4-NaClO3、HCI-NaClO3和HCl-H2O2。
①将浸出液为乙时的离子方程式补充完整:
3Pt+___________Cl-+___________
 +___________=3[PtCl6]2-+___________H2O
+___________=3[PtCl6]2-+___________H2O②当NaClO3或H2O2作为氧化剂浸出等量Pt时,n(NaClO3):n(H2O2)=
③c(H+)相同、浸出时间相同时,甲、乙、丙三种浸出液对Pt的浸出率如下表。[注:c(NaClO3)按照②中的物质的量关系换算成c(H2O2)计]。
| 编号 | 氧化剂浓度/mol·L-1 | 0.1 | 0.2 | 0.3 | 0.4 |
| 甲 | HCl-H2SO4-NaClO3对Pt的浸出率/% | 72.7 | 78.2 | 77.5 | 75.4 |
| 乙 | HCl-NaClO3对Pt的浸出率/% | 79.6 | 85.3. | 82.1 | 81.6. |
| 丙 | HCl-H2O2对Pt的浸出率/% | 80.0 | 85.6. | 83.2 | 82.5 |
 被
被b.氧化剂浓度均为0.2mol/L时,甲中Pt的浸出率最低的可能原因:由于三种浸出液中的c(H+)均相同,
(3)过程Ⅲ中萃取剂(R3N)的萃取机理如下(O表示有机体系,A表示水溶液体系)。
ⅰ.R3N(O)+
 +
+
 R3NHCl(O)。
R3NHCl(O)。ⅱ.2R3NHCl(O)+

 (R3NH)2[PtCl6](O)+2
(R3NH)2[PtCl6](O)+2
①分离操作x是
②“反萃取”时向含Pt的有机物中加入NaOH溶液,可使[PtCl6]2-进入水溶液体系,反应的离子方程式是
您最近半年使用:0次
名校
4 . 下列事实能用勒夏特列原理来解释的是
A. 被氧化为 被氧化为 ,往往需要使用催化剂: ,往往需要使用催化剂: |
B.500℃温度比室温更有利于合成氨反应:  |
C. 、 、 、 、 平衡混合气体加压后颜色加深: 平衡混合气体加压后颜色加深: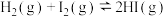 |
D.实验室采用排饱和食盐水的方法收集氯气: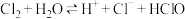 |
您最近半年使用:0次
名校
解题方法
5 . 氟碳铈矿(主要成分为 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:

(1) 中
中 的化合价为
的化合价为___________ ;氧化焙烧时不能使用陶瓷容器的原因是产物 会腐蚀
会腐蚀 生成
生成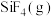 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)氧化焙烧后的产物之一为 ,则酸浸时发生反应的离子方程式为
,则酸浸时发生反应的离子方程式为___________ 。
(3)操作I的名称为___________ ;有机物 能将
能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 。向
。向 中加入稀硫酸能获得较纯的含
中加入稀硫酸能获得较纯的含 水溶液,从平衡移动角度解释其原因
水溶液,从平衡移动角度解释其原因___________ 。
(4)写出向 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式
的化学方程式___________ 。
 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
(1)
 中
中 的化合价为
的化合价为 会腐蚀
会腐蚀 生成
生成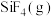 ,该反应的化学方程式为
,该反应的化学方程式为(2)氧化焙烧后的产物之一为
 ,则酸浸时发生反应的离子方程式为
,则酸浸时发生反应的离子方程式为(3)操作I的名称为
 能将
能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 。向
。向 中加入稀硫酸能获得较纯的含
中加入稀硫酸能获得较纯的含 水溶液,从平衡移动角度解释其原因
水溶液,从平衡移动角度解释其原因(4)写出向
 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式
的化学方程式
您最近半年使用:0次
6 . 下列说法正确的是
A.将装有 气体的注射器压缩至原体积的一半,压缩后的气体颜色比压缩前深,则说明增大压强, 气体的注射器压缩至原体积的一半,压缩后的气体颜色比压缩前深,则说明增大压强, 平衡向逆反应方向移动 平衡向逆反应方向移动 |
B.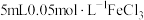 溶液中滴入几滴KSCN溶液,溶液呈红色,再加入少量KCl固体,溶液红色变浅,则说明增大生成物浓度,平衡向逆反应方向移动 溶液中滴入几滴KSCN溶液,溶液呈红色,再加入少量KCl固体,溶液红色变浅,则说明增大生成物浓度,平衡向逆反应方向移动 |
C.加热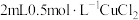 溶液,溶液变为黄绿色,则说明 溶液,溶液变为黄绿色,则说明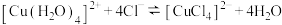 的 的 |
D.对 的平衡体系压缩体积,体系颜色变深,则说明增大压强,平衡向逆反应方向移动 的平衡体系压缩体积,体系颜色变深,则说明增大压强,平衡向逆反应方向移动 |
您最近半年使用:0次
名校
7 . 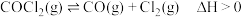 .当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加
.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加 的浓度 ④减压 ⑤恒压通入惰性气体 ⑥加催化剂,能提高
的浓度 ④减压 ⑤恒压通入惰性气体 ⑥加催化剂,能提高 转化率的是
转化率的是
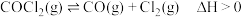 .当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加
.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加 的浓度 ④减压 ⑤恒压通入惰性气体 ⑥加催化剂,能提高
的浓度 ④减压 ⑤恒压通入惰性气体 ⑥加催化剂,能提高 转化率的是
转化率的是| A.①②④ | B.③⑤⑥ | C.②③⑤ | D.①④⑤ |
您最近半年使用:0次
名校
解题方法
8 . 探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
ⅰ.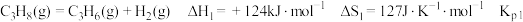
ⅱ.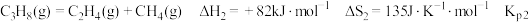
ⅲ.
已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数 见下表。
见下表。
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ_____ 反应 ⅱ(填“>”或“<”)。
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:_____ 。
②平衡体系中检测不到 ,可认为存在反应:
,可认为存在反应: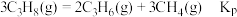 ,下列相关说法正确的是
,下列相关说法正确的是_____ (填标号)。
a.
b.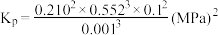
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性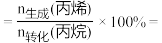
_____ (列出计算式)。
(3)丙烷甲醇共进料时,还发生反应:ⅳ.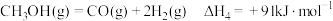 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
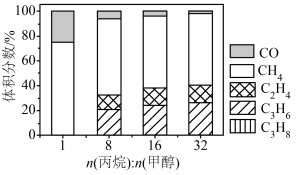
①进料比n(丙烷):n(甲醇) 时,体系总反应:
时,体系总反应: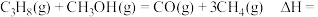
______  。
。
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是______ 。
ⅰ.
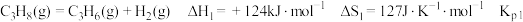
ⅱ.
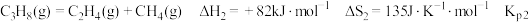
ⅲ.

已知:
 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数 见下表。
见下表。| 物质 | 丙烯 | 乙烯 | 甲烷 | 丙烷 | 氢气 |
| 体积分数(%) | 21 | 23.7 | 55.2 | 0.1 | 0 |
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:
②平衡体系中检测不到
 ,可认为存在反应:
,可认为存在反应: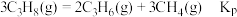 ,下列相关说法正确的是
,下列相关说法正确的是a.

b.
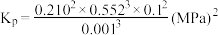
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性
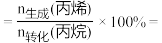
(3)丙烷甲醇共进料时,还发生反应:ⅳ.
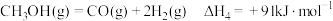 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷):n(甲醇)
 时,体系总反应:
时,体系总反应: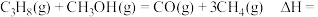
 。
。②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是
您最近半年使用:0次
名校
9 . 在373K时,把0.5molN2O4气体通入体积为5L 的恒容密闭容器中,发生反应: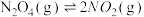 立即出现红棕色。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是
立即出现红棕色。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是
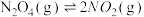 立即出现红棕色。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是
立即出现红棕色。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是| A.前60秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s) |
B.在 60秒时,  物质的量为0.2mol 物质的量为0.2mol |
| C.在平衡时体系内含N2O4的物质的量为0.2mol |
| D.60秒时,再充入一定量N2O4则可提高N2O4的转化率 |
您最近半年使用:0次
名校
10 . 下列实验中,能达到实验目的是
| A | B | C | D |
| 实现将反应Cu+2Fe3+=Cu2++2Fe2+的化学能转变为电能 | 验证非金属性强弱:Cl>C>Si | 证明:相同温度下的溶解度:Mg(OH)2>Fe(OH)3 | 探究浓度对化学平衡的影响规律: +H2O +H2O 2 2 +2H+ +2H+ |
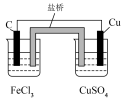 |  | 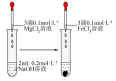 | 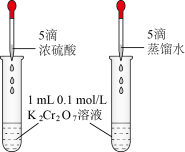 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



