名校
解题方法
1 . 高炉炼铁是现代钢铁生产的重要环节,此法工艺简单,产量大,能耗低,仍是现代炼铁的主要方法,回答下列问题:
(1)已知炼铁过程的主要反应为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1
还会发生3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=a kJ/mol;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=b kJ/mol;
FeO(s)+CO(g)=Fe(s)+ CO2(g) △H4=c kJ/mol;
则△H1=________ kJ/mol(用含a、b、c的代数式表示)。
(2)高炉炼铁产生的废气(CO、CO2)有多种处理方法,反应原理如下:
①生成甲醇:CO(g)+2H2(g)⇌CH3OH(l)。一定温度下在恒容密闭容器中模拟此反应,下列化学反应速率最快的是_______________
A.υ(CO)=1.2 mol/(L·min) B.υ(H2)=0.025 mol/(L·s) C.υ(CH3OH)=1 mol/(L·min)
②生成乙烯:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)。在两个容积相同的密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入原料气,CO2平衡转化率α(CO2)与温度的关系如图所示
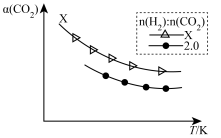
氢碳比X_____ 2.0(填>、<或=,下同),理由是___________________ 。
(3)反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),其化学平衡常数K与温度T关系如表:
①该反应是___________ 反应(填“吸热”或“放热”)。
②若某恒定温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2、3 mol H2,10 min后反应达到平衡状态,测得υ (CH3OH)=0.075 mol/(L·min),则此反应条件下温度______ 800℃(填>、<或=)。
③若反应在1200℃进行试验,某时刻测得反应容器中各物质浓度满足关系式2c(CO2)·c3(H2)=3c(CH3OH)·c(H2O),此时反应在________ 向进行(填“正”或“逆”)。
(1)已知炼铁过程的主要反应为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1
还会发生3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=a kJ/mol;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=b kJ/mol;
FeO(s)+CO(g)=Fe(s)+ CO2(g) △H4=c kJ/mol;
则△H1=
(2)高炉炼铁产生的废气(CO、CO2)有多种处理方法,反应原理如下:
①生成甲醇:CO(g)+2H2(g)⇌CH3OH(l)。一定温度下在恒容密闭容器中模拟此反应,下列化学反应速率最快的是
A.υ(CO)=1.2 mol/(L·min) B.υ(H2)=0.025 mol/(L·s) C.υ(CH3OH)=1 mol/(L·min)
②生成乙烯:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)。在两个容积相同的密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入原料气,CO2平衡转化率α(CO2)与温度的关系如图所示

氢碳比X
(3)反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),其化学平衡常数K与温度T关系如表:
| T/℃ | 700 | 800 | 1000 | 1200 |
| K | 0.6 | 1.0 | 2.3 | 3.6 |
①该反应是
②若某恒定温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2、3 mol H2,10 min后反应达到平衡状态,测得υ (CH3OH)=0.075 mol/(L·min),则此反应条件下温度
③若反应在1200℃进行试验,某时刻测得反应容器中各物质浓度满足关系式2c(CO2)·c3(H2)=3c(CH3OH)·c(H2O),此时反应在
您最近一年使用:0次
2020-06-18更新
|
395次组卷
|
3卷引用:四川省凉山州2020届高三第三次诊断性测试理综化学试题
名校
解题方法
2 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________ 。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?__________ (“是”或“否”),理由是____________________________________________________ 。
(3)对比试管a、b、c的实验现象,可知pH增大
_____ (选填“增大”,“减小”,“不变”);
(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-__________ CrO42-(填“大于”,“小于”,“不确定”);写出此过程中氧化还原反应的离子方程式_________ 。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
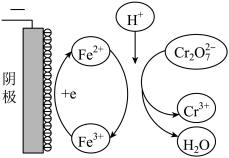
①实验ⅱ中Cr2O72-放电的电极反应式是________________ 。
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________ 。

已知:Cr2O72-(橙色)+H2O
 2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?
(3)对比试管a、b、c的实验现象,可知pH增大

(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
| 实验 | ⅰ | ⅱ | ⅲ | ⅳ |
| 是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
| 是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
| 电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因

您最近一年使用:0次
名校
3 . 某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__ 。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
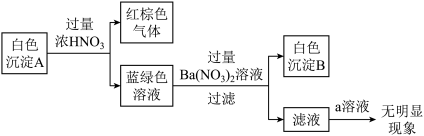
请回答:
①根据白色沉淀B是__ (填化学式),判断沉淀A中一定存在CuSCN。
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__ 。
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__ (填化学式)。
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_ Cu2++_ SCN-=_ CuSCN↓+_ (SCN)2
⑤结合上述过程以及Fe(SCN)3 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__ 。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__ 或__ 。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
①根据白色沉淀B是
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
⑤结合上述过程以及Fe(SCN)3
 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是
您最近一年使用:0次
2020-04-27更新
|
321次组卷
|
5卷引用:2020届高三化学二轮冲刺新题专练——卤素互化物、拟卤素
解题方法
4 . 苯乙稀( )是重要的有机化工原料。工业上以乙苯(
)是重要的有机化工原料。工业上以乙苯(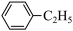 )为原料,采用催化脱氢的方法制取苯乙稀的化学方程式为:
)为原料,采用催化脱氢的方法制取苯乙稀的化学方程式为:  (g)
(g) 
 (g)+H2(g)△H=124kJ·mol-1
(g)+H2(g)△H=124kJ·mol-1
(1)25℃、101 kPa 时,1 mol 可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。 已知:H2 和苯乙烯的燃烧热 △H 分别为-290 kJ·mol -1 和-4400 kJ·mol-1,则乙苯的燃烧热△H=_____ kJ·mol-1。
(2)在体积不变的恒温密闭容器中,发生乙苯催化脱氢的反应,反应过程中各物质浓度随时间变化的关系如图所示。 在 t1 时刻加入 H2,t2 时刻再次达到平衡。

①物质 X 为_____ ,判断理由是_____ ;
②乙苯催化脱氢反应的化学平衡常数为_____ (用含 a、b、c 的式子表示)。
(3)在体积为 2 L 的恒温密闭容器中通入 2 mol 乙苯蒸气,2 min 后达到平衡,测得氢气的浓度是 0.5 mol·L-1,则乙苯蒸气的反应速率为_____ ;维持温度和容器体积不变,向上述平衡中再通入 1.5 mol 氢气和 1.5 mol 乙苯蒸气,则 v 正______ v 逆(填“大于”、“小于”或“等于”)。
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比(M)对乙苯的平衡转化率的影响如图所示。[M= ]
]
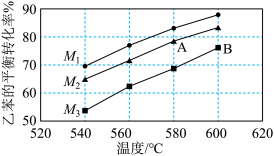
①比较图中 A、B 两点对应的平衡常数大小:KA_____ KB(填“>”、“<”或“=”);
②图中投料比 M1、M2、M3 的大小顺序为_____ 。
 )是重要的有机化工原料。工业上以乙苯(
)是重要的有机化工原料。工业上以乙苯( )为原料,采用催化脱氢的方法制取苯乙稀的化学方程式为:
)为原料,采用催化脱氢的方法制取苯乙稀的化学方程式为:  (g)
(g) 
 (g)+H2(g)△H=124kJ·mol-1
(g)+H2(g)△H=124kJ·mol-1(1)25℃、101 kPa 时,1 mol 可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。 已知:H2 和苯乙烯的燃烧热 △H 分别为-290 kJ·mol -1 和-4400 kJ·mol-1,则乙苯的燃烧热△H=
(2)在体积不变的恒温密闭容器中,发生乙苯催化脱氢的反应,反应过程中各物质浓度随时间变化的关系如图所示。 在 t1 时刻加入 H2,t2 时刻再次达到平衡。

①物质 X 为
②乙苯催化脱氢反应的化学平衡常数为
(3)在体积为 2 L 的恒温密闭容器中通入 2 mol 乙苯蒸气,2 min 后达到平衡,测得氢气的浓度是 0.5 mol·L-1,则乙苯蒸气的反应速率为
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比(M)对乙苯的平衡转化率的影响如图所示。[M=
 ]
]
①比较图中 A、B 两点对应的平衡常数大小:KA
②图中投料比 M1、M2、M3 的大小顺序为
您最近一年使用:0次
2020-03-27更新
|
167次组卷
|
2卷引用:山东省泰安市2019-2020学年高二上学期期末考试化学试题
名校
5 . 硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
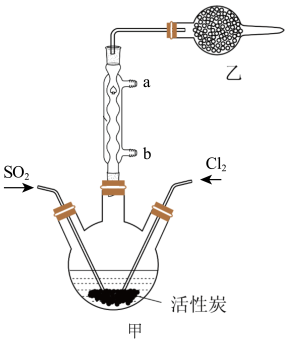
I.SO2Cl2的制备
(1)水应从___ (选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___ (填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___ 。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___ 。
(5)反应结束后,分离甲中混合物的最佳实验操作是___ 。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___ 。
(7)产品中SO2Cl2的质量分数为___ %,若步骤③不加入硝基苯则所测SO2Cl2含量将___ (填“偏高”、“偏低”或“无影响”)。
 SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
I.SO2Cl2的制备
(1)水应从
(2)制取SO2的最佳组合是
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是
(4)制备过程中需要将装置甲置于冰水浴中,原因是
(5)反应结束后,分离甲中混合物的最佳实验操作是
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为
(7)产品中SO2Cl2的质量分数为
您最近一年使用:0次
2019-12-10更新
|
482次组卷
|
3卷引用:2019年四川省泸州市高三第一次教学质量检测理综化学试题
名校
解题方法
6 . 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:

(1)上述反应平衡常数K的表达式为________________ ,温度降低,平衡常数K________ (填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________ 。从反应到平衡时CO2转化率=________
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________ (填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
 CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
(1)上述反应平衡常数K的表达式为
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
您最近一年使用:0次
2019·浙江·一模
7 . 化石能源的脱硫处理是环保热点问题。 用臭氧处理燃煤烟气脱硫的主要反应如下:
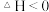 ,向1L反应装置充入
,向1L反应装置充入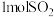 和
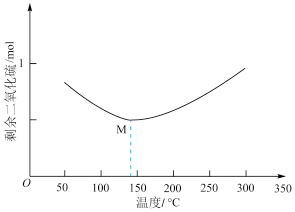
和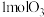 ,经过相同反应时间t后剩余
,经过相同反应时间t后剩余 的物质的量与温度关系如图所示:
的物质的量与温度关系如图所示:
已知臭氧会转化成氧气: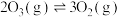 ,在上述反应条件下臭氧分解率与温度关系如下:
,在上述反应条件下臭氧分解率与温度关系如下:
(1)关于脱硫的主要反应,下列说法错误的是______________ 。
A. 50℃时,缩小反应装置的体积可以提高相同时间t内SO2的转化率
B.M点该反应处于平衡状态
C.温度越高,该反应的平衡常数越小
D.随温度的升高,正反应速率变大,逆反应速率减小
(2)200℃以后随着温度升高,SO2的物质的量增多的原因可能是______________________ 。
(3)已知250℃时 的平衡常数
的平衡常数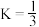 ,求该温度下反应
,求该温度下反应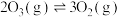 的平衡常数
的平衡常数
__________ 。
(4)其他条件不变,经过相同反应时间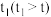 ,在图中画出剩余SO2的物质的量在
,在图中画出剩余SO2的物质的量在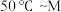 点温度范围内的关系趋势图
点温度范围内的关系趋势图____________ 。
(5)烟气脱硫后续还需用碱液吸收 形成
形成 ,溶液pH为
,溶液pH为 之间时
之间时 在电解池阴极上被还原成连二硫酸根
在电解池阴极上被还原成连二硫酸根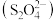 ,写出该电极反应式:
,写出该电极反应式:____________ 。

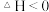 ,向1L反应装置充入
,向1L反应装置充入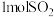 和
和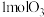 ,经过相同反应时间t后剩余
,经过相同反应时间t后剩余 的物质的量与温度关系如图所示:
的物质的量与温度关系如图所示:
已知臭氧会转化成氧气:
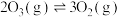 ,在上述反应条件下臭氧分解率与温度关系如下:
,在上述反应条件下臭氧分解率与温度关系如下:温度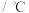 | 50 | 100 | 150 | 200 | 250 | 300 |
 分解率 分解率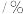 | 0 | 0 | 0 | 4 | 20 | 81 |
A. 50℃时,缩小反应装置的体积可以提高相同时间t内SO2的转化率
B.M点该反应处于平衡状态
C.温度越高,该反应的平衡常数越小
D.随温度的升高,正反应速率变大,逆反应速率减小
(2)200℃以后随着温度升高,SO2的物质的量增多的原因可能是
(3)已知250℃时
 的平衡常数
的平衡常数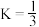 ,求该温度下反应
,求该温度下反应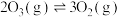 的平衡常数
的平衡常数
(4)其他条件不变,经过相同反应时间
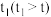 ,在图中画出剩余SO2的物质的量在
,在图中画出剩余SO2的物质的量在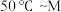 点温度范围内的关系趋势图
点温度范围内的关系趋势图(5)烟气脱硫后续还需用碱液吸收
 形成
形成 ,溶液pH为
,溶液pH为 之间时
之间时 在电解池阴极上被还原成连二硫酸根
在电解池阴极上被还原成连二硫酸根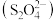 ,写出该电极反应式:
,写出该电极反应式:
您最近一年使用:0次



