名校
1 . 一定温度下,将2molSO2和1molO2冲入10L恒温密闭容器中,发生反应:2SO2(g)+O2(g)⇌ 2SO3(g)ΔH═-196kJ/mol,5min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
| A.0~5min内,用O2表示的平均反应速率υ(O2)═0.017mol·(L·min)-1 |
| B.条件不变,起始时向容器中冲入4molSO2和2molO2,平衡时反应放热小于333.2kJ |
| C.若增大O2的浓度,则SO2的转化率增大 |
D.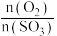 的值不变时,该反应达到平衡状态 的值不变时,该反应达到平衡状态 |
您最近一年使用:0次
2019-12-06更新
|
211次组卷
|
2卷引用:第2章《化学键 化学反应规律》单元测试——鲁科版(2019)必修第二册
名校
解题方法
2 . 一定条件下,体积为2L的密闭容器中,1molX和3mol Y进行反应:X(g)+3Y(g) 2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
 2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )| A.以X浓度变化表示的反应速率为0.125mol/(L·s) |
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的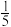 |
| C.若增大X的浓度,则物质Y的转化率减小 |
| D.若该反应的ΔH<0,升高温度,平衡常数K减小 |
您最近一年使用:0次
2019-11-21更新
|
145次组卷
|
11卷引用:2018-2019学年人教版高中化学选修四章化学反应速率和化学平衡末综合测评(二)
2018-2019学年人教版高中化学选修四章化学反应速率和化学平衡末综合测评(二)(已下线)2011届北京市大兴区高三上学期期末考试化学试卷(已下线)2011-2012学年南京学大教育专修学校高二暑期结业测试理科化学试卷(已下线)浙江省普通高校招生2019届选考科目化学模拟试卷(已下线)2018年11月浙江省普通高校招生选考科目考试化学仿真模拟试卷02(已下线)2019年1月浙江省普通高中学业水平考试化学仿真模拟试题02吉林省长春九台师范高中2019-2020学年高二上学期期中考试化学试卷河南省许昌市许昌县第三高级中学2019-2020学年高二月考化学试题湖南省长沙宁乡市第十高级中学2020-2021学年高二上学期10月月考化学试题陕西省绥德中学2020-2021学年高二下学期6月质量检测化学试题重庆市天星桥中学2021-2022学年高二上学期第二次月考化学试题
3 . 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
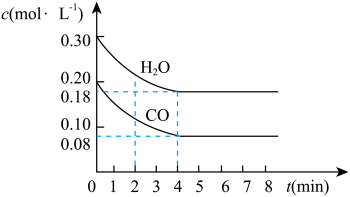
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=___ mol/(L·min),v(H2)=___ mol/(L·min),v(CO2)=___ mol/(L·min)。
(2)请你在图中标出CO2和H2的浓度变化。___
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3min~4min之间,反应处于___ 状态;c1___ 0.08mol/L(填“大于”、“小于”或“等于”)。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是___ (单选),表中5min~6min之间数值发生变化,可能的原因是___ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
 CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=
(2)请你在图中标出CO2和H2的浓度变化。
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
| 时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
| CO | 0.200 | 0.138 | c1 | c1 | 0.116 | 0.096 |
| H2O | 0.300 | 0.238 | c2 | c2 | 0.216 | 0.266 |
| CO2 | 0 | 0.062 | c3 | c3 | 0.084 | 0.104 |
| H2 | 0 | 0.062 | c4 | c4 |
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
您最近一年使用:0次
2019-11-19更新
|
436次组卷
|
2卷引用:人教版高中化学(2019)必修第二册第六章《化学反应与能量》检测题
真题
名校
4 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
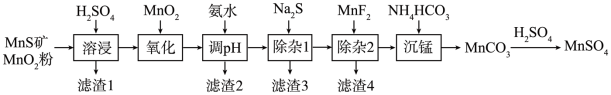
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19501次组卷
|
29卷引用:高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测
高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学
名校
5 . 反应:H2(g)+ I2(g) 2HI(g) △H ﹤0 达平衡后,下列说法正确的是
2HI(g) △H ﹤0 达平衡后,下列说法正确的是
 2HI(g) △H ﹤0 达平衡后,下列说法正确的是
2HI(g) △H ﹤0 达平衡后,下列说法正确的是| A.增加H2的量,反应放出的热量减小 | B.升高温度,反应放出的热量增加 |
| C.增大压强,反应放出的热量不变 | D.加入催化剂,反应的△H减小 |
您最近一年使用:0次
2019-02-19更新
|
307次组卷
|
3卷引用:2020年人教版高二化学选修4化学反应原理第二章《化学反应速率与平衡》练习3-1
18-19高二上·湖北荆州·期末
名校
6 . 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g) CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不 正确的是
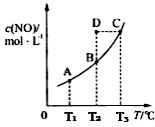
 CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
| A.该反应正反应的△H<0 |
| B.若状态A、B的逆反应速率分别为v逆(A)、v逆(B),则v逆(A)>v逆(B) |
| C.在T2时,若反应体系处于状态D,则此时v正>v逆 |
| D.若状态B、C、D的压强分别为PB、PC、PD,则 PC>PD=PB |
您最近一年使用:0次
2019-02-06更新
|
823次组卷
|
6卷引用:第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)
(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)【全国百强校】湖北省荆州中学2018-2019学年高二上学期期末考试化学试题湖北省利川市第五中学2019-2020学年高二12月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡的图像分析(强化练习)辽宁省葫芦岛市普通高中2019-2020高二上学期期末质量测试化学试题吉林油田高级中学2019-2020学年高一下学期期末考试化学试题
真题
名校
7 . 下列实验事实不能用平衡移动原理解释的是
A. |
B. |
C. |
D. |
您最近一年使用:0次
2019-01-30更新
|
1239次组卷
|
29卷引用:苏教版化学高中必修4模块综合检测题
苏教版化学高中必修4模块综合检测题2013年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)(已下线)2014届高考化学二轮复习提分训练 专题6化学反应速率和化学平衡练习卷(已下线)2014届高考化学三轮复习排查 专题6化学反应速率和化学平衡练习卷(已下线)2014~2015学年黑龙江省哈六中高二上学期期中化学试卷2015届山东省潍坊市一中高三12月月考试化学试卷2014-2015学年湖北省荆州市松滋四中高二下学期6月月考化学试卷2014-2015学年广东省广州地区人教版高二上期末化学理试卷2015-2016学年山东省济宁市高二上学期期末考试化学试卷2015-2016学年陕西省长安区一中高二上期末理化学试卷2016届河南省三门峡市陕州中学高三下尖子生专题训练(三)理综化学试卷2015-2016学年江苏省江阴市青阳中学高二下期中化学试卷2018版化学(苏教版)高考总复习专题七对接高考精练--化学平衡的移动甘肃省兰州第一中学2017-2018学年高二12月月化学试题宁夏长庆高级中学2018届高三第四次月考理综化学试卷北京师大附中2017-2018学年上学期高二年级期中考试化学试卷(已下线)二轮复习测试专项-专题09 化学反应速率与化学平衡【全国校级联考】湖北省鄂东南省级示范高中教育教学改革联盟校2017-2018学年高二下学期期中考试化学试题福建省永春县第一中学2017-2018高二下学期期末考试化学试题【全国区级联考】北京市东城区2017-2018学年高二下学期期末考试化学试题四川省广安市邻水实验学校2018-2019学年高二上学期第三次月考化学试题福建省永春县第一中学2018-2019学年高二上学期期末考试(理)化学试题四川省邻水市实验中学2019-2020学年高二12月月考化学试题北京师范大学附中2019-2020学年高二上学期期中考试化学试题河北省唐山遵化市2019-2020学年高二上学期期中考试化学试题北京市石景山区2020-2021学年高二上学期期末调研化学试题北京市日坛中学2022-2023学年高二上学期期中考试化学试题北京市第四十三中学2021-2022学年高二上学期期中考试化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷
8 . 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是A.CO与HbO2反应的平衡常数K=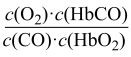 |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向逆反应方向移动 |
您最近一年使用:0次
2019-01-30更新
|
1615次组卷
|
33卷引用:选择性必修1 化学反应原理综合训练
选择性必修1 化学反应原理综合训练2009年普通高等学校招生统一考试理综试题化学部分(天津卷)(已下线)09-10年湖北恩施高二下学期期末测试化学卷(已下线)2010年江西省九江一中高二上学期第一次月考(化学)(已下线)2010年河北省邯郸市高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省台州中学高二下学期第一次统练化学试卷(已下线)2011-2012学年浙江省温州四中高二下学期期中考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二期末考试化学试卷(已下线)2013-2014学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷2015-2016学年浙江省东阳中学高二上学期12月阶段测化学试卷2016-2017学年辽宁省鞍山一中高二上期中化学试卷福建省莆田市第七中学2016-2017学年高二下学期第二次月考化学试题北京市第161中学2017-2018学年高二上学期期中适应性训练化学试题【校级联考】福建省平和一中、南靖一中等五校2018-2019学年高二上学期第一次联考化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二(理)上学期期中考试化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二下学期第一次月考(开学)化学试题山西大学附属中学2019-2020学年高二10月月考化学试题河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题云南省楚雄市实验中学2018—2019学年高二上学期11月月考化学试题鲁科版(2019)选择性必修1化学反应原理 综合训练高中必刷题高二选择性必修1化学反应原理综合训练四川省广安市武胜烈面中学校2020-2021学年高二上学期10月月考化学试题广东省汕头市澄海中学2020-2021学年高二上学期期中考试化学(选考)试题重庆实验外国语学校2022届高三上学期开学考试化学试题河北省衡水市第十四中学2021-2022学年高二上学期二调考试化学试题(已下线)2.4 化学反应的调控(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)广东实验中学2021-2022学年高二上学期期中考试化学试题(已下线)2.2.3 化学平衡常数(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)辽宁省沈阳市铁西区重点协作校2021-2022学年高二上学期期中考试化学试题山东省德州市第一中学2022-2023学年高二上学期10月月考化学试题云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题福建省莆田第一中学2023-2024学年高二上学期期中考试化学试题
9 . 饱和氨水中存在化学平衡和电离平衡:NH3+H2O NH3·H2O
NH3·H2O NH
NH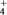 +OH-。下列有关说法正确的是( )
+OH-。下列有关说法正确的是( )
 NH3·H2O
NH3·H2O NH
NH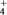 +OH-。下列有关说法正确的是( )
+OH-。下列有关说法正确的是( )| A.常温下饱和氨水的pH<7 |
| B.向氨水中滴加过量硫酸,所有平衡均正向移动,pH增大 |
| C.电离是吸热过程,升高温度,所有平衡均正向移动 |
| D.向饱和氨水中加入适量NaOH固体,所有平衡均逆向移动,有NH3放出 |
您最近一年使用:0次
2018-09-08更新
|
1255次组卷
|
7卷引用:2018-2019学年人教版高中化学选修四水溶液中的离子平衡章末综合测评题(三)
2018-2019学年人教版高中化学选修四水溶液中的离子平衡章末综合测评题(三)(已下线)2019年3月3日《每日一题》二轮复习- 每周一测(已下线)专题8.1 弱电解质的电离平衡(讲)-《2020年高考一轮复习讲练测》(已下线)3.1.2 弱电解质的电离平衡(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)3.2.1 弱电解质的电离平衡-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
解题方法
10 . 褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。

已知色氨酸水溶液中存在平衡:
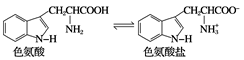
下列说法不正确的是

已知色氨酸水溶液中存在平衡:

下列说法不正确的是
| A.色氨酸分子中存在氨基和羧基,能反应生成盐 |
| B.在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
| C.在一定条件下,色氨酸可发生脱水缩合反应 |
| D.褪黑素与色氨酸结构相似,也具有两性化合物的特性 |
您最近一年使用:0次
2018-08-24更新
|
345次组卷
|
5卷引用:第四章 本章达标检测
第四章 本章达标检测2018-2019学年苏教版高二化学选修5《氨基酸》同步检测题(已下线)考点39 生命中基本的有机化学物质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点40 生命中基本的有机化学物质-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第57练 蛋白质-2023年高考化学一轮复习小题多维练(全国通用)



