1 . (1)K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l) 2CrO42-(aq)+ 2H+(aq),平衡常数表达式
2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________ 已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入氢氧化钠溶液呈___ 色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________ 色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________ 这种改变的方向移动,
(2)在KMnO4与H2C2O4反应中,可通过测定_________________ 来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:__________________ ;此反应开始反应缓慢,随后反应迅速加快,其原因是______ (填字母)
A. KMnO4溶液中的H+起催化作用
B. 生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D. 在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
①该实验进行的目的是_____________ 淀粉溶液的作用是____________ 。
②表中Vx=_______ mL,比较t1、t2、t3大小____________ ,试推测该实验结论: ____________
 2CrO42-(aq)+ 2H+(aq),平衡常数表达式
2CrO42-(aq)+ 2H+(aq),平衡常数表达式(2)在KMnO4与H2C2O4反应中,可通过测定
A. KMnO4溶液中的H+起催化作用
B. 生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D. 在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验 序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
②表中Vx=
您最近一年使用:0次
名校
2 . 已知K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
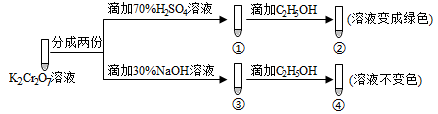
结合实验,下列说法正确的是
 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
结合实验,下列说法正确的是
| A.①中溶液变黄,③中溶液橙色加深 |
| B.上述可逆反应的平衡常数:①<③ |
| C.K2Cr2O7溶液的氧化性在酸性条件下更强 |
| D.若向④中加入70%H2S04溶液至过量,溶液变为橙色 |
您最近一年使用:0次
2017-03-31更新
|
561次组卷
|
4卷引用:黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题
名校
解题方法
3 . 实验小组探究酸对Fe3++3SCN-⇌Fe(SCN)3平衡的影响。将0.005mol·L-1FeCl3溶液(接近无色)和0.01mol·L-1KSCN溶液等体积混合,得到红色溶液。
(1)FeCl3溶液呈酸性的原因是___ (用离子方程式表示)。
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中___ 增大,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
[查阅资料]
Fe3+和Cl-、SO 均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO
均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO ⇌[Fe(SO4)2]-(无色)。
⇌[Fe(SO4)2]-(无色)。
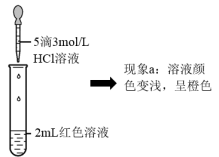
实验I.探究现象a中溶液颜色变化的原因
(3)实验①的目的是___ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:___ 。
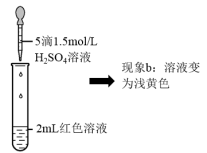
实验II.探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是___ 。
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:___ 、___ 。
(1)FeCl3溶液呈酸性的原因是
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
 |  |
Fe3+和Cl-、SO
 均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO
均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO ⇌[Fe(SO4)2]-(无色)。
⇌[Fe(SO4)2]-(无色)。实验I.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol·L-1KCl溶液 | 溶液颜色变浅,呈橙色 |
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验II.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL0.0025mol·L-1Fe2(SO4)3溶液(无色)。加入1mL0.01mol·L-1KSCN溶液,再加入5滴1.5mol·L-1H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol·L-1FeCl3溶液, |
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
2021-04-01更新
|
557次组卷
|
9卷引用:河北省石家庄市第二中学2021届高三3月学情考试化学试题
河北省石家庄市第二中学2021届高三3月学情考试化学试题北京市清华大学附属中学2022-2023学年高三上学期12月统练六化学试题北京市海淀区2021届高三上学期期末考试化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)江苏省宜兴市张渚高级中学2020-2021学年高二下学期期中考试化学试题(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)北京市第十五中学2021-2022学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题(已下线)北京市海淀区2022届高三一模(实验探究题)
名校
解题方法
4 . 某实验小组同学对影响CuSO4溶液和浓氨水反应产物的因素进行了如下探究。
【查阅资料】
①Cu(OH)2(s) Cu2+ + 2OH— Ksp = 2.2×10-20;
Cu2+ + 2OH— Ksp = 2.2×10-20;
 Cu2+ + 4NH3 K = 4.8×10-14。
Cu2+ + 4NH3 K = 4.8×10-14。
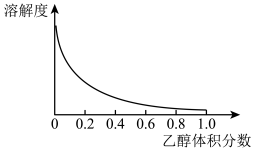
②Cu(NH3)4SO4·H2O是一种易溶于水、难溶于乙醇的深蓝色固体,加热分解有氨气放出。Cu(NH3)4SO4·H2O在乙醇-水混合溶剂中的溶解度如下图所示。
【实验 1】CuSO4溶液和浓氨水的反应。
(1)进一步实验证明,深蓝色溶液A、B中均含有 ,相应的实验方案为
,相应的实验方案为___________________________ (写出实验操作及现象)。
【实验 2】探究影响 CuSO4溶液和浓氨水反应产物的因素。
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________ 。
②试剂a为___________________________ 。
(3)利用平衡移动原理对实验2-2的现象进行解释:_______________ 。
(4)实验2-3的目的是___________________ 。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有______________ 。
【查阅资料】
①Cu(OH)2(s)
 Cu2+ + 2OH— Ksp = 2.2×10-20;
Cu2+ + 2OH— Ksp = 2.2×10-20;
 Cu2+ + 4NH3 K = 4.8×10-14。
Cu2+ + 4NH3 K = 4.8×10-14。②Cu(NH3)4SO4·H2O是一种易溶于水、难溶于乙醇的深蓝色固体,加热分解有氨气放出。Cu(NH3)4SO4·H2O在乙醇-水混合溶剂中的溶解度如下图所示。

【实验 1】CuSO4溶液和浓氨水的反应。
| 序号 | 实验内容 | 实验现象 |
| 1-1 | 向2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入2 mL 1 mol/L氨水 | 立即出现浅蓝色沉淀,溶液变无色;随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液A |
| 1-2 | 向 2 mL 1 mol/L氨水中逐滴加入 2mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液B |
 ,相应的实验方案为
,相应的实验方案为【实验 2】探究影响 CuSO4溶液和浓氨水反应产物的因素。
| 序号 | 实验内容 | 实验现象 |
| 2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
| 2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
| 2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
| 序号 | 实验内容 | 实验现象 |
| 2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
②试剂a为
(3)利用平衡移动原理对实验2-2的现象进行解释:
(4)实验2-3的目的是
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有
您最近一年使用:0次
2020-06-28更新
|
479次组卷
|
4卷引用:北京市中央民族大学附属中学2021-2022学年高三下学期2月适应性练习化学试题
北京市中央民族大学附属中学2021-2022学年高三下学期2月适应性练习化学试题北京市海淀区中央民族大学附属中学2020届高三考前热身化学试题北京市清华大学附属中学2020届高三三模试卷化学试题(已下线)第七单元 水溶液中的离子平衡测试题-2021年高考化学一轮复习名师精讲练
5 . 某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
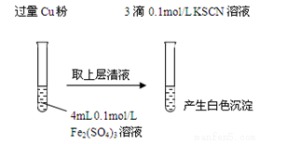
(1) Fe3+与Cu粉发生反应的离子方程式为:________________________________________ 。
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2+ + 4 I-= 2CuI↓+ I2
则Cu2+与SCN-反应的离子方程式为________________________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2+ + NO Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO 产生的原因_______________________________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
① 依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________ (填“快”或“慢”)。
② 乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______________________________ 。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________________________ 。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+ Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。
实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________
实验Ⅰ:将Fe3+转化为Fe2+

(1) Fe3+与Cu粉发生反应的离子方程式为:
(2)探究白色沉淀产生的原因,请填写实验方案:
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL | 产生白色沉淀 | CuSO4与KSCN 反应产生了白色沉淀 |
| 步骤2:取 | 无明显现象 |
则Cu2+与SCN-反应的离子方程式为
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2+ + NO
 Fe(NO)2+(棕色)
Fe(NO)2+(棕色)(3)用离子方程式解释NO 产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
① 依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ
② 乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+
 Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

您最近一年使用:0次
2018-10-30更新
|
308次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2019-2020学年高二下学期第一次在线月考化学试题
名校
6 . 手机主板中含有贵金属单质Au(金)、Ag和Pd(钯)。如图方法可从侤旧手机主板中回收贵金属。

已知:i.Au+3 +6H+
+6H+ Au3++3NO2↑+3H2O K<10-5
Au3++3NO2↑+3H2O K<10-5
Au+ +4H+
+4H+ Au3++NO↑+2H2O K<10-5
Au3++NO↑+2H2O K<10-5
Au3++4Cl- [AuCl4]- K>105
[AuCl4]- K>105
ii.HAuCl4=H++[AuCl4]-
(1)酸浸前,将废旧手机主板粉碎的目的是_______ 。
(2)已知:王水[V(浓硝酸):V(浓盐酸)=1:3]溶金反应时产生NO。
①写出该反应的离子方程式:________ 。
②从反应原理的角度解释浓盐酸的作用________ 。
(3)若用Zn粉将溶液中的1molHAuCl4完全还原,则参加反应的Zn的物质的量是________ mol。
(4)AgCl溶于氨水的离子方程式为________ 。
(5)水合肼(N2H4•H2O)是一种液态还原剂,能直接与AgCl反应生成单质Ag。上述工艺中,先将氯化银溶于氨水,再与水合肼反应,除了“碱性条件下水合肼的还原性增强”,还具有的优点可能有________ (写出一条即可)。
(6)Pd(NH3)2Cl2难溶于水,溶于氨水,是一种电镀试剂,是制备钯及其化合物的重要原料。加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,则该条件下配位能力:Cl-_______ NH3(填“>”或“<”)。

已知:i.Au+3
 +6H+
+6H+ Au3++3NO2↑+3H2O K<10-5
Au3++3NO2↑+3H2O K<10-5Au+
 +4H+
+4H+ Au3++NO↑+2H2O K<10-5
Au3++NO↑+2H2O K<10-5Au3++4Cl-
 [AuCl4]- K>105
[AuCl4]- K>105ii.HAuCl4=H++[AuCl4]-
(1)酸浸前,将废旧手机主板粉碎的目的是
(2)已知:王水[V(浓硝酸):V(浓盐酸)=1:3]溶金反应时产生NO。
①写出该反应的离子方程式:
②从反应原理的角度解释浓盐酸的作用
(3)若用Zn粉将溶液中的1molHAuCl4完全还原,则参加反应的Zn的物质的量是
(4)AgCl溶于氨水的离子方程式为
(5)水合肼(N2H4•H2O)是一种液态还原剂,能直接与AgCl反应生成单质Ag。上述工艺中,先将氯化银溶于氨水,再与水合肼反应,除了“碱性条件下水合肼的还原性增强”,还具有的优点可能有
(6)Pd(NH3)2Cl2难溶于水,溶于氨水,是一种电镀试剂,是制备钯及其化合物的重要原料。加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,则该条件下配位能力:Cl-
您最近一年使用:0次
2023-08-31更新
|
155次组卷
|
2卷引用:四川省泸县第一中学2023-2024学年高二上学期10月月考化学试题
名校
7 . 某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+
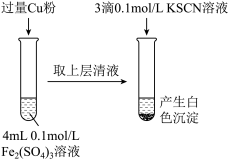
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________ 。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________ 。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________ 。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL① | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
| 步骤2:取4mL② | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO
 Fe(NO)2+(棕色)
Fe(NO)2+(棕色)(3)用离子方程式解释NO产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因
您最近一年使用:0次
2018-04-25更新
|
400次组卷
|
4卷引用:黑龙江省鹤岗市第一中学2020届高三11月月考化学试题
名校
解题方法
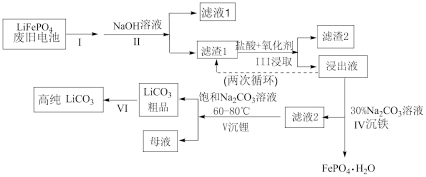
8 . 磷酸亚铁锂电池是新能源汽车的动力电池之一、采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
(1)I步操作是粉碎废旧电极,其主要目的是___________ 。
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是___________ 。
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
(4)浸出液中存在大量 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入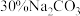 溶液沉铁的主要原理是
溶液沉铁的主要原理是___________ 。
(5)滤液2中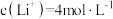 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中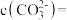
___________ 。[溶液混合后体积变化忽略不计,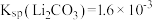 ]
]
(6)为将粗品 提纯,VI步使用
提纯,VI步使用___________ (填“热”或“冰”)水进行洗涤操作,理由是___________ 。
(7)工业上将回收的 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:___________ 。
 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
A. | B.酸性 | C. | D. |
 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入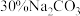 溶液沉铁的主要原理是
溶液沉铁的主要原理是(5)滤液2中
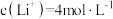 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中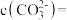
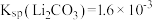 ]
](6)为将粗品
 提纯,VI步使用
提纯,VI步使用(7)工业上将回收的
 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:
您最近一年使用:0次
2022-02-05更新
|
610次组卷
|
7卷引用:北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题
北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题重庆市2021-2022学年高三上学期学业质量调研抽测(第一次)化学试卷(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)北京市通州区2022届高三查缺补漏化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(三)化学试题
9 . 用K2Cr2O7溶液进行下列实验,结合实验,下列说法错误的是
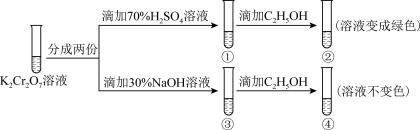
| A.①中溶液橙色加深,③中溶液变黄 |
B.②中 被C2H5OH还原 被C2H5OH还原 |
| C.K2Cr2O7的氧化性强于K2CrO4 |
| D.若向④中加入70%H2SO4溶液至过量,溶液恢复橙色 |
您最近一年使用:0次
名校
10 . 重铬酸铵[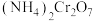 ]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室中将
]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室中将 通入重铬酸(
通入重铬酸(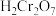 )溶液制备
)溶液制备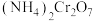 的装置如图所示(夹持装置略)。已知:
的装置如图所示(夹持装置略)。已知: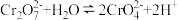 。下列说法错误的是
。下列说法错误的是
 ]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室中将
]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室中将 通入重铬酸(
通入重铬酸(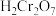 )溶液制备
)溶液制备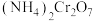 的装置如图所示(夹持装置略)。已知:
的装置如图所示(夹持装置略)。已知: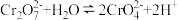 。下列说法错误的是
。下列说法错误的是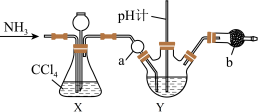
A.装置X可控制通入 的速度且能观察装置Y中是否堵塞 的速度且能观察装置Y中是否堵塞 |
| B.仪器a的作用是防止倒吸 |
C.装置Y中溶液的pH不宜过大,否则会有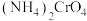 生成 生成 |
D.仪器b中装入的试剂为碱石灰,目的是吸收过量的 |
您最近一年使用:0次
2024-03-13更新
|
36次组卷
|
2卷引用:陕西省渭南市尚德中学2023-2024学年高三上学期考练化学试卷



