1 . 铬是硬度最高的金属,具有良好的抗腐蚀性的耐磨性,常用于制造不锈钢和仪器仪表的金属表面镀铬,用途十分广泛。
(1)铬的常见的氧化——三氧化二铬( ),既能与KOH溶液反应生成
),既能与KOH溶液反应生成 ,又能与硫酸反应生成
,又能与硫酸反应生成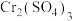 。
。 是
是___________ (填“酸性”“碱性”或“两性”)氧化物,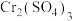 与过量KOH溶液反应的离子方程式为
与过量KOH溶液反应的离子方程式为___________ 。
(2)已知: ,Cr(Ⅲ)体现还原性生成
,Cr(Ⅲ)体现还原性生成 或
或 。在碱性介质中Cr(Ⅲ)有较强的还原性,可使
。在碱性介质中Cr(Ⅲ)有较强的还原性,可使 —淀粉溶液褪色,反应过程中铬元素由
—淀粉溶液褪色,反应过程中铬元素由___________ 转化为___________ (填离子符号);在酸性介质中Cr(Ⅲ)还原性较差,可与强氧化剂反应,可将 还原为
还原为 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(3) 中铬元素的化合价为
中铬元素的化合价为___________ ;将 溶液滴加到淀粉——KI溶液中,溶液变蓝;可使
溶液滴加到淀粉——KI溶液中,溶液变蓝;可使 、
、 和
和 在不同酸碱性条件下氧化性的大小关系是
在不同酸碱性条件下氧化性的大小关系是___________ 。
(1)铬的常见的氧化——三氧化二铬(
 ),既能与KOH溶液反应生成
),既能与KOH溶液反应生成 ,又能与硫酸反应生成
,又能与硫酸反应生成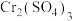 。
。 是
是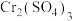 与过量KOH溶液反应的离子方程式为
与过量KOH溶液反应的离子方程式为(2)已知:
 ,Cr(Ⅲ)体现还原性生成
,Cr(Ⅲ)体现还原性生成 或
或 。在碱性介质中Cr(Ⅲ)有较强的还原性,可使
。在碱性介质中Cr(Ⅲ)有较强的还原性,可使 —淀粉溶液褪色,反应过程中铬元素由
—淀粉溶液褪色,反应过程中铬元素由 还原为
还原为 ,其反应的离子方程式为
,其反应的离子方程式为(3)
 中铬元素的化合价为
中铬元素的化合价为 溶液滴加到淀粉——KI溶液中,溶液变蓝;可使
溶液滴加到淀粉——KI溶液中,溶液变蓝;可使 、
、 和
和 在不同酸碱性条件下氧化性的大小关系是
在不同酸碱性条件下氧化性的大小关系是
您最近一年使用:0次
名校
2 . 某小组同学用乙醛进行银镜反应实验时,补充做了以下实验。
已知[Ag(NH3)2]+ Ag++2NH3
Ag++2NH3

下列关于该实验的分析不正确的是
已知[Ag(NH3)2]+
 Ag++2NH3
Ag++2NH3
下列关于该实验的分析不正确的是
| A.实验①无需加热,说明碱性条件有利于银氨溶液与乙醛的反应 |
B.实验①加入NaOH后,溶液中c( )增大 )增大 |
| C.实验表明,乙醛还原的是二氨合银离子中的银元素 |
| D.对比实验①和②知,形成二氨合银离子后银元素的氧化性降低 |
您最近一年使用:0次
名校
解题方法
3 . 某实验小组依据反应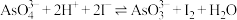 设计如图所示的原电池装置,探究pH对
设计如图所示的原电池装置,探究pH对 氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
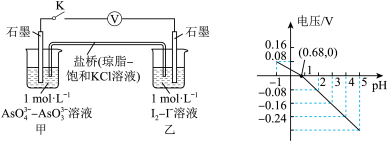
| A.调节pH可以改变反应的方向 | B.pH=0.68时,反应处于平衡状态 |
C.pH>0.68时,氧化性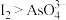 | D.pH=5时,负极电极反应式为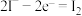 |
您最近一年使用:0次
2022-11-26更新
|
392次组卷
|
4卷引用:安徽省合肥市第一中学2022-2023学年高三上学期11月月考化学试题
名校
解题方法
4 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:①+6价铬盐在一定条件下可被还原为 ,
, 在水溶液中为绿色:②微热
在水溶液中为绿色:②微热 溶液,黄色加深。
溶液,黄色加深。
(1) 溶液中存在的转化反应是
溶液中存在的转化反应是___________ (用离子方程式表示);b试管中加水后平衡___________ (填“正向”、“不”或“逆向”)移动,
___________ (填“增大”、“减小”或“不变”)。
(2)对比试管c和b,推测试管c的现象是___________ 。对比试管a和b,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是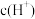 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是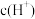 增大对平衡的影响。你认为是否需要再设计实验证明
增大对平衡的影响。你认为是否需要再设计实验证明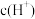 对平衡的影响,并说明理由:
对平衡的影响,并说明理由:___________ 。
(3)分析试管c继续滴加 溶液和过量稀
溶液和过量稀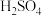 的实验现象,说明+6价铬盐氧化性
的实验现象,说明+6价铬盐氧化性
___________  (填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
(填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为___________ 。

已知:①+6价铬盐在一定条件下可被还原为
 ,
, 在水溶液中为绿色:②微热
在水溶液中为绿色:②微热 溶液,黄色加深。
溶液,黄色加深。(1)
 溶液中存在的转化反应是
溶液中存在的转化反应是
(2)对比试管c和b,推测试管c的现象是
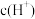 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是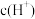 增大对平衡的影响。你认为是否需要再设计实验证明
增大对平衡的影响。你认为是否需要再设计实验证明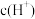 对平衡的影响,并说明理由:
对平衡的影响,并说明理由:(3)分析试管c继续滴加
 溶液和过量稀
溶液和过量稀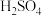 的实验现象,说明+6价铬盐氧化性
的实验现象,说明+6价铬盐氧化性
 (填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
(填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
您最近一年使用:0次
23-24高三上·上海浦东新·阶段练习
名校
5 . 某研究性学习小组通过亚硫酸钠固体和浓硫酸反应制备SO2并进行性质探究。
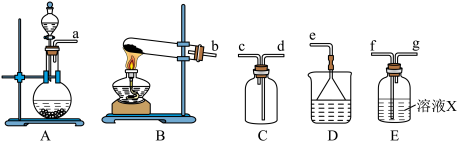
Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为___________ 。
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为___________ (填序号)。
(3)溶液X中盛放的试剂为___________ ,装置D的作用为___________ 。
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性
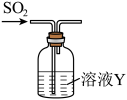
(4)Y是Na2S溶液,可观察到的现象___________ 。Na2S溶液的浓度为0.1 mol/L溶液最多可以吸收标况下的SO2体积为___________ mL(不考虑SO2的溶解)。
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为___________ ,用方程式表示产生该现象的原因___________ 。
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中: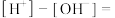
___________ (用溶液中的含硫微粒浓度表示)。
探究活动3:SO2与FeCl3溶液的反应
实验1中出现红棕色的原因,研究小组成员查阅资料得: 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: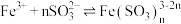 (红棕色)。
(红棕色)。
(7)实验2中,溶液由黄色变为浅绿色的离子方程式为___________ 。
(8)结合速率与平衡的知识,解释实验1颜色变化的原因___________ 。
(9)解释实验2的现象与实验1的现象不同的原因___________ 。

Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为
(3)溶液X中盛放的试剂为
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性

(4)Y是Na2S溶液,可观察到的现象
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中:
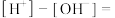
探究活动3:SO2与FeCl3溶液的反应
| 实验 | 溶液Y | 现象 |
| 1 | 1 mol/L FeCl3溶液 | 溶液由黄色变为红棕色,静置,溶液红棕色逐渐消失,1 h后变为浅绿色 |
| 2 | 1 mol/L FeCl3溶液和HCl混合溶液 | 溶液由黄色变为浅绿色 |
 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: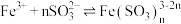 (红棕色)。
(红棕色)。(7)实验2中,溶液由黄色变为浅绿色的离子方程式为
(8)结合速率与平衡的知识,解释实验1颜色变化的原因
(9)解释实验2的现象与实验1的现象不同的原因
您最近一年使用:0次
名校
6 . 新制氢氧化铜存在平衡:Cu(OH)2 +2OH-⇌ (深蓝色)。某同学进行下列实验:
(深蓝色)。某同学进行下列实验:
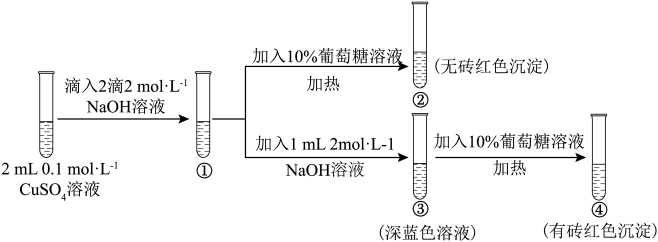
下列说法不正确 的是
 (深蓝色)。某同学进行下列实验:
(深蓝色)。某同学进行下列实验:
下列说法
| A.①中出现蓝色沉淀 |
B.③中现象是Cu(OH)2 +2OH-⇌ 正向移动的结果 正向移动的结果 |
| C.④中现象证明葡萄糖具有还原性 |
D.对比②和④可知Cu(OH)2氧化性强于 |
您最近一年使用:0次
2017-02-17更新
|
747次组卷
|
10卷引用:四川省双流中学2018-2019学年高二6月月考化学试题
四川省双流中学2018-2019学年高二6月月考化学试题北京市中央民族大学附属中学2022届高三9月月考化学试题2017届北京市海淀区高三上学期期末化学试卷【全国百强校】北京师范大学附属中学2017-2018学年高二下学期期中考试化学试题【全国百强校】北京101中学2017-2018学年高二下学期期中考试化学试题安徽省定远县育才学校2019-2020学年高二下学期期末考试化学试题(已下线)2.3.1 浓度对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)湖南省常德市一中2020-2021学年高二上学期期末考试化学试题第四章 生物大分子(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
7 . 在特定碱性条件下,过量 可将
可将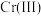 完全氧化成
完全氧化成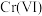 ,其反应为
,其反应为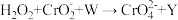 (未配平),下列有关说法错误的是
(未配平),下列有关说法错误的是
 可将
可将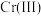 完全氧化成
完全氧化成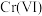 ,其反应为
,其反应为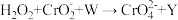 (未配平),下列有关说法错误的是
(未配平),下列有关说法错误的是A.W为 |
B.上述反应中氧化剂和还原剂的物质的量之比为 |
C.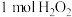 参加反应时,转移电子的物质的量为2mol 参加反应时,转移电子的物质的量为2mol |
D.在酸性条件下 可以转化为 可以转化为 |
您最近一年使用:0次
2022-11-24更新
|
535次组卷
|
5卷引用:天津市第一中学2022-2023学年高三上学期第二次月考化学试题
天津市第一中学2022-2023学年高三上学期第二次月考化学试题吉林省通化市辉南县第六中学2024届高三上学期第二次半月考化学试题(已下线)查补易混易错03 基本概念和基础理论部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)黑龙江省鸡西市新兴实验学校2023-2024学年高三上学期11月期中考试化学试题
名校
8 . Ⅰ.为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
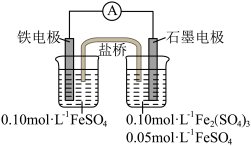
回答下列问题:
(1)实验室用FeSO4•7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和________ (写名称)。
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为________ ,因此,验证了Fe2+氧化性小于________ (写化学符号,下同)
Ⅱ.工业废水中常含有一定量有毒的Cr2O ,必须进行处理。常用的处理方法有两种。
,必须进行处理。常用的处理方法有两种。
方法一:还原沉淀法
该法的工艺流程为:CrO Cr2O
Cr2O
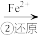 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
(3)第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显________ 色。
(4)写出第②步的离子反应方程式:________ 。
方法二:电解法
该法用Fe做电极电解含Cr2O 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为________ 。

回答下列问题:
(1)实验室用FeSO4•7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为
Ⅱ.工业废水中常含有一定量有毒的Cr2O
 ,必须进行处理。常用的处理方法有两种。
,必须进行处理。常用的处理方法有两种。方法一:还原沉淀法
该法的工艺流程为:CrO
 Cr2O
Cr2O
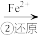 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓(3)第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显(4)写出第②步的离子反应方程式:
方法二:电解法
该法用Fe做电极电解含Cr2O
 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。(5)用Fe做电极的原因为
您最近一年使用:0次
名校
解题方法
9 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,原子核外有_______ 种不同能量的电子,写出其最外层电子的轨道表示式_______ ;碘元素在元素周期表中的位置是_______ ;液溴的保存通常采取的方法是_______ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
(3) 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是_______ 。
(4)已知: 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_______
(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_______
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是_______ (填字母)。
a.海盐提纯:

b.海水提镁:
c.海带提碘: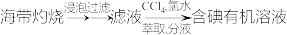

d.海水提溴:
(1)与氯元素同族的短周期元素的原子,原子核外有
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的氧化性 的氧化性 | B. 、 、 、 、 的熔点 的熔点 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是(4)已知:
 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a.海盐提纯:


b.海水提镁:

c.海带提碘:
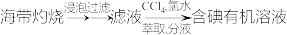

d.海水提溴:

您最近一年使用:0次
2022-11-11更新
|
171次组卷
|
2卷引用:湖北省黄冈市黄梅县育才高级中学2023-2024学年高二下学期3月月考化学试题
10 . 元素铬(Cr)的几种化合物存在下列转化关系:

下列判断不正确 的是

下列判断
A.反应①表明 是两性氧化物 是两性氧化物 |
B.反应②利用了 的氧化性 的氧化性 |
| C.反应③中溶液颜色变化是由化学平衡移动引起的 |
D.从物质性质的角度分析,溶液酸性增强, 的氧化性增强 的氧化性增强 |
您最近一年使用:0次



