解题方法
1 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 向 溶液中滴加过量氯水,再加入淀粉 溶液中滴加过量氯水,再加入淀粉 溶液 溶液 | 先变橙色,后变蓝色 | 氧化性: |
| B | 检验铁锈中是否含有二价铁 | 将铁锈溶于浓盐酸,滴入 溶液,紫色褪去 溶液,紫色褪去 | 铁锈中含有二价铁 |
| C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向 溶液中缓慢滴加硫酸溶液,黄色变为橙红色 溶液中缓慢滴加硫酸溶液,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 一定温度下,烧杯中有25mL对二甲苯和5mL水,加入bmol HA后充分搅拌并完全溶解,静置平衡后HA在对二甲苯(PX)中浓度为 ,在水(W)中浓度为
,在水(W)中浓度为 。已知:
。已知:
①实验条件下HA在两相间的分配系数: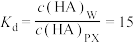 (只与温度有关):
(只与温度有关):
②HA不能在对二甲苯中电离,在水中电离平衡常数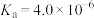 。
。
忽略溶液混合时体积的变化,下列说法错误的是
 ,在水(W)中浓度为
,在水(W)中浓度为 。已知:
。已知:①实验条件下HA在两相间的分配系数:
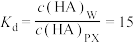 (只与温度有关):
(只与温度有关):②HA不能在对二甲苯中电离,在水中电离平衡常数
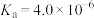 。
。忽略溶液混合时体积的变化,下列说法错误的是
A.水溶液中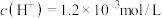 |
B.若向平衡体系中再加入对二甲苯,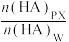 减小 减小 |
C.若向平衡体系中再加入20mL水,平衡后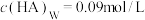 |
D.若向平衡体系中再加入NaOH固体,使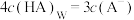 ,平衡后 ,平衡后 |
您最近一年使用:0次
2023-12-05更新
|
298次组卷
|
3卷引用:重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题
名校
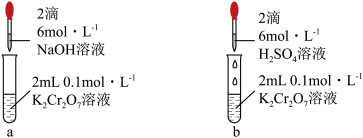
3 . 分析如下实验操作,对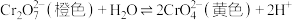 平衡的影响说法正确的是
平衡的影响说法正确的是
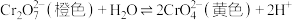 平衡的影响说法正确的是
平衡的影响说法正确的是
| A.元素Cr的价电子数目为1 |
| B.该实验反应属于氧化还原反应 |
| C.试管a中溶液橙色变浅至黄色,说明平衡向正向移动 |
D.试管b中增大 ,平衡向逆向移动,平衡常数减小 ,平衡向逆向移动,平衡常数减小 |
您最近一年使用:0次
2023-02-21更新
|
387次组卷
|
5卷引用:天津市河西区2023届高三上学期期末质量调查化学试题
天津市河西区2023届高三上学期期末质量调查化学试题辽宁省朝阳市部分学校2022-2023学年高二下学期期末考试化学试题江西省抚州市崇仁一中、广昌一中、金溪县第一中学2022-2023学年高二下学期第一次月考联考化学试题广东省佛山市南海区狮山石门高级中学2022-2023学年高二下学期3月月考化学试题(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
名校
解题方法
4 . 如图为可逆反应。A(s)+D(g) E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是
E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是

 E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是
E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是
| A.t3时刻可能采取的措施是减小c(D) | B.t5时刻可能采取的措施是降温 |
| C.t7时刻可能采取的措施是减小压强 | D.t5~t6时间段平衡向逆反应方向移动 |
您最近一年使用:0次
2022-12-14更新
|
326次组卷
|
2卷引用:青海省西宁市海湖中学2022-2023学年高二上学期期末考试化学试题
名校
5 . 下列事实不能用勒夏特列原理解释的是
| A.打开可乐瓶盖后看到有大量气泡逸出 |
| B.H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深 |
| C.新制的氯水在光照条件下颜色变浅,溶液的pH减小 |
| D.实验室可用向浓氨水中加入一定量的氢氧化钠固体来快速制取氨气 |
您最近一年使用:0次
2022-01-23更新
|
394次组卷
|
3卷引用:广东省广州市天河区2021-2022学年高二上学期期末考试化学试题
6 . 血红蛋白分子(Hb)在人体中存在如下过程:①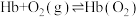
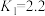 ;
;
②
 。下列说法错误的是
。下列说法错误的是
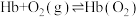
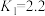 ;
;②

 。下列说法错误的是
。下列说法错误的是A.相比于 ,血红蛋白分子更易与CO结合 ,血红蛋白分子更易与CO结合 |
B.CO中毒时,需立即阻隔(或切断)CO源,使 变小 变小 |
| C.高原地区含氧量低,因此该地区人体内的Hb数量普遍较高 |
| D.CO中毒时,可将病人移入高压氧舱,使平衡②逆向移动 |
您最近一年使用:0次
2022-10-12更新
|
601次组卷
|
8卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题
解题方法
7 . 以磷灰石[主要成分为Ca5(PO4)3F]制备锂离子电池正极材料前体FePO4的实验流程如下:

(1)用磷酸、硫酸“分步浸取”磷灰石制备H3PO4,发生的主要反应如下:
Ca5(PO4)3F+7H3PO4=5Ca(H2PO4)2+HF↑
Ca(H2PO4)2+H2SO4+2H2O=CaSO4·2H2O ↓+2H3PO4
①磷灰石也可直接用硫酸溶解。两种工艺相比,该“分步浸取”工艺的优点是_____________________ 。
②经“酸浸”得到的粗H3PO4为CaSO4∙H3PO4∙H2O 混合体系。“纯化” 步骤控制温度在70 ℃,调节H3PO4质量分数为55%,使CaSO4以结晶水合物析出,过滤。为提高H3PO4的产率,需对CaSO4水合物晶体进行洗涤,并________ ,再将其中部分返回酸浸系统。
(2)将H3PO4溶液、FeSO4溶液和H2O2溶液混合,调节溶液pH,得到FePO4·2H2O,焙烧脱水得FePO4。
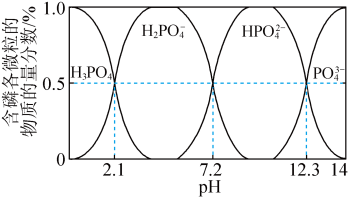
已知: FePO4·2H2O 晶体的纯度及颗粒大小会影响产品性能,沉淀速率过快会形成细小颗粒状粉末;含磷各微粒的物质的量分数与pH的关系如图所示;Fe3++EDTA4-⇌[Fe(EDTA)]-。
① 生成FePO4·2H2O的离子方程式为________ 。
②工业上选择溶液pH为2,此时溶液中c(HPO )为1.0×10-7.3 mol·L-1,则c(PO
)为1.0×10-7.3 mol·L-1,则c(PO )=
)=_____ mol·L-1。
③实际生产时,还加入EDTA四钠盐溶液,其目的是________ 。
④设计以H3PO4溶液、FeSO4溶液和H2O2溶液为原料,制备较大颗粒FePO4·2H2O晶体的实验方案:_________________________ 。 (FePO4·2H2O晶体需“洗涤完全”,除主要原料外,其他试剂任用)

(1)用磷酸、硫酸“分步浸取”磷灰石制备H3PO4,发生的主要反应如下:
Ca5(PO4)3F+7H3PO4=5Ca(H2PO4)2+HF↑
Ca(H2PO4)2+H2SO4+2H2O=CaSO4·2H2O ↓+2H3PO4
①磷灰石也可直接用硫酸溶解。两种工艺相比,该“分步浸取”工艺的优点是
②经“酸浸”得到的粗H3PO4为CaSO4∙H3PO4∙H2O 混合体系。“纯化” 步骤控制温度在70 ℃,调节H3PO4质量分数为55%,使CaSO4以结晶水合物析出,过滤。为提高H3PO4的产率,需对CaSO4水合物晶体进行洗涤,并

(2)将H3PO4溶液、FeSO4溶液和H2O2溶液混合,调节溶液pH,得到FePO4·2H2O,焙烧脱水得FePO4。
已知: FePO4·2H2O 晶体的纯度及颗粒大小会影响产品性能,沉淀速率过快会形成细小颗粒状粉末;含磷各微粒的物质的量分数与pH的关系如图所示;Fe3++EDTA4-⇌[Fe(EDTA)]-。
① 生成FePO4·2H2O的离子方程式为
②工业上选择溶液pH为2,此时溶液中c(HPO
 )为1.0×10-7.3 mol·L-1,则c(PO
)为1.0×10-7.3 mol·L-1,则c(PO )=
)=③实际生产时,还加入EDTA四钠盐溶液,其目的是
④设计以H3PO4溶液、FeSO4溶液和H2O2溶液为原料,制备较大颗粒FePO4·2H2O晶体的实验方案:
您最近一年使用:0次
真题
名校
8 . 在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
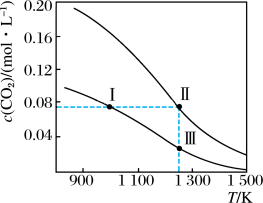
 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.反应CO2(g)+C(s)  2CO(g)的ΔS>0、ΔH<0 2CO(g)的ΔS>0、ΔH<0 |
| B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
| D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
您最近一年使用:0次
2019-11-21更新
|
1545次组卷
|
35卷引用:2015-2016学年江苏省南通中学高二上学期期末化学试卷
2015-2016学年江苏省南通中学高二上学期期末化学试卷2015-2016学年山东省淄博六中高二上学期期末化学试卷江西省高安中学2019-2020学年高二上学期期末考试化学(A卷)试题安徽省滁州市民办高中2019-2020学年高二上学期期末考试化学试题江西省高安中学2019-2020学年高二上学期期末考试化学(B卷)试题河南省漯河市临颍县南街高级中学2019-2020学年高二下学期期末考试化学试题2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2015-2016学年安徽省蚌埠二中高二下学期期中化学试卷2016-2017学年河北省冀州中学高二上期中化学卷2016-2017学年河北省邢台一中高二上月考二化学卷2016-2017学年四川省成都七中高二上11月考试化学卷安徽师范大学附属中学2017-2018学年高二上学期10月月考化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题河南省南阳市第一中学2017-2018学年高二上学期第二次月考化学试题安徽师范大学附属中学2017-2018学年高二上学期期中考查化学试题江西省南昌市第二中学2017-2018学年高二上学期期中考试化学试题江西省南昌二中2017-2018学年高二上学期期中考试化学试卷内蒙古杭锦后旗奋斗中学2017-2018学年高二下学期第一次月考化学试题江西省宁都中学2018-2019学年高二上学期期中考试化学试题【全国百强校】四川省成都市成都外国语学校2018-2019学年高二上学期12月月考化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略黑龙江省哈尔滨师范大学附属中学2019-2020学年高二上学期期中考试化学试题四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分山西大学附属中学2020-2021学年高二上学期期中考试化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题浙江省绍兴市柯桥区2021届高三下学期6月选考科目考试化学试题山东省青岛第二中学2020-2021学年高二上学期期中考试化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题15 化学平衡图像-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
9 . 已知某容器中存在反应,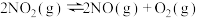
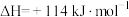 ,
,
 。下列说法错误的是
。下列说法错误的是
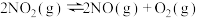
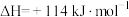 ,
,
 。下列说法错误的是
。下列说法错误的是A.保持恒容,向容器中充入 ,各种物质的物质的量浓度均增大 ,各种物质的物质的量浓度均增大 |
B.保持恒温,增大压强, 物质的量浓度减小 物质的量浓度减小 |
| C.保持恒容,降低温度,气体的平均相对分子质量变大 |
| D.当容器内颜色不再变化时,两反应均达到平衡状态 |
您最近一年使用:0次
2022-01-17更新
|
626次组卷
|
4卷引用:山东省济南市2021-2022上学期高二上学期期末考试化学试题
名校
解题方法
10 . 下列事实不能用勒夏特列原理解释的是
| A.用排饱和食盐水法收集Cl2 |
| B.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| C.500 ℃比室温更有利于合成氨的反应 |
D.工业制取金属钾Na(l)+KCl(l)  NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
您最近一年使用:0次
2022-12-11更新
|
356次组卷
|
2卷引用:四川省凉山州西昌市第二中学2021-2022学年高二上学期期末检测化学试题



