名校
1 . 氰化氢(HCN,易挥发,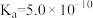 )主要应用于电镀、采矿、药物合成等工业生产。HCN、
)主要应用于电镀、采矿、药物合成等工业生产。HCN、 能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是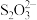 将
将 转化为
转化为 和
和 。验证该转化过程中生成
。验证该转化过程中生成 的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,_______ 。
(2)Cu2+可催化过氧化氢氧化废水中的 。
。
①反应不能在酸性条件下进行,原因是_______
②在含氰废水总量、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得 的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过
的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过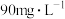 时,
时, 的氧化去除率有所下降,原因是
的氧化去除率有所下降,原因是_______ 。

(3)通过电激发产生 和
和 可处理废水中的
可处理废水中的 ,其可能的反应机理如图所示。
,其可能的反应机理如图所示。
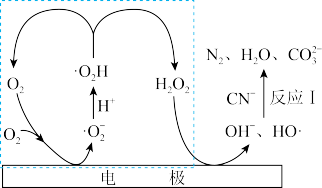
①反应I的离子方程式为_______ 。
②虚线方框内的过程可描述为_______ 。
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应: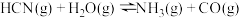

除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是_______ 。

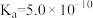 )主要应用于电镀、采矿、药物合成等工业生产。HCN、
)主要应用于电镀、采矿、药物合成等工业生产。HCN、 能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
能抑制人体组织细胞内酶的活性,不能直接排放到环境中。(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是
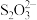 将
将 转化为
转化为 和
和 。验证该转化过程中生成
。验证该转化过程中生成 的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,(2)Cu2+可催化过氧化氢氧化废水中的
 。
。①反应不能在酸性条件下进行,原因是
②在含氰废水总量、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得
 的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过
的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过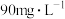 时,
时, 的氧化去除率有所下降,原因是
的氧化去除率有所下降,原因是
(3)通过电激发产生
 和
和 可处理废水中的
可处理废水中的 ,其可能的反应机理如图所示。
,其可能的反应机理如图所示。
①反应I的离子方程式为
②虚线方框内的过程可描述为
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:
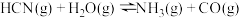

除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是

您最近一年使用:0次
2021-03-26更新
|
1190次组卷
|
6卷引用:江苏省镇江中学2020-2021学年高二下学期期末模拟测试化学试题
2 . 化学常用图像直观地描述化学反应的进程或结果。下列与NH3有关的图像描述正确的是


A.图①表示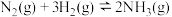 在t1时刻扩大容器体积,v逆随时间变化的曲线 在t1时刻扩大容器体积,v逆随时间变化的曲线 |
B.图②表示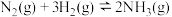 平衡时NH3体积分数随起始 平衡时NH3体积分数随起始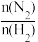 变化的曲线,则转化率:aA(H2)=aB(H2) 变化的曲线,则转化率:aA(H2)=aB(H2) |
| C.图③表示25℃时分别稀释pH=1的NaOH溶液和氨水时溶液pH的变化,曲线Ⅰ表示氨水 |
| D.图④可表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
您最近一年使用:0次
3 . 许多含氯化合物既是重要化工原料,又是高效、广谱灭菌消毒剂。
(1)亚氯酸钠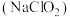 是一种高效漂白剂。在
是一种高效漂白剂。在 溶液中存在
溶液中存在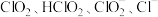 等微粒。经测定,25℃时各组分含量随
等微粒。经测定,25℃时各组分含量随 变化情况如题图-1所示(
变化情况如题图-1所示( 未画出)。其他条件相同时,以
未画出)。其他条件相同时,以 溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
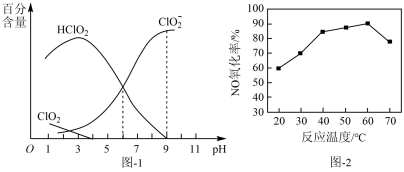
①25℃时,
_______  。25℃时,浓度均为
。25℃时,浓度均为 的HClO2溶液和
的HClO2溶液和 溶液等体积混合后,
溶液等体积混合后,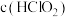
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②酸性条件下,NaClO2能将烟气中的NO氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
③温度高于60℃时,NO氧化率下降,其原因是_______ 。
(2)二氧化氯(ClO2)是一种广谱消毒剂。ClO2在酸性溶液中比较稳定,氧化性随着溶液酸性增强而增强;ClO2在碱性溶液中不能稳定存在,可歧化为NaClO3和NaClO2。以ClO2为吸收剂进行脱硫,实验时测得SO2的脱除率随溶液pH变化如题图-3所示。

①当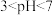 时,随pH的增大,SO2脱除率逐渐降低,其原因是
时,随pH的增大,SO2脱除率逐渐降低,其原因是_______ 。
②在pH约7.6之后,随pH的增大,SO2脱除率又开始升高,其原因是_______ 。
(1)亚氯酸钠
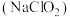 是一种高效漂白剂。在
是一种高效漂白剂。在 溶液中存在
溶液中存在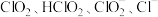 等微粒。经测定,25℃时各组分含量随
等微粒。经测定,25℃时各组分含量随 变化情况如题图-1所示(
变化情况如题图-1所示( 未画出)。其他条件相同时,以
未画出)。其他条件相同时,以 溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
①25℃时,

 。25℃时,浓度均为
。25℃时,浓度均为 的HClO2溶液和
的HClO2溶液和 溶液等体积混合后,
溶液等体积混合后,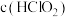
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②酸性条件下,NaClO2能将烟气中的NO氧化为
 ,该反应的离子方程式为
,该反应的离子方程式为③温度高于60℃时,NO氧化率下降,其原因是
(2)二氧化氯(ClO2)是一种广谱消毒剂。ClO2在酸性溶液中比较稳定,氧化性随着溶液酸性增强而增强;ClO2在碱性溶液中不能稳定存在,可歧化为NaClO3和NaClO2。以ClO2为吸收剂进行脱硫,实验时测得SO2的脱除率随溶液pH变化如题图-3所示。

①当
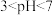 时,随pH的增大,SO2脱除率逐渐降低,其原因是
时,随pH的增大,SO2脱除率逐渐降低,其原因是②在pH约7.6之后,随pH的增大,SO2脱除率又开始升高,其原因是
您最近一年使用:0次
4 . 硫及其化合物之间的转化在生产中有着重要作用。接触法制硫酸中, 制取
制取 的反应为
的反应为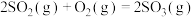
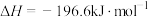 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是

 制取
制取 的反应为
的反应为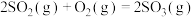
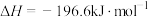 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
A. 催化时,该反应的速率取决于步骤① 催化时,该反应的速率取决于步骤① |
B.使用 作催化剂同时降低了正、逆反应的活化能 作催化剂同时降低了正、逆反应的活化能 |
C.其他条件相同,增大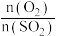 , , 的转化率下降 的转化率下降 |
D.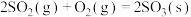 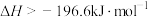 |
您最近一年使用:0次
名校
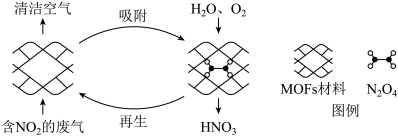
5 . 某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高选择性吸附NO2。废气中的NO2被吸附后,经处理能全部转化为HNO3。原理如图。已知: ,△H<0,下列说法不正确的是
,△H<0,下列说法不正确的是
 ,△H<0,下列说法不正确的是
,△H<0,下列说法不正确的是
| A.气体温度升高后有利于N2O4的固定 |
B.使用多孔材料不能改变 的焓变 的焓变 |
C.使用多孔材料能促进 平衡正向移动,有利于NO2的去除 平衡正向移动,有利于NO2的去除 |
D.加入 H2O和O2,发生化学反应方程式为: |
您最近一年使用:0次
2023-02-22更新
|
313次组卷
|
2卷引用:江苏省南京外国语学校2022-2023学年高三上学期期末考试化学试题
解题方法
6 . 以磷灰石[主要成分为Ca5(PO4)3F]制备锂离子电池正极材料前体FePO4的实验流程如下:

(1)用磷酸、硫酸“分步浸取”磷灰石制备H3PO4,发生的主要反应如下:
Ca5(PO4)3F+7H3PO4=5Ca(H2PO4)2+HF↑
Ca(H2PO4)2+H2SO4+2H2O=CaSO4·2H2O ↓+2H3PO4
①磷灰石也可直接用硫酸溶解。两种工艺相比,该“分步浸取”工艺的优点是_____________________ 。
②经“酸浸”得到的粗H3PO4为CaSO4∙H3PO4∙H2O 混合体系。“纯化” 步骤控制温度在70 ℃,调节H3PO4质量分数为55%,使CaSO4以结晶水合物析出,过滤。为提高H3PO4的产率,需对CaSO4水合物晶体进行洗涤,并________ ,再将其中部分返回酸浸系统。
(2)将H3PO4溶液、FeSO4溶液和H2O2溶液混合,调节溶液pH,得到FePO4·2H2O,焙烧脱水得FePO4。
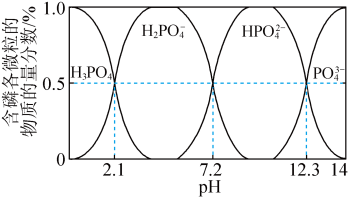
已知: FePO4·2H2O 晶体的纯度及颗粒大小会影响产品性能,沉淀速率过快会形成细小颗粒状粉末;含磷各微粒的物质的量分数与pH的关系如图所示;Fe3++EDTA4-⇌[Fe(EDTA)]-。
① 生成FePO4·2H2O的离子方程式为________ 。
②工业上选择溶液pH为2,此时溶液中c(HPO )为1.0×10-7.3 mol·L-1,则c(PO
)为1.0×10-7.3 mol·L-1,则c(PO )=
)=_____ mol·L-1。
③实际生产时,还加入EDTA四钠盐溶液,其目的是________ 。
④设计以H3PO4溶液、FeSO4溶液和H2O2溶液为原料,制备较大颗粒FePO4·2H2O晶体的实验方案:_________________________ 。 (FePO4·2H2O晶体需“洗涤完全”,除主要原料外,其他试剂任用)

(1)用磷酸、硫酸“分步浸取”磷灰石制备H3PO4,发生的主要反应如下:
Ca5(PO4)3F+7H3PO4=5Ca(H2PO4)2+HF↑
Ca(H2PO4)2+H2SO4+2H2O=CaSO4·2H2O ↓+2H3PO4
①磷灰石也可直接用硫酸溶解。两种工艺相比,该“分步浸取”工艺的优点是
②经“酸浸”得到的粗H3PO4为CaSO4∙H3PO4∙H2O 混合体系。“纯化” 步骤控制温度在70 ℃,调节H3PO4质量分数为55%,使CaSO4以结晶水合物析出,过滤。为提高H3PO4的产率,需对CaSO4水合物晶体进行洗涤,并

(2)将H3PO4溶液、FeSO4溶液和H2O2溶液混合,调节溶液pH,得到FePO4·2H2O,焙烧脱水得FePO4。
已知: FePO4·2H2O 晶体的纯度及颗粒大小会影响产品性能,沉淀速率过快会形成细小颗粒状粉末;含磷各微粒的物质的量分数与pH的关系如图所示;Fe3++EDTA4-⇌[Fe(EDTA)]-。
① 生成FePO4·2H2O的离子方程式为
②工业上选择溶液pH为2,此时溶液中c(HPO
 )为1.0×10-7.3 mol·L-1,则c(PO
)为1.0×10-7.3 mol·L-1,则c(PO )=
)=③实际生产时,还加入EDTA四钠盐溶液,其目的是
④设计以H3PO4溶液、FeSO4溶液和H2O2溶液为原料,制备较大颗粒FePO4·2H2O晶体的实验方案:
您最近一年使用:0次
真题
名校
7 . 在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
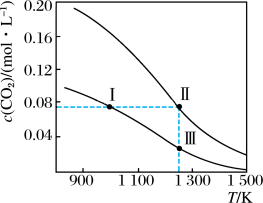
 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.反应CO2(g)+C(s)  2CO(g)的ΔS>0、ΔH<0 2CO(g)的ΔS>0、ΔH<0 |
| B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
| D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
您最近一年使用:0次
2019-11-21更新
|
1545次组卷
|
35卷引用:2015-2016学年江苏省南通中学高二上学期期末化学试卷
2015-2016学年江苏省南通中学高二上学期期末化学试卷2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)2015-2016学年山东省淄博六中高二上学期期末化学试卷江西省高安中学2019-2020学年高二上学期期末考试化学(A卷)试题安徽省滁州市民办高中2019-2020学年高二上学期期末考试化学试题江西省高安中学2019-2020学年高二上学期期末考试化学(B卷)试题河南省漯河市临颍县南街高级中学2019-2020学年高二下学期期末考试化学试题2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2015-2016学年安徽省蚌埠二中高二下学期期中化学试卷2016-2017学年河北省冀州中学高二上期中化学卷2016-2017学年河北省邢台一中高二上月考二化学卷2016-2017学年四川省成都七中高二上11月考试化学卷安徽师范大学附属中学2017-2018学年高二上学期10月月考化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题河南省南阳市第一中学2017-2018学年高二上学期第二次月考化学试题安徽师范大学附属中学2017-2018学年高二上学期期中考查化学试题江西省南昌市第二中学2017-2018学年高二上学期期中考试化学试题江西省南昌二中2017-2018学年高二上学期期中考试化学试卷内蒙古杭锦后旗奋斗中学2017-2018学年高二下学期第一次月考化学试题江西省宁都中学2018-2019学年高二上学期期中考试化学试题【全国百强校】四川省成都市成都外国语学校2018-2019学年高二上学期12月月考化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略黑龙江省哈尔滨师范大学附属中学2019-2020学年高二上学期期中考试化学试题四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分山西大学附属中学2020-2021学年高二上学期期中考试化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题浙江省绍兴市柯桥区2021届高三下学期6月选考科目考试化学试题山东省青岛第二中学2020-2021学年高二上学期期中考试化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题15 化学平衡图像-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
8 . 对于反应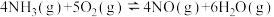
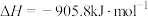 ,下列说法正确的是
,下列说法正确的是
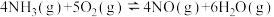
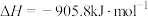 ,下列说法正确的是
,下列说法正确的是A.适当降温加压可提高 的平衡转化率 的平衡转化率 |
B.该反应的平衡常数可表达为 |
| C.分离出NO(g),v(正)增大,平衡向正反应方向移动 |
| D.1mol N-H断裂的同时有1mol O-H断裂,说明反应到达该条件下的平衡状态 |
您最近一年使用:0次
2022-03-09更新
|
484次组卷
|
5卷引用:江苏省南京师范大学附属中学江宁分校2022-2023学年高三上学期期末检测化学试题
名校
9 . 黄铁矿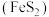 是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化:
是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化: 。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有:
。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有: ;
; 。
。 的反应机理如下:
的反应机理如下:
反应Ⅰ: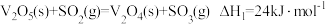
反应Ⅱ:
反应中的能量变化如题图,下列说法不正确的是

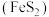 是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化:
是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化: 。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有:
。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有: ;
; 。
。 的反应机理如下:
的反应机理如下:反应Ⅰ:
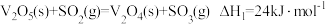
反应Ⅱ:

反应中的能量变化如题图,下列说法不正确的是

A. | B.反应Ⅰ的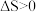 |
C.通入过量空气,可提高 的平衡转化率 的平衡转化率 | D.反应速率由反应Ⅰ决定 |
您最近一年使用:0次
2022-09-13更新
|
300次组卷
|
2卷引用:江苏省南京市六校联合体2022-2023学年高一下学期期末联合调研化学试题
解题方法
10 . 萨巴蒂尔反应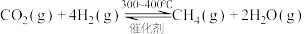 ,与水的电解联合使用是一种重要的载人航天器中氧气再生的方法。下列说法不正确的是
,与水的电解联合使用是一种重要的载人航天器中氧气再生的方法。下列说法不正确的是
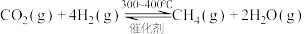 ,与水的电解联合使用是一种重要的载人航天器中氧气再生的方法。下列说法不正确的是
,与水的电解联合使用是一种重要的载人航天器中氧气再生的方法。下列说法不正确的是A.上述反应 | B.增大 , , 的平衡转化率升高 的平衡转化率升高 |
C.上述反应平衡常数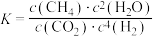 | D.萨巴蒂尔反应产生的 可作航天器燃料 可作航天器燃料 |
您最近一年使用:0次



