2022高三·全国·专题练习
1 . 某温度下,反应CH2=CH2(g)+H2O(g) CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
 CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是A.增大压强,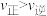 ,平衡常数增大 ,平衡常数增大 |
B.加入催化剂,平衡时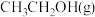 的浓度增大 的浓度增大 |
C.恒容下,充入一定量的 ,平衡向正反应方向移动 ,平衡向正反应方向移动 |
D.恒容下,充入一定量的 , , 的平衡转化率增大 的平衡转化率增大 |
您最近一年使用:0次
2022-07-04更新
|
9517次组卷
|
31卷引用:宁夏六盘山高级中学2022-2023学年高三上学期期末考试化学试题
宁夏六盘山高级中学2022-2023学年高三上学期期末考试化学试题天津市和平区2022-2023学年高二上学期期末质量调查化学试卷天津市和平区2022-2023学年高二上学期期末质量检测化学试题 河南省驻马店市2022-2023学年高二下学期期末考试化学试题(已下线)专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题1-14(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)四川省成都市树德中学2022-2023学年高二上学期10月月考化学试题四川省宜宾市叙州区第一中学校2022-2023学年高二上学期第一学月考试化学试题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题新疆石河子第一中学2022-2023学年高二10月月考化学试题(已下线)热点情景汇编-专题七 化学反应速率与平衡(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省长沙市第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)专题卷11 化学反应速率与化学平衡归因分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)第13练 化学反应速率与化学平衡的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)广东省广州市第六十五中学2022-2023学年高三上学期1月月考化学试题章末检测卷(二) 化学反应速率与化学平衡(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第二章 化学反应速率与化学平衡 第二节 化学平衡 第3课时 影响化学平衡的因素(已下线)考点3 化学平衡常数及转化率的计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期第一次月考化学试题(已下线)题型13 化学平衡常数的计算及应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
2 . 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
下列说法正确的是
 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
| 平衡v正(SO2)/mol/(L·s) | v1 | v2 | v3 |
| 平衡c(SO3)mol/L | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率/α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
| A.v1<v2,c2<2c1 | B.K1>K3,p2>2p3 |
| C.v1>v3,α1(SO2)>α3(SO2) | D.c2>2c3,α2(SO3)+α3(SO2)<1 |
您最近一年使用:0次
2021-08-14更新
|
1550次组卷
|
25卷引用:宁夏银川一中2020-2021学年高二上学期期末考试化学试题
宁夏银川一中2020-2021学年高二上学期期末考试化学试题浙江省诸暨市2019-2020学年高二上学期期末考试化学试题浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008天津市静海区第一中学2020届高三下学期第六周周末训练化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 高考帮人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关(已下线)【浙江新东方】高中化学20210304-010(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)四川省蓬安中学校2019-2020学年高二上学期开学考试化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)2.3.2 压强变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)吉林省长春市第二中学2021-2022学年高二上学期第一次月考化学试题江西省吉安一中2021-2022学年高二上学期第一次段考化学试题江西省九江市第一中学2021-2022学年高二上学期期中考试化学试题江西省宜春市八校2022-2023学年高二上学期12月联考化学试题河北省部分学校2023-2024学年高二上学期10月联考化学试题安徽省当涂第一中学2023-2024学年高二上学期10月月考化学试题
2023高三·全国·专题练习
名校
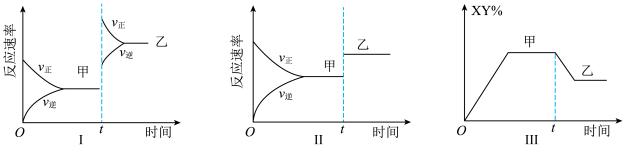
3 . 在密闭容器中,反应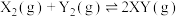
 ,达到如下图甲平衡,在仅改变某一条件后达到乙平衡,对改变的条件下列分析正确的是
,达到如下图甲平衡,在仅改变某一条件后达到乙平衡,对改变的条件下列分析正确的是
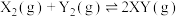
 ,达到如下图甲平衡,在仅改变某一条件后达到乙平衡,对改变的条件下列分析正确的是
,达到如下图甲平衡,在仅改变某一条件后达到乙平衡,对改变的条件下列分析正确的是
| A.图Ⅰ是增大反应物的浓度 | B.图Ⅱ一定是升高温度 |
| C.图Ⅲ是增大压强 | D.图Ⅲ是升高温度 |
您最近一年使用:0次
4 . 含铬废水会严重污染环境,一种烟气协同处理含铬废水(含 、
、 、泥沙等)的流程如图:
、泥沙等)的流程如图:

下列说法不正确的是
 、
、 、泥沙等)的流程如图:
、泥沙等)的流程如图:
下列说法不正确的是
| A.“沉降”的主要目的是除去泥沙等不溶物 |
B.溶液A通常选用硫酸“调pH”,目的是将 转化为 转化为 |
| C.“还原”过程涉及的氧化还原反应,氧化剂与还原剂的物质的量之比为2∶3 |
D.母液经处理可获得 |
您最近一年使用:0次
2022-03-22更新
|
322次组卷
|
4卷引用:宁夏平罗中学2022-2023学年高二下学期期末考试(重点班)化学试题
宁夏平罗中学2022-2023学年高二下学期期末考试(重点班)化学试题湖南省长郡中学2021-2022学年高三上学期第四次月考化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)重庆市北碚区2022-2023学年高三上学期10月月考化学试题
名校
解题方法
5 . 下列选项中的原因或结论与现象不对应的是
| 选项 | 现象 | 原因或结论 |
| A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
| B | 向5mL0.005mol•L-1FeCl3溶液中加入5mL0.010mol•L-1KSCN溶液,溶液呈红色,再滴加几滴1mol•L-1KCl溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
| C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) N2O4(g),△H<0,平衡向生成NO2方向移动 N2O4(g),△H<0,平衡向生成NO2方向移动 |
| D | 在密闭容器中有反应:A(?)+xB(g) 2C(g)。达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的三倍,测得c(A)为0.2mol/L 2C(g)。达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的三倍,测得c(A)为0.2mol/L | A气体,x>1 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-25更新
|
529次组卷
|
4卷引用:宁夏银川一中2020-2021学年高二上学期期末考试化学试题
10-11高二下·安徽合肥·期中
名校
6 . 某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g) 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是A.该反应的化学平衡常数表达式是 K=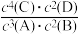 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加 B,平衡向右移动,B的平衡转化率增大 |
您最近一年使用:0次
2020-12-26更新
|
890次组卷
|
40卷引用:宁夏吴忠中学2020-2021学年高二上学期期末考试化学试题
宁夏吴忠中学2020-2021学年高二上学期期末考试化学试题(已下线)2011-2012学年吉林省长春市十一高中高一下学期期末考试化学试卷(已下线)2012-2013学年吉林省长春市十一高中高二上学期期末考试化学试卷宁夏石嘴山市第三中学2020届高三上学期期中考试化学试题辽宁省抚顺市六校协作体2019-2020学年高二上学期期末考试化学试题甘肃省庆阳市镇原县第二中学2020-2021学年高二上学期期末考试化学试题河南省宏力学校2020-2021学年高二上学期期末考试化学试题(已下线)2010-2011学年安徽省合肥一中高二下学期期中考试化学试卷(已下线)2012届山东省济宁市邹城二中高三第二次月考化学试卷(已下线)2012-2013学年湖北省武汉市重点中学高二上学期期中考试化学试卷2014-2015学年福建省清流一中高二上学期月考化学理试卷2014-2015浙江省严州中学高二下学期4月阶段性测试化学试卷2016届西藏山南第二高级中学高三下一模理综化学试卷(已下线)2.3.3 化学平衡常数高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第三课时(化学平衡常数)【全国百强校】四川省彭州中学2018-2019学年高二上学期10月月考化学试题河南省安阳市第三十六中学2018-2019学年高二上学期期中考试化学试题【全国百强校】湖南省长沙市长郡中学2018-2019学年高二下学期开学考试化学试题福建省莆田第一中学2018-2019学年高二下学期期初考试化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期期中考试化学(理)试题山东省兖州市2019-2020学年高二上学期期中考试化学试题吉林省长春九台师范高中2019-2020学年高二上学期期中考试化学试卷山西省朔州市怀仁县第一中学2018-2019学年高二上学期第二次月考化学试题吉林省桦甸市第八中学2020届高三上学期第三次月考化学试题(已下线)2.3.2 压强变化对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)2.3.2 压强变化对化学平衡的影响(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)山东省莱芜一中2021届高三第一次考试化学试题广东省深圳外国语学校2021届高三上学期11月月考化学试题山东省泰安市新泰第一中学(东校)2020-2021学年高二上学期期中考试化学试题(已下线)练习7 化学平衡(二)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)湖北省襄阳市南漳县第二中学2021-2022学年高二上学期10月考化学试题重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题吉林省抚松县第一中学2021-2022学年高二上学期第二次月考(平行班)化学试题(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)新疆石河子第二中学2021-2022学年高二上学期第二次月考化学试题四川省广安第二中学校2021-2022学年高二上学期第一次月考化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题四川省宜宾市叙州区第一中学校2022-2023学年高二上学期第一学月考试化学试题浙江省嘉兴八校联盟2021-2022学年高二上学期期中联考化学试题山东省临沂第一中学2020-2021学年高三上学期第一次检测化学试题
2023高三·全国·专题练习
7 . 在一定条件下反应A(g)+B(g)  C(g) ΔH<0达到平衡后,改变条件,正、逆反应速率随时间的变化如图,下列说法正确的是
C(g) ΔH<0达到平衡后,改变条件,正、逆反应速率随时间的变化如图,下列说法正确的是
 C(g) ΔH<0达到平衡后,改变条件,正、逆反应速率随时间的变化如图,下列说法正确的是
C(g) ΔH<0达到平衡后,改变条件,正、逆反应速率随时间的变化如图,下列说法正确的是
| A.图①改变的条件可能是增大A的浓度,达到新平衡后A的转化率减小 |
| B.图②改变的条件是加压,达到新平衡后A的转化率不变 |
| C.图③改变的条件可能是减小A的浓度,达到新平衡后A的转化率减小 |
| D.图④改变的条件是升温,达到新平衡后A的转化率增大 |
您最近一年使用:0次
11-12高二下·浙江温州·期中
名校
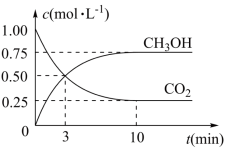
8 . 已知:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.升高温度能使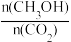 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075mol·L-1·min-1 |
您最近一年使用:0次
2020-04-14更新
|
416次组卷
|
20卷引用:宁夏育才中学2019-2020学年高二上学期期末考试化学试题
宁夏育才中学2019-2020学年高二上学期期末考试化学试题福建省永春县第一中学2018-2019学年高二上学期期末考试(理)化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题甘肃省甘南藏族自治州合作第一中学2021-2022学年高二上学期期末考试化学试题(已下线)2011-2012学年浙江瑞安中学高二下学期期中考试化学试卷(已下线)2012-2013学年辽宁瓦房店高级中学高二上学期期中考试化学试卷(已下线)2014届甘肃省武威市第六中学高三上学期第五次月考化学试卷(已下线)2013届北京四中高三上学期开学检测化学试卷2015-2016学年重庆市三峡名校联盟高二上学期12月联考化学试卷【全国百强校】四川省彭州中学2018-2019学年高二上学期10月月考化学试题四川省棠湖中学2019-2020学年高二上学期第一次月考化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)第04练 化学平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)甘肃省天水市第一中学2021-2022学年高二下学期开学检测化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题四川省内江市资中县第二中学2023-2024学年高二上学期12月月考化学试题
9 . 将CH4和CO2两种引发温室效应的气体转化为合成气(H2和CO),可以实现能量综合利用,对环境保护具有十分重要的意义。
(1)甲烷二氧化碳干式重整涉及以下反应
a.CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1平衡常数K 1
2CO(g)+2H2(g) ∆H1平衡常数K 1
b.CO(g)+H2O(g) CO2(g)+H2(g) ∆H2平衡常数K 2
CO2(g)+H2(g) ∆H2平衡常数K 2
c.CH4(g)+2H2O(g) CO2(g)+ 4H2(g) ∆H3平衡常数K 3
CO2(g)+ 4H2(g) ∆H3平衡常数K 3
①∆H3=_______ (用∆H1、 ∆H2表示 )
②K3=_______ (用K1、 K2表示 )
③∆fHΘm为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其∆fHΘm为零。根据下表所示数据,计算反应a的反应热∆H1=_______ ,该反应在_______ (填“高温”或“低温”)下能自发进行。
(2)甲烷的水蒸气重整涉及以下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
在一密闭容器中,通入1molCH4和3molH2O(g)发生甲烷的水蒸气重整反应。
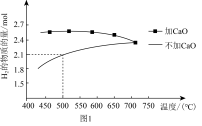
①压强为P0 kPa时,分别在加CaO和不加CaO时,平衡体系中H2的物质的量随温度变化如图1所示。温度低于700℃时,加入CaO可明显提高混合气中H2的物质的量,原因是_______ 。
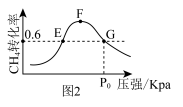
②500℃时,反应相同时间后测得CH4的转化率ɑ随压强的变化如图2所示。则图2中E点和G点CH4的浓度大小关系为c(G)_______ c(E)(填>”“<”或“=”),此温度下反应Ⅱ的分压平衡常数Kp(用分压代替浓度,分压等于总压×物质的量分数)为_______ 。
③甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法。其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:_______ 。

(1)甲烷二氧化碳干式重整涉及以下反应
a.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1平衡常数K 1
2CO(g)+2H2(g) ∆H1平衡常数K 1b.CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2平衡常数K 2
CO2(g)+H2(g) ∆H2平衡常数K 2c.CH4(g)+2H2O(g)
 CO2(g)+ 4H2(g) ∆H3平衡常数K 3
CO2(g)+ 4H2(g) ∆H3平衡常数K 3①∆H3=
②K3=
③∆fHΘm为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其∆fHΘm为零。根据下表所示数据,计算反应a的反应热∆H1=
| 物质 | CH4 | CO2 | CO |
| ∆fHΘm | -74.8 | -393.5 | -110.5 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)在一密闭容器中,通入1molCH4和3molH2O(g)发生甲烷的水蒸气重整反应。
①压强为P0 kPa时,分别在加CaO和不加CaO时,平衡体系中H2的物质的量随温度变化如图1所示。温度低于700℃时,加入CaO可明显提高混合气中H2的物质的量,原因是

②500℃时,反应相同时间后测得CH4的转化率ɑ随压强的变化如图2所示。则图2中E点和G点CH4的浓度大小关系为c(G)

③甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法。其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:

您最近一年使用:0次
名校
解题方法
10 . 下列叙述中正确的是
| A.pH=11的NaOH和Na2S溶液中水的电离程度前者大于后者 |
| B.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉 |
| C.25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO3)2溶液中的大 |
| D.向FeCl3+3KSCN⇌Fe(SCN)3+3KCl平衡体系中加入少量KCl固体,溶液血红色变浅 |
您最近一年使用:0次
2020-12-26更新
|
167次组卷
|
3卷引用:宁夏青铜峡市高级中学2020-2021学年高二上学期期末考试化学试题



