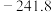名校
1 . 某研究小组试探究1,6-己二硫醇(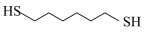 ,用HDT表示)与铜的反应历程。
,用HDT表示)与铜的反应历程。
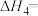
化学键 | C-H | C-C | H-H |
键能/ | 413 | 347 | 436 |
(2)温度一定时,在隔绝空气的条件下使HDT(g)以恒定的流速通过如甲图所示的反应器,仅发生反应Ⅰ、Ⅱ、Ⅲ,在反应器出口处实时检测各物质的相对含量如图乙所示。
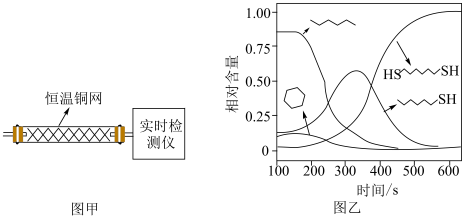
②推测
 在该实验条件下与Cu反应生成烃类产物的名称为
在该实验条件下与Cu反应生成烃类产物的名称为(3)向恒温刚性容器M中充入己烷(g)和HDT(g),初始总压为2.5Pa,己烷的体积分数为80%。容器M中只发生反应Ⅳ,达平衡时,己烷的转化率为50%,则反应Ⅳ的

(
 )
)
您最近一年使用:0次
2024-05-30更新
|
76次组卷
|
2卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
2 . 研究 的综合利用具有重要的意义。
的综合利用具有重要的意义。
Ⅰ. 催化重整制氢气
催化重整制氢气
一种 与
与 催化重整制取
催化重整制取 的过程如图1所示。在反应管中加入
的过程如图1所示。在反应管中加入 和催化剂,先通入
和催化剂,先通入 ,待步骤Ⅰ完成后,再将
,待步骤Ⅰ完成后,再将 以一定流速通入,并控制温度为
以一定流速通入,并控制温度为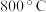 ,进行步骤Ⅱ。
,进行步骤Ⅱ。___________ 。
(2)步骤Ⅱ中还存在少量副反应: ,测得出口处
,测得出口处 和
和 的流量随时间变化如图2所示。
的流量随时间变化如图2所示。 时出口处气体流量
时出口处气体流量 略高于
略高于 的原因是
的原因是___________ 。
②反应进行 后,反应管中仍残留较多
后,反应管中仍残留较多 ,但
,但 流量迅速降低,
流量迅速降低, 流量升高,可能的原因是
流量升高,可能的原因是___________ 。
Ⅱ. 用于烟气脱硝
用于烟气脱硝
(3) 烟气脱硝相关反应如下:
烟气脱硝相关反应如下:
反应Ⅰ

反应Ⅱ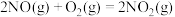

反应Ⅲ
①反应Ⅲ的
___________  。
。
②反应Ⅰ和反应II的平衡常数分别为 、
、 ,则相同温度下反应Ⅲ的
,则相同温度下反应Ⅲ的
___________ (用 、
、 表示)。
表示)。
(4)模拟烟气脱硝:一定条件下,将 、
、 和
和 按
按 匀速通过催化脱硝反应器,测得
匀速通过催化脱硝反应器,测得 去除率和
去除率和 转化率随反应温度的变化如图3所示。
转化率随反应温度的变化如图3所示。 时,
时, 的去除率随温度升高而升高,可能原因是
的去除率随温度升高而升高,可能原因是___________ 。
②当温度高于 时,
时, 的去除率随温度升高而降低,可能原因是
的去除率随温度升高而降低,可能原因是___________ 。
 的综合利用具有重要的意义。
的综合利用具有重要的意义。Ⅰ.
 催化重整制氢气
催化重整制氢气一种
 与
与 催化重整制取
催化重整制取 的过程如图1所示。在反应管中加入
的过程如图1所示。在反应管中加入 和催化剂,先通入
和催化剂,先通入 ,待步骤Ⅰ完成后,再将
,待步骤Ⅰ完成后,再将 以一定流速通入,并控制温度为
以一定流速通入,并控制温度为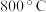 ,进行步骤Ⅱ。
,进行步骤Ⅱ。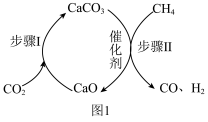
(2)步骤Ⅱ中还存在少量副反应:
 ,测得出口处
,测得出口处 和
和 的流量随时间变化如图2所示。
的流量随时间变化如图2所示。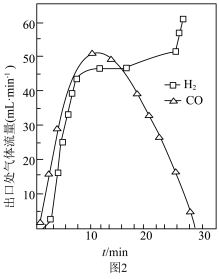
 时出口处气体流量
时出口处气体流量 略高于
略高于 的原因是
的原因是②反应进行
 后,反应管中仍残留较多
后,反应管中仍残留较多 ,但
,但 流量迅速降低,
流量迅速降低, 流量升高,可能的原因是
流量升高,可能的原因是Ⅱ.
 用于烟气脱硝
用于烟气脱硝(3)
 烟气脱硝相关反应如下:
烟气脱硝相关反应如下:反应Ⅰ


反应Ⅱ
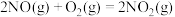

反应Ⅲ

①反应Ⅲ的

 。
。②反应Ⅰ和反应II的平衡常数分别为
 、
、 ,则相同温度下反应Ⅲ的
,则相同温度下反应Ⅲ的
 、
、 表示)。
表示)。(4)模拟烟气脱硝:一定条件下,将
 、
、 和
和 按
按 匀速通过催化脱硝反应器,测得
匀速通过催化脱硝反应器,测得 去除率和
去除率和 转化率随反应温度的变化如图3所示。
转化率随反应温度的变化如图3所示。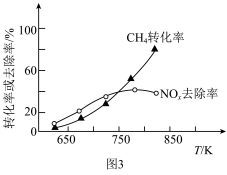
 时,
时, 的去除率随温度升高而升高,可能原因是
的去除率随温度升高而升高,可能原因是②当温度高于
 时,
时, 的去除率随温度升高而降低,可能原因是
的去除率随温度升高而降低,可能原因是
您最近一年使用:0次
名校
3 . CO2的资源化利用具有重要的意义。合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现:
2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
NH2COONH4(s)=CO(NH2)2(l)+H2O(g) △H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素和水蒸气的热化学方程式为_______ ;该反应自发进行的条件是_______ (填“低温”、“高温”或“任意条件“”)。
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是_______ 。
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。_______ 。
②控制电压为0.8V,电解时转移电子的物质的量为_______ mol。
CH4与CO2重整主要发生下列反应:
反应1:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
反应2:H2(g)+CO2(g) H2O(g)+CO(g) △H=+41kJ/mol
H2O(g)+CO(g) △H=+41kJ/mol
恒温,将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2。
(4)下列说法正确的是_______。
(5)CH4和CO2的平衡转化率随温度变化关系如图3所示。_______ (写出计算式即可)。
(6)室温下,H2CO3溶液中各含碳微粒的物质的量分数与pH的关系如图4所示。则H2CO3的Ka1=_______ 。
2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
NH2COONH4(s)=CO(NH2)2(l)+H2O(g) △H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素和水蒸气的热化学方程式为
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。
②控制电压为0.8V,电解时转移电子的物质的量为
CH4与CO2重整主要发生下列反应:
反应1:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol反应2:H2(g)+CO2(g)
 H2O(g)+CO(g) △H=+41kJ/mol
H2O(g)+CO(g) △H=+41kJ/mol恒温,将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2。
(4)下列说法正确的是_______。
| A.n(CO)保持不变说明容器已经达到平衡状态 |
| B.容器中气体密度不变能说明反应已经达到平衡状态 |
| C.恒容向容器中充入He,CH4平衡转化率变小 |
| D.如果将容器体积缩小为1L,则反应1的化学反应速率变快,反应2不变 |
(5)CH4和CO2的平衡转化率随温度变化关系如图3所示。

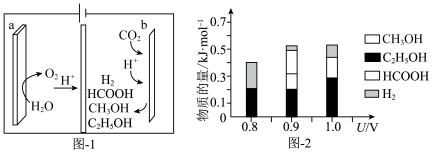
(6)室温下,H2CO3溶液中各含碳微粒的物质的量分数与pH的关系如图4所示。则H2CO3的Ka1=
您最近一年使用:0次
4 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,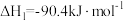 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,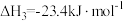 ;
;
Ⅳ. ,
,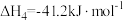 ;
;
请回答下列问题:
(1)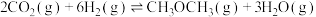

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和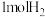 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化;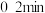 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数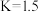 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,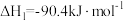 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,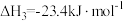 ;
;Ⅳ.
 ,
,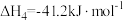 ;
;请回答下列问题:
(1)
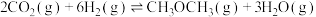

(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和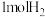 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: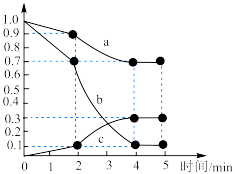
 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
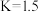 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  |  |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
5 . 乙烯合成的发展体现了化学科学与技术的不断进步。
(1)用烃类热裂解法制乙烯是乙烯工业化生产的开端。
①乙烷高温裂解制备乙烯(反应Ⅰ)的化学方程式是______ 。
②在裂解过程中伴随反应Ⅱ: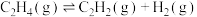 ,在高温下缩短
,在高温下缩短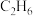 在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ
在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ______ 反应Ⅱ。(填“>”“<”或“=”)
(2)乙炔选择性加氢制乙烯是石油化工领域重要的发展阶段。
以钯(Pd)为催化剂可有效提高乙烯产率,在催化剂表面的反应机理如下图所示(吸附在催化剂表面的粒子用*标注)。______ 。
a.NP-Pd催化反应过程中步骤Ⅰ为放热反应
b.ISA-Pd催化反应过程中步骤Ⅱ为决速步骤
c.两种催化剂均能降低总反应的反应热
②吸附态乙烯( )脱离催化剂表面,可得到
)脱离催化剂表面,可得到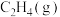 ,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制
,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制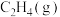 选择性较好的催化剂是
选择性较好的催化剂是______ 。
(3)以 为原料用不同的方法制乙烯有助于实现碳中和。
为原料用不同的方法制乙烯有助于实现碳中和。
I.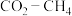 干气重整制乙烯。下图是2种投料比[
干气重整制乙烯。下图是2种投料比[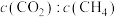 ,分别为1:1、2:1]下,反应温度对
,分别为1:1、2:1]下,反应温度对 平衡转化率影响的曲线。
平衡转化率影响的曲线。______ 。
②当曲线a、b对应的投料比达到相同的 平衡转化率时,对应的反应温度与投料比的关系是
平衡转化率时,对应的反应温度与投料比的关系是______ 。
Ⅱ.双金属串联催化剂电催化 制乙烯,装置示意图如图所示。
制乙烯,装置示意图如图所示。
已知:法拉第效率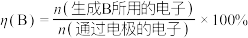
______ 。
④该环境下,测得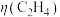 可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是______ mol。
(1)用烃类热裂解法制乙烯是乙烯工业化生产的开端。
①乙烷高温裂解制备乙烯(反应Ⅰ)的化学方程式是
②在裂解过程中伴随反应Ⅱ:
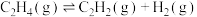 ,在高温下缩短
,在高温下缩短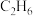 在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ
在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ(2)乙炔选择性加氢制乙烯是石油化工领域重要的发展阶段。
以钯(Pd)为催化剂可有效提高乙烯产率,在催化剂表面的反应机理如下图所示(吸附在催化剂表面的粒子用*标注)。
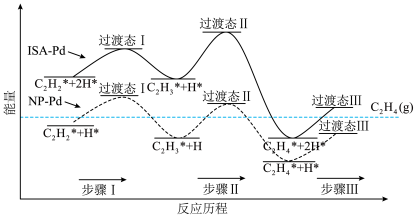
a.NP-Pd催化反应过程中步骤Ⅰ为放热反应
b.ISA-Pd催化反应过程中步骤Ⅱ为决速步骤
c.两种催化剂均能降低总反应的反应热
②吸附态乙烯(
 )脱离催化剂表面,可得到
)脱离催化剂表面,可得到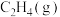 ,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制
,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制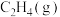 选择性较好的催化剂是
选择性较好的催化剂是(3)以
 为原料用不同的方法制乙烯有助于实现碳中和。
为原料用不同的方法制乙烯有助于实现碳中和。I.
 干气重整制乙烯。下图是2种投料比[
干气重整制乙烯。下图是2种投料比[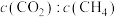 ,分别为1:1、2:1]下,反应温度对
,分别为1:1、2:1]下,反应温度对 平衡转化率影响的曲线。
平衡转化率影响的曲线。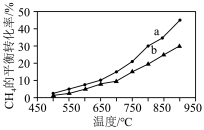
②当曲线a、b对应的投料比达到相同的
 平衡转化率时,对应的反应温度与投料比的关系是
平衡转化率时,对应的反应温度与投料比的关系是Ⅱ.双金属串联催化剂电催化
 制乙烯,装置示意图如图所示。
制乙烯,装置示意图如图所示。已知:法拉第效率
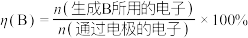
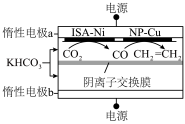
④该环境下,测得
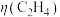 可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
您最近一年使用:0次
解题方法
6 . 乙烯是一种基本化工原料,广泛应用于高新材料合成、医药合成等。工业上,乙烯的制备途径有多种。回答下列问题:
(1)二氧化碳催化加氢制备乙烯
反应原理: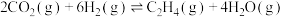
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
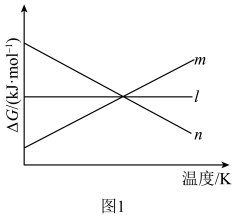
①△H=______ ;△G随着温度变化的三种趋势如图1所示,能用来表示该反应的曲线是________ (填字母标号)。 和3mol
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是______ (填字母标号); K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
___________ 。
主反应:
副反应:
某温度下,向0.5L恒容密闭容器中充入1mol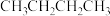 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=_______ 。
②平衡时乙烯的选择性η(乙烯)=_________ 。
[已知选择性 ]
]
③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图_________ 。
(1)二氧化碳催化加氢制备乙烯
反应原理:
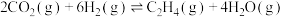
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。物质 |
|
|
|
|
|
| 0 | 52.3 |
|
 和3mol
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是 K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
主反应:

副反应:

某温度下,向0.5L恒容密闭容器中充入1mol
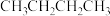 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=
②平衡时乙烯的选择性η(乙烯)=
[已知选择性
 ]
]③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图

您最近一年使用:0次
7 . 应用(CO2催化加氢规模化生产甲醇是综合利用(CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.

II.

(1)反应过程中各物质的相对能量变化情况如图所示: =
=___________ ,反应是快反应___________ (填“Ⅰ”或“Ⅱ”)
(2)若
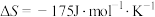 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。
(3)已知反应 ,在540K下,按初始投料
,在540K下,按初始投料 、
、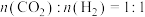 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:___________ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数Kp=___________ (MPa)-2(用平衡分压计算)。
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为___________ 。
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式___________ 。

 ,需通过以下两步实现:
,需通过以下两步实现:I.


II.


(1)反应过程中各物质的相对能量变化情况如图所示:

 =
=(2)若

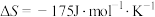 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。| A.0℃ | B.70℃ | C.150℃ | D.280°C |
(3)已知反应
 ,在540K下,按初始投料
,在540K下,按初始投料 、
、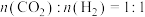 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:
②N点在b曲线上,540K时的压强平衡常数Kp=
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式
您最近一年使用:0次
8 . 大气中 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: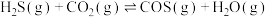 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。
(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
(2)在573K下,向2L恒容密闭容器中通入2mol 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。
①上述条件下 的平衡转化率
的平衡转化率
___________ %。
②在上述平衡体系中再加2mol 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向___________ 。
(3)在不同温度下,向密闭容器甲、乙中分别充入2mol 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。___________ 。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是___________ 。
 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: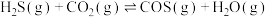 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
A.容器内 不再生成 不再生成 | B.容器内压强不再发生变化 |
| C.容器内气体密度不再发生变化 | D. |
(2)在573K下,向2L恒容密闭容器中通入2mol
 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。①上述条件下
 的平衡转化率
的平衡转化率
②在上述平衡体系中再加2mol
 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向(3)在不同温度下,向密闭容器甲、乙中分别充入2mol
 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是
您最近一年使用:0次
名校
9 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: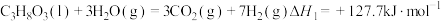
反应Ⅱ: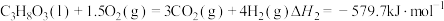
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠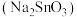 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积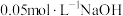 溶液和
溶液和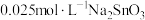 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为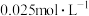 时,氢气产率接近
时,氢气产率接近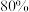 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用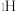 、
、 和
和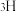 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
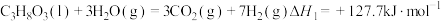
反应Ⅱ:
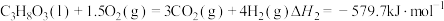
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠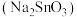 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积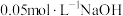 溶液和
溶液和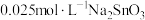 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是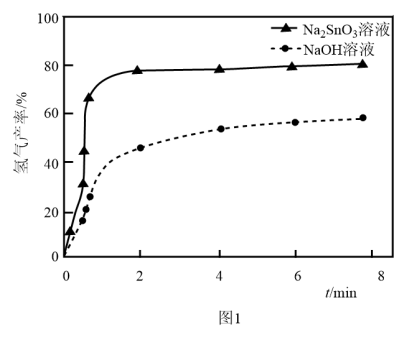
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为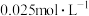 时,氢气产率接近
时,氢气产率接近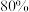 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是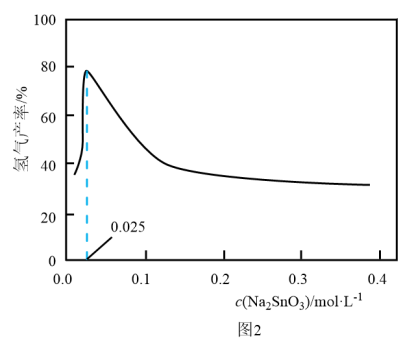
 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用 、
、 和
和 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为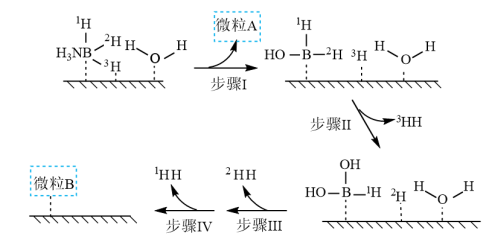
您最近一年使用:0次
10 . 氮及其化合物在工农业生产、生活中有着重要作用。
1.下列元素中电负性最大的是____。
2.NH3和PH3都具有四面体结构,NH3比PH3的分解温度高的原因是____。
3.配合物Ni(CO)4也具有四面体结构,常温下Ni(CO)4为液态,易溶于CCl4、苯等有机溶剂。写出基态Ni的电子排布式____ ;Ni(CO)4属于____ 晶体。
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol
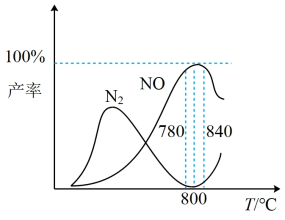
有关物质产率与温度的关系如图。_________ 。
6.工业上采用物料比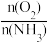 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:______________ 。
7.下列说法正确的是______________ 。
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
表中数据计算0~4min内υ(NO2)=_________ 。
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点___ (填“是”或“不是”)反应达平衡的点。d点之后,转化率随温度升高而降低的原因是___ 。
1.下列元素中电负性最大的是____。
| A.N | B.P | C.Si | D.C |
| A.NH3分子间有氢键 | B.NH3分子极性强 |
| C.N-H键键能大于P-H键 | D.氨极易液化 |
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
| A.3p | B.3d | C.4s | D.4p |
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol副反应:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol有关物质产率与温度的关系如图。
6.工业上采用物料比
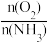 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:7.下列说法正确的是
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点
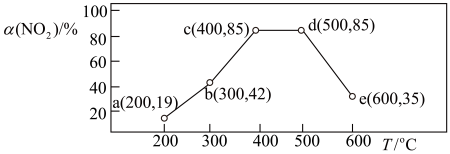
您最近一年使用:0次

 (g)
(g)