真题
名校
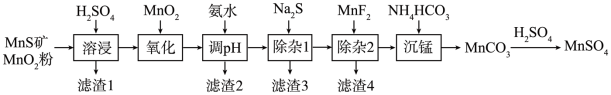
1 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19580次组卷
|
29卷引用:陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题
陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学
名校
2 . 为减少大气污染,科学家采取多种措施处理工业废气中排放的氮氧化物(NOx)、SO2等。回答下列问题:
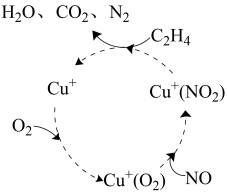
(1)某脱硝反应机理如图所示,Cu+的作用为____ ,C2H4参与的反应方程式为____ 。
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
①若有3molNO参与反应,则被NO氧化的NH3的物质的量为____ 。
②催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是____ 。
③350℃时NO的百分含量与氨氮比的关系如图所示,若只改变氨气的投放量,当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是____ (用化学方程式表示)。

(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点,ClO2在酸性条件下稳定,是性能优良的脱硫脱硝试剂。
①ClO 也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为
也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为____ 。
②某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。
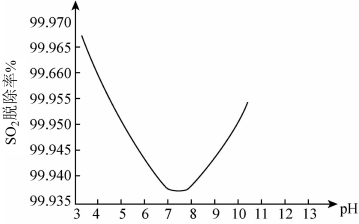
当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是:____ ;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是____ 。
(1)某脱硝反应机理如图所示,Cu+的作用为

(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
4N2(g)+6H2O(g) △H=-1627kJ·mol-1。①若有3molNO参与反应,则被NO氧化的NH3的物质的量为
②催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是
③350℃时NO的百分含量与氨氮比的关系如图所示,若只改变氨气的投放量,当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点,ClO2在酸性条件下稳定,是性能优良的脱硫脱硝试剂。
①ClO
 也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为
也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为②某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。

当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是:
您最近一年使用:0次
2022-08-29更新
|
240次组卷
|
4卷引用:陕西省咸阳高新一中2023届高三上学期第一次质量检测化学试题
名校
解题方法
3 . 某课外活动小组为了探究外界条件对化学平衡的影响,做了如下实验:
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比: (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入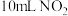 气体,将针筒前端封闭。
气体,将针筒前端封闭。

①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是___________ ;
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是___________ 。
(2)探究浓度对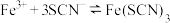 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
①甲同学根据中学所掌握知识预测红色应该___________ (填“变深”“变浅”或“不变”)。
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中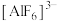 、银氨溶液中
、银氨溶液中 、
、 、
、 等。因此预测红色应该
等。因此预测红色应该___________ (填“变深”“变浅”或“不变”),理由:___________ 。
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比:
 (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入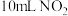 气体,将针筒前端封闭。
气体,将针筒前端封闭。
①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是
(2)探究浓度对
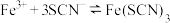 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。①甲同学根据中学所掌握知识预测红色应该
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中
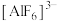 、银氨溶液中
、银氨溶液中 、
、 、
、 等。因此预测红色应该
等。因此预测红色应该
您最近一年使用:0次
2023-10-12更新
|
120次组卷
|
3卷引用:陕西省西安市鄠邑区2023-2024学年高二上学期期中质量检测化学试题
名校
4 . 工业上采用高浓度含砷废水制取 ,工艺流程如下:
,工艺流程如下:

已知含砷废水中砷元素以+3价的形式存在。不同pH时,三价砷的物种分布如下图所示:

(1) 第一步电离方程式
第一步电离方程式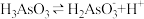 的电离常数为
的电离常数为 ,则
,则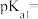
___________ (已知 )
)
(2)“调pH”时,控制溶液的pH=6,“沉砷”时会生成 沉淀。写出“沉砷”时反应的离子方程式:
沉淀。写出“沉砷”时反应的离子方程式:___________
(3)“沉砷”时会发生副反应: ,从而降低砷元素的沉淀率。为减少副反应的发生,采取的方法是加入
,从而降低砷元素的沉淀率。为减少副反应的发生,采取的方法是加入 的同时加入少量
的同时加入少量 ,生成的
,生成的 沉淀中会混有FeS。加入少量
沉淀中会混有FeS。加入少量 能抑制副反应的原因是(用平衡移动原理解释)
能抑制副反应的原因是(用平衡移动原理解释)___________
(4)“焙烧”含少量FeS的 可以得到
可以得到 和
和 的混合物。
的混合物。 是一种酸性氧化物,选择合适的溶液X,将砷元素转化为
是一种酸性氧化物,选择合适的溶液X,将砷元素转化为 从混合物中浸出。写出“浸出”反应的离子方程式:
从混合物中浸出。写出“浸出”反应的离子方程式:___
(5)保持溶液X的浓度不变,为了提高焙烧后固体中砷元素的浸出速率,可以采取的方法有(填两条):
①________
②________
 ,工艺流程如下:
,工艺流程如下:
已知含砷废水中砷元素以+3价的形式存在。不同pH时,三价砷的物种分布如下图所示:

(1)
 第一步电离方程式
第一步电离方程式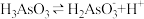 的电离常数为
的电离常数为 ,则
,则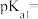
 )
)(2)“调pH”时,控制溶液的pH=6,“沉砷”时会生成
 沉淀。写出“沉砷”时反应的离子方程式:
沉淀。写出“沉砷”时反应的离子方程式:(3)“沉砷”时会发生副反应:
 ,从而降低砷元素的沉淀率。为减少副反应的发生,采取的方法是加入
,从而降低砷元素的沉淀率。为减少副反应的发生,采取的方法是加入 的同时加入少量
的同时加入少量 ,生成的
,生成的 沉淀中会混有FeS。加入少量
沉淀中会混有FeS。加入少量 能抑制副反应的原因是(用平衡移动原理解释)
能抑制副反应的原因是(用平衡移动原理解释)(4)“焙烧”含少量FeS的
 可以得到
可以得到 和
和 的混合物。
的混合物。 是一种酸性氧化物,选择合适的溶液X,将砷元素转化为
是一种酸性氧化物,选择合适的溶液X,将砷元素转化为 从混合物中浸出。写出“浸出”反应的离子方程式:
从混合物中浸出。写出“浸出”反应的离子方程式:(5)保持溶液X的浓度不变,为了提高焙烧后固体中砷元素的浸出速率,可以采取的方法有(填两条):
①
②
您最近一年使用:0次
2021-11-15更新
|
301次组卷
|
2卷引用:陕西省西安市西北工业大学附属中学2022-2023学年高三上学期期末考试化学试题
名校
解题方法
5 . 二甲酸( )是一种性能优良的汽车燃料,工业上可利用CO和
)是一种性能优良的汽车燃料,工业上可利用CO和 来合成二甲醚,发生的反应为:
来合成二甲醚,发生的反应为:
Ⅰ.
Ⅱ.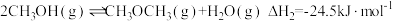 回答下列问题:
回答下列问题:
(1)由CO和 直接合成
直接合成 的热化学反应方程式为
的热化学反应方程式为______ 。
(2)T℃下,向体积为2L的恒容密闭容器中充入2mol 发生反应Ⅱ。20min时反应达平衡,测得体系中
发生反应Ⅱ。20min时反应达平衡,测得体系中 的体积分数为25%。
的体积分数为25%。
①0~20min内,用 表示的平均反应速率
表示的平均反应速率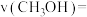
______  ;若其他条件不变,向该平衡体系中再充入1mol
;若其他条件不变,向该平衡体系中再充入1mol 和1mol
和1mol ,则平衡向
,则平衡向______ (填“正”或“逆”)反应方向移动。
②实验测得该反应: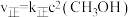 ,
, ,
, 、
、 为速率常数。若改变温度为T′℃,测得平衡时
为速率常数。若改变温度为T′℃,测得平衡时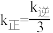 ,则T′
,则T′______ T(填“大于”或“小于”)。
(3)不同压强和温度下,将2.0molCO(g)和4.0mol 充入容积为2L的恒温密闭容器中,平衡时体系中二甲醚的物质的量分数变化情况如图所示,则
充入容积为2L的恒温密闭容器中,平衡时体系中二甲醚的物质的量分数变化情况如图所示,则 的平衡转化率最大时应选择的条件是______(填标号)。
的平衡转化率最大时应选择的条件是______(填标号)。
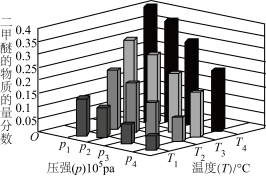
 )是一种性能优良的汽车燃料,工业上可利用CO和
)是一种性能优良的汽车燃料,工业上可利用CO和 来合成二甲醚,发生的反应为:
来合成二甲醚,发生的反应为:Ⅰ.

Ⅱ.
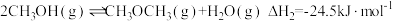 回答下列问题:
回答下列问题:(1)由CO和
 直接合成
直接合成 的热化学反应方程式为
的热化学反应方程式为(2)T℃下,向体积为2L的恒容密闭容器中充入2mol
 发生反应Ⅱ。20min时反应达平衡,测得体系中
发生反应Ⅱ。20min时反应达平衡,测得体系中 的体积分数为25%。
的体积分数为25%。①0~20min内,用
 表示的平均反应速率
表示的平均反应速率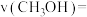
 ;若其他条件不变,向该平衡体系中再充入1mol
;若其他条件不变,向该平衡体系中再充入1mol 和1mol
和1mol ,则平衡向
,则平衡向②实验测得该反应:
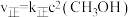 ,
, ,
, 、
、 为速率常数。若改变温度为T′℃,测得平衡时
为速率常数。若改变温度为T′℃,测得平衡时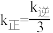 ,则T′
,则T′(3)不同压强和温度下,将2.0molCO(g)和4.0mol
 充入容积为2L的恒温密闭容器中,平衡时体系中二甲醚的物质的量分数变化情况如图所示,则
充入容积为2L的恒温密闭容器中,平衡时体系中二甲醚的物质的量分数变化情况如图所示,则 的平衡转化率最大时应选择的条件是______(填标号)。
的平衡转化率最大时应选择的条件是______(填标号)。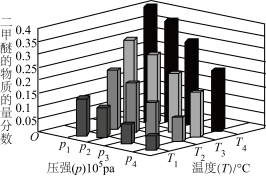
A. 、 、 | B.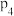 、 、 | C. 、 、 | D. 、 、 |
您最近一年使用:0次
6 . 抗击“疫情”期间,过氧乙酸是常用的消毒剂之一,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%H2O2溶液,最终得到质量分数约68%的H2O2溶液。
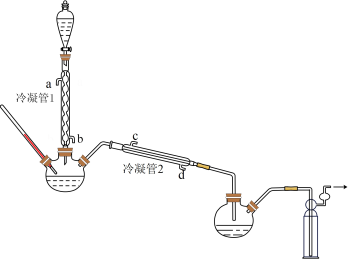
①冷凝管1、冷凝管2中进水接口依次为、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知CH3COOH+H2O2= +H2O)
+H2O)
①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、胶头滴管、玻璃棒和量筒外,还需要______ 。
②设计步骤b的目的是___________ 。
③过氧乙酸的质量分数为___________ %。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%H2O2溶液,最终得到质量分数约68%的H2O2溶液。

①冷凝管1、冷凝管2中进水接口依次为、
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知CH3COOH+H2O2=
 +H2O)
+H2O)①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是
②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、胶头滴管、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
名校
7 . 硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
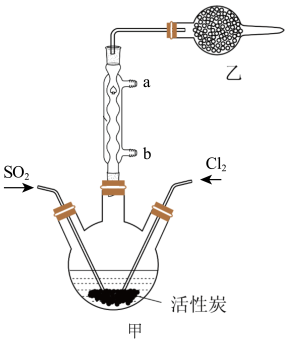
I.SO2Cl2的制备
(1)水应从___ (选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___ (填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___ 。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___ 。
(5)反应结束后,分离甲中混合物的最佳实验操作是___ 。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___ 。
(7)产品中SO2Cl2的质量分数为___ %,若步骤③不加入硝基苯则所测SO2Cl2含量将___ (填“偏高”、“偏低”或“无影响”)。
 SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
I.SO2Cl2的制备
(1)水应从
(2)制取SO2的最佳组合是
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是
(4)制备过程中需要将装置甲置于冰水浴中,原因是
(5)反应结束后,分离甲中混合物的最佳实验操作是
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为
(7)产品中SO2Cl2的质量分数为
您最近一年使用:0次
2019-12-10更新
|
482次组卷
|
3卷引用:陕西省西安市长安区第一中学2020-2021学年高三第七次质量检测理综化学试题
名校
解题方法
8 . 三氧化二钴(Co2O3)常作氧化剂、催化剂,一般用于玻璃、陶瓷制品的上彩。以某含钴矿石(主要成分为CoCO3,含有少量FeO、MgO和NiO)为原料制备Co2O3的流程如图所示:

相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)含钴矿石预先粉碎的目的是____ 。
(2)写出“溶浸”后某离子被氧化的离子方程式____ 。
(3)滤渣1的主要成分为____ (写化学式),该步骤中应调节pH的范围为:____ 。
(4)沉淀除杂步骤中加入过量的NaF溶液使Mg2+(浓度为1.0×10-3mol·L-1)生成沉淀除去,当溶液中c(F-)=2.0×10-3mol·L-1时,溶液中c(Mg2+)=____ mol·L-1[Ksp(MgF2)=9×10-11]。
(5)加入萃取剂萃取分离Ni2+和Co2+,原理为Ni2+(水相)+2RH(有机相) R(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+和Co2+的萃取率影响如图所示,V0/VA的最佳取值为
R(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+和Co2+的萃取率影响如图所示,V0/VA的最佳取值为____ 。在____ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相中Ni2+生而循环利用。

(6)沉钴过程中生成CoCO3,则该过程发生反应的离子方程式为____ 。

相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Fe3+ | Fe2+ | Mg2+ | Co2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 9.3 | 6.8 | 6.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 10.8 | 9.0 | 9.2 |
(1)含钴矿石预先粉碎的目的是
(2)写出“溶浸”后某离子被氧化的离子方程式
(3)滤渣1的主要成分为
(4)沉淀除杂步骤中加入过量的NaF溶液使Mg2+(浓度为1.0×10-3mol·L-1)生成沉淀除去,当溶液中c(F-)=2.0×10-3mol·L-1时,溶液中c(Mg2+)=
(5)加入萃取剂萃取分离Ni2+和Co2+,原理为Ni2+(水相)+2RH(有机相)
 R(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+和Co2+的萃取率影响如图所示,V0/VA的最佳取值为
R(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+和Co2+的萃取率影响如图所示,V0/VA的最佳取值为
(6)沉钴过程中生成CoCO3,则该过程发生反应的离子方程式为
您最近一年使用:0次
9 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: ;
;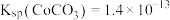 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)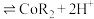 ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: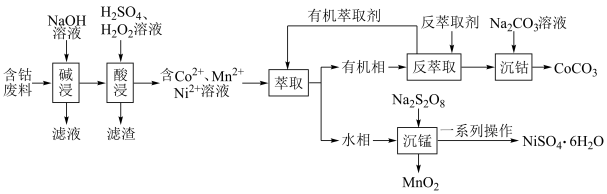
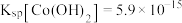 ;
;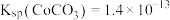 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)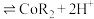 ,若萃取剂的量一定时,
,若萃取剂的量一定时, ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为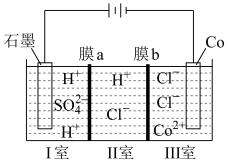
您最近一年使用:0次
10 . 反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g);△H>0,在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g);△H>0,在一容积可变的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率_______ (填“增大”“不变”或“减小”,下同),平衡_______ 移动(填“不”“向正反应方向”或“向逆反应方向”,下同)。
(2)将容器的体积缩小一半,其正反应速率_______ ,平衡_______ 移动。
(3)升高温度,其正反应速率_______ ,平衡_______ 移动。
(4)保持体积不变,充入水蒸气,其正反应速率_______ ,平衡_______ 移动。
(5)若要加快该反应的反应速率,可采取的措施有_______ 、_______ 。
 Fe3O4(s)+4H2(g);△H>0,在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g);△H>0,在一容积可变的密闭容器中进行,试回答:(1)增加Fe的量,其正反应速率
(2)将容器的体积缩小一半,其正反应速率
(3)升高温度,其正反应速率
(4)保持体积不变,充入水蒸气,其正反应速率
(5)若要加快该反应的反应速率,可采取的措施有
您最近一年使用:0次



