名校
1 . 某化学小组研究草酸(H2C2O4)及其盐的性质。
(1)已知: ,
,
①将等物质的量浓度、等体积的H2C2O4溶液与KOH溶液混合,反应的离子方程式是_______ 。
②向①中继续加入KOH溶液至恰好完全反应,得到K2C2O4溶液。下列关系正确的是_______ (填字母)。
a.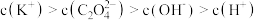
b.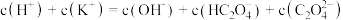
c.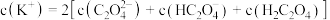
(2) 中碳元素的化合价是+3 价,推测其有还原性。文献表明:相同条件下,
中碳元素的化合价是+3 价,推测其有还原性。文献表明:相同条件下, 的还原性强于 Fe2+。为验证此结论,小组同学完成了如下实验:向10 mL0.5 mol·L−1FeCl3溶液中缓慢加入0.5mol·L−1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
的还原性强于 Fe2+。为验证此结论,小组同学完成了如下实验:向10 mL0.5 mol·L−1FeCl3溶液中缓慢加入0.5mol·L−1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
资料:三水三草酸合铁酸钾[K3Fe(C2O4)3·3H2O]为翠绿色晶体,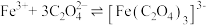 ,
,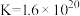 。
。
取少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。用平衡移动原理解释溶液变红的原因是_______ 。
(1)已知:
 ,
,
①将等物质的量浓度、等体积的H2C2O4溶液与KOH溶液混合,反应的离子方程式是
②向①中继续加入KOH溶液至恰好完全反应,得到K2C2O4溶液。下列关系正确的是
a.
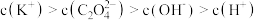
b.
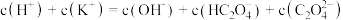
c.
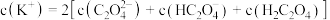
(2)
 中碳元素的化合价是+3 价,推测其有还原性。文献表明:相同条件下,
中碳元素的化合价是+3 价,推测其有还原性。文献表明:相同条件下, 的还原性强于 Fe2+。为验证此结论,小组同学完成了如下实验:向10 mL0.5 mol·L−1FeCl3溶液中缓慢加入0.5mol·L−1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
的还原性强于 Fe2+。为验证此结论,小组同学完成了如下实验:向10 mL0.5 mol·L−1FeCl3溶液中缓慢加入0.5mol·L−1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。资料:三水三草酸合铁酸钾[K3Fe(C2O4)3·3H2O]为翠绿色晶体,
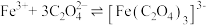 ,
,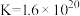 。
。取少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。用平衡移动原理解释溶液变红的原因是
您最近一年使用:0次
名校
2 . 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:
 。下列说法
。下列说法
| A.饮食中摄入过多食盐,会加重痛风病病情 | B.大量饮水会增大痛风病发作的可能性 |
| C.寒冷季节更易诱发关节疼痛 | D.患痛风病的人应少吃能代谢产生更多尿酸的食物 |
您最近一年使用:0次
2024-02-21更新
|
161次组卷
|
41卷引用:北京市顺义区2023届高三第一次统练化学试题
北京市顺义区2023届高三第一次统练化学试题(已下线)专题15 化学反应速率和化学平衡北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第六十六中学2023-2024学年高二上学期期中质量检测化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题北京市顺义区2022-2023学年高三上学期第一次统练化学试卷北京市西城区2019-2020学年度高二上学期期末考试化学试题北京市第四十三中学2020-2021学年高二上学期12月月考化学试题北京市房山区2020-2021学年高二上学期期末考试化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2021-2022学年高二上学期期中考试化学试题 北京市房山区2022-2023学年高二上学期期中质量检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题广东省汕头市聿怀中学2022-2023学年高二上学期期末线上考试化学试题安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高二上学期11月期中考试化学试题北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题四川省内江市2025届第三中学高二上学期化学试卷上海市奉贤区2020届高三5月教学质量调研(二模)化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题河南省焦作市县级重点中学2021-2022学年高二上学期期中考试化学试题吉林省长白山第二高级中学校2021-2022学年高三上学期第二次月考化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期11月期中检测化学试题河南省信阳市淮滨县2022-2023学年高二上学期11月期中考试化学试题
名校
3 . 下列事实能用平衡移动原理解释的是
| A.H2O2溶液中加入少量FeCl3固体,促进H2O2分解 |
| B.铁钉放入浓HNO3中不再变化后,加热能产生大量红棕色气体 |
| C.氯碱工业中阳极区的溶液用盐酸调pH为2~3,促进Cl2的产生 |
| D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生 |
您最近一年使用:0次
名校
4 . 血浆中存在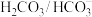 “缓冲"体系:
“缓冲"体系: 。该体系可使人体血液pH保持在7.35-7.45。血液pH降到7.2以下引起酸中毒,升至7.5以上会引起碱中毒,更高或更低会危及生命安全。下列说法正确的是
。该体系可使人体血液pH保持在7.35-7.45。血液pH降到7.2以下引起酸中毒,升至7.5以上会引起碱中毒,更高或更低会危及生命安全。下列说法正确的是
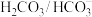 “缓冲"体系:
“缓冲"体系: 。该体系可使人体血液pH保持在7.35-7.45。血液pH降到7.2以下引起酸中毒,升至7.5以上会引起碱中毒,更高或更低会危及生命安全。下列说法正确的是
。该体系可使人体血液pH保持在7.35-7.45。血液pH降到7.2以下引起酸中毒,升至7.5以上会引起碱中毒,更高或更低会危及生命安全。下列说法正确的是A.该体系中一定不存在 |
B.人体血液碱中毒时,可注射 溶液缓解 溶液缓解 |
C.血液中 浓度增大,会使上述平衡向正反应方向移动 浓度增大,会使上述平衡向正反应方向移动 |
| D.“缓冲作用,是指体系中增加少量强酸或强碱时,pH不会出现较大幅度变化 |
您最近一年使用:0次
5 . 下列事实不能用平衡移动原理解释的是
A. 溶液中加入固体KSCN后颜色变深 溶液中加入固体KSCN后颜色变深 |
| B.实验室用排饱和食盐水的方法收集氯气 |
C.工业合成氨:  ,采用400℃~500℃的高温条件 ,采用400℃~500℃的高温条件 |
D.工业制备 : :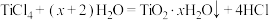 ,加入大量水,同时加热 ,加入大量水,同时加热 |
您最近一年使用:0次
2024-01-24更新
|
101次组卷
|
2卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
名校
6 . 某同学研究浓度对化学平衡的影响,下列说法不正确的是
已知: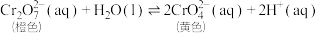 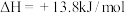 | |
| 实验步骤 | 实验现象 |
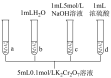 | ⅰ.待试管b中颜色不变后与试管a比较,试管b中橙色比试管a中的浅; ⅱ.待试管c中颜色不变后与试管b比较,试管c中的颜色比试管b中的浅; ⅲ.滴加浓硫酸,试管d温度略有升高,溶液颜色与试管b中的相比,变深 |
| A.试管b中的现象说明加水后平衡正向移动 |
| B.该实验能证明减小生成物浓度,平衡正向移动 |
| C.“待试管c中溶液颜色不变”的目的是使反应达到平衡状态 |
D.试管d中的现象能说明影响平衡的主要因素是 增大 增大 |
您最近一年使用:0次
名校
7 . 氯水中存在平衡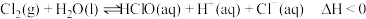 ,下列说法正确的是
,下列说法正确的是
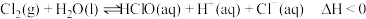 ,下列说法正确的是
,下列说法正确的是A.升高温度,氯水中的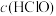 增大 增大 |
| B.氯水中加入少量醋酸钠固体,平衡不发生移动 |
C.该平衡可解释用饱和食盐水除去氯气中混有的 气体的原因 气体的原因 |
D.取两份氯水,分别滴加 溶液和淀粉 溶液和淀粉 溶液,若前者产生白色沉淀,后者溶液变蓝色,可以证明上述反应为可逆反应 溶液,若前者产生白色沉淀,后者溶液变蓝色,可以证明上述反应为可逆反应 |
您最近一年使用:0次
名校
8 . 密闭容器内的可逆反应 达到平衡状态时,保持恒温恒容,向容器中加入一定量的
达到平衡状态时,保持恒温恒容,向容器中加入一定量的 ,下列说法正确的是
,下列说法正确的是
 达到平衡状态时,保持恒温恒容,向容器中加入一定量的
达到平衡状态时,保持恒温恒容,向容器中加入一定量的 ,下列说法正确的是
,下列说法正确的是A.平衡正向移动, 转化率增大 转化率增大 | B.浓度商Q变小,平衡常数K变大 |
C.正反应速率增大, 转化率增大 转化率增大 | D.逆反应速率减小,平衡常数K不变 |
您最近一年使用:0次
名校
解题方法
9 . 白云石的主要化学成分为 ,还含有质量分数约为2.1%的
,还含有质量分数约为2.1%的 和1.0%的
和1.0%的 。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
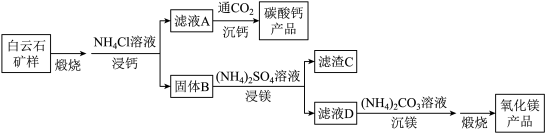
已知:
(1)白云石矿样煅烧完全分解的化学方程式为___________ 。
(2) 用量对碳酸钙产品的影响如下表所示。
用量对碳酸钙产品的影响如下表所示。
备注:ⅰ. 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量)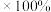 (M代表
(M代表 或
或 )
)
ⅱ. 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。
①解释“浸钙”过程中主要浸出 的原因是
的原因是___________ 。
②沉钙反应的离子方程式为___________ 。
③“浸钙”过程不适宜选用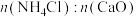 的比例为
的比例为___________ 。
④产品中 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是___________ 。
(3)“浸镁”过程中,取固体B与一定浓度的 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是___________ 。
(4)滤渣C中含有的物质是 、
、 和
和___________ 。
(5)该流程中可循环利用的物质是 、
、 和
和___________ 。
 ,还含有质量分数约为2.1%的
,还含有质量分数约为2.1%的 和1.0%的
和1.0%的 。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
已知:
| 物质 |  |  |  |  |
 | 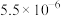 |  |  | 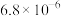 |
(1)白云石矿样煅烧完全分解的化学方程式为
(2)
 用量对碳酸钙产品的影响如下表所示。
用量对碳酸钙产品的影响如下表所示。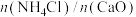 | 氧化物( )浸出率/% )浸出率/% | 产品中 纯度/% 纯度/% | 产品中 杂质含量/%(以 杂质含量/%(以 计) 计) | ||
 |  | 计算值 | 实测值 | ||
| 2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
| 2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
| 2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量)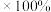 (M代表
(M代表 或
或 )
)ⅱ.
 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。①解释“浸钙”过程中主要浸出
 的原因是
的原因是②沉钙反应的离子方程式为
③“浸钙”过程不适宜选用
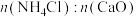 的比例为
的比例为④产品中
 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是(3)“浸镁”过程中,取固体B与一定浓度的
 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是(4)滤渣C中含有的物质是
 、
、 和
和(5)该流程中可循环利用的物质是
 、
、 和
和
您最近一年使用:0次
名校
10 . 下列事实不能 用化学平衡移动原理解释的是
| A.打开碳酸饮料瓶盖有气泡产生 |
| B.实验室收集氯气时,常用排饱和食盐水的方法收集 |
C.除去 中的 中的 时,常用酸性 时,常用酸性 溶液洗气 溶液洗气 |
D.检验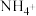 时、需向待测液中加入浓 时、需向待测液中加入浓 溶液,并加热 溶液,并加热 |
您最近一年使用:0次



