1 . 反应SO2(g)+NO2(g)  SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
(1)该反应达到平衡状态的标志是___________
A.SO3(g)的生成速率等于SO2(g)的消耗速率
B.混合物的物质的量不再发生变化
C.混合气体的平均摩尔质量不再发生变化
D.混合气体的压强不再发生变化
E.各组分的物质的量分数不再发生变化
(2)此反应在该温度下的平衡常数为___________ 。
(3)在上述温度下,若SO2(g)的初始浓度增大到3 mol·L-1,NO2(g)的初始浓度仍为2 mol·L-1,达到化学平衡状态时,计算下列各物质的平衡浓度及SO2和NO2的平衡转化率。
①c(SO3) =___________ mol·L-1,c(SO2)=___________ mol·L-1。
②SO2的转化率为___________ , NO2的转化率为___________ 。
(4)反应SO2(g)+NO2(g) NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
①平衡左移,容器内压强不一定增大 ②平衡右移,平衡时容器内压强不一定增大 ③平衡不一定移动,容器内压强一定增大 ④平衡右移,SO2转化率提高
 SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:(1)该反应达到平衡状态的标志是
A.SO3(g)的生成速率等于SO2(g)的消耗速率
B.混合物的物质的量不再发生变化
C.混合气体的平均摩尔质量不再发生变化
D.混合气体的压强不再发生变化
E.各组分的物质的量分数不再发生变化
(2)此反应在该温度下的平衡常数为
(3)在上述温度下,若SO2(g)的初始浓度增大到3 mol·L-1,NO2(g)的初始浓度仍为2 mol·L-1,达到化学平衡状态时,计算下列各物质的平衡浓度及SO2和NO2的平衡转化率。
①c(SO3) =
②SO2的转化率为
(4)反应SO2(g)+NO2(g)
 NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。①平衡左移,容器内压强不一定增大 ②平衡右移,平衡时容器内压强不一定增大 ③平衡不一定移动,容器内压强一定增大 ④平衡右移,SO2转化率提高
| A.①② | B.②③ | C.③④ | D.②④ |
您最近半年使用:0次
名校
2 . Ⅰ.甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
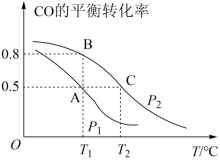
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是___________ ;平衡常数K=___________ 。平衡后再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大”、“不变”成“减小”),CO与CH3OH的浓度比
___________ (填“增大”、“不变”或“减小”)。
(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___________ v(逆)(填“>”、“<”或“=”)。
(3)若p2压强恒定为p,则平衡常数Kp=___________ (Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s) PH3(g)+HI(g)
PH3(g)+HI(g)
②4PH3(g) P4(g)+6H2(g)
P4(g)+6H2(g)
③2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将___________ (填“增加”、“减小”或“不变”)。
(5)平衡后容器内P4(g)的物质的量___________ 。
(6)求反应①的K___________ 。
 CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是

(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
(3)若p2压强恒定为p,则平衡常数Kp=
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s)
 PH3(g)+HI(g)
PH3(g)+HI(g) ②4PH3(g)
 P4(g)+6H2(g)
P4(g)+6H2(g) ③2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将
(5)平衡后容器内P4(g)的物质的量
(6)求反应①的K
您最近半年使用:0次
名校
3 . 在某刚性容器中发生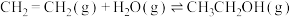
 ,下列说法正确的是
,下列说法正确的是
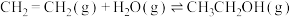
 ,下列说法正确的是
,下列说法正确的是A.恒温恒容条件下,增大 的物质的量,则 的物质的量,则 的平衡转化率增大 的平衡转化率增大 |
| B.恒温恒压条件下达到平衡状态,再通入适量氮气,平衡逆向移动,平衡常数减小 |
C.恒温恒容条件下达到平衡状态,升高温度,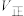 增大, 增大,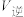 增大,平衡向逆反应方向移动 增大,平衡向逆反应方向移动 |
D.加入催化剂,能缩短达到平衡时间,并提高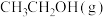 的平衡产率 的平衡产率 |
您最近半年使用:0次
名校
解题方法
4 . 含氮、含硫化合物在工业、农业生产中应用广泛,氮、硫的氧化物对环境不友好经常采用碱液吸收法消除氮、硫的氧化物。
(1)硫酸肼(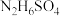 )是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与
)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似,写出硫酸肼第一步水解反应的离子方程式:
类似,写出硫酸肼第一步水解反应的离子方程式:___________ 。
(2)利用氢氧化钠溶液吸收 。吸收
。吸收 的过程中,溶液中
的过程中,溶液中 、
、 、
、 三者所占物质的量分数(a)随pH变化的关系如图所示:
三者所占物质的量分数(a)随pH变化的关系如图所示:
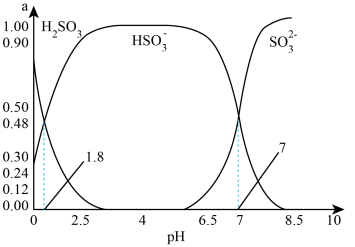
①图中 时,溶液中离子浓度关系正确的是
时,溶液中离子浓度关系正确的是___________ (填字母)。
A.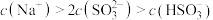
B.
C.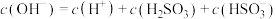
D.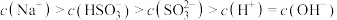
②利用图中数据,求反应 的平衡常数的数值
的平衡常数的数值___________ 。
③用NaOH吸收 ,并用CaO使NaOH再生:
,并用CaO使NaOH再生: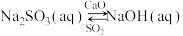 。CaO在水中存在如下转化:
。CaO在水中存在如下转化: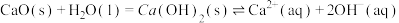 从平衡移动的角度,简述NaOH再生的原理:
从平衡移动的角度,简述NaOH再生的原理:___________ 。
(3)利用氢氧化钠溶液吸收 ,反应为
,反应为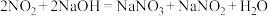 。已知25℃电离常数
。已知25℃电离常数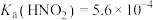 、
、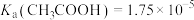 ,现有:溶液A:含0.2molNaOH的水溶液与0.2mol
,现有:溶液A:含0.2molNaOH的水溶液与0.2mol 恰好完全反应得1L溶液;溶液B:
恰好完全反应得1L溶液;溶液B: 溶液。两份溶液中
溶液。两份溶液中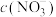 、
、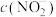 和
和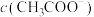 由大到小的顺序为
由大到小的顺序为___________ 。
(1)硫酸肼(
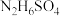 )是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与
)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似,写出硫酸肼第一步水解反应的离子方程式:
类似,写出硫酸肼第一步水解反应的离子方程式:(2)利用氢氧化钠溶液吸收
 。吸收
。吸收 的过程中,溶液中
的过程中,溶液中 、
、 、
、 三者所占物质的量分数(a)随pH变化的关系如图所示:
三者所占物质的量分数(a)随pH变化的关系如图所示:
①图中
 时,溶液中离子浓度关系正确的是
时,溶液中离子浓度关系正确的是A.
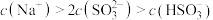
B.

C.
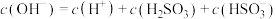
D.
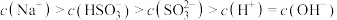
②利用图中数据,求反应
 的平衡常数的数值
的平衡常数的数值③用NaOH吸收
 ,并用CaO使NaOH再生:
,并用CaO使NaOH再生: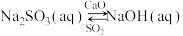 。CaO在水中存在如下转化:
。CaO在水中存在如下转化: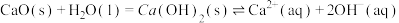 从平衡移动的角度,简述NaOH再生的原理:
从平衡移动的角度,简述NaOH再生的原理:(3)利用氢氧化钠溶液吸收
 ,反应为
,反应为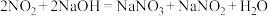 。已知25℃电离常数
。已知25℃电离常数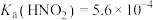 、
、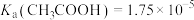 ,现有:溶液A:含0.2molNaOH的水溶液与0.2mol
,现有:溶液A:含0.2molNaOH的水溶液与0.2mol 恰好完全反应得1L溶液;溶液B:
恰好完全反应得1L溶液;溶液B: 溶液。两份溶液中
溶液。两份溶液中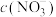 、
、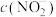 和
和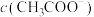 由大到小的顺序为
由大到小的顺序为
您最近半年使用:0次
名校
5 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与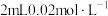 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与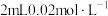 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。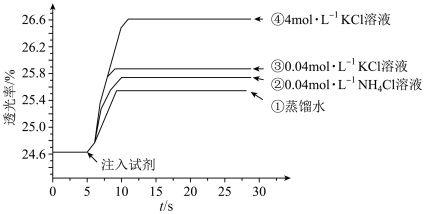
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近半年使用:0次
2023-11-21更新
|
340次组卷
|
7卷引用:河南省南阳市2023-2024学年高二上学期期中考试化学试题
名校
6 . 根据实验目的,下列实验现象、结论都正确的是
| 选项 | 实验目的 | 实验过程 | 现象及结论 |
| A | 测定中和反应的反应热 | 测定浓度均为1.0  和 和 溶液初始温度 溶液初始温度 。快速将体积均为100 。快速将体积均为100 的 的 和 和 溶液倒入量热计中,盖好杯盖,轻轻搅拌,记录体系的最高温度 溶液倒入量热计中,盖好杯盖,轻轻搅拌,记录体系的最高温度 。 。 |  和 和 溶液密度近似为1 溶液密度近似为1 ,溶液的比热容4.18 ,溶液的比热容4.18 。中和反应的反应热: 。中和反应的反应热: 。 。 |
| B | 探究铁钉镀铜 | 直流电源正极、负极分别与铁钉、铜片连接,将铁钉和铜片插入 溶液中,接通电源。 溶液中,接通电源。 | 铜片逐渐溶解,铁钉表面有红色物质析出。 |
| C | 探究浓度对化学平衡的影响 | 向 溶液中缓慢滴加硫酸,溶液由黄色变为橙色。 溶液中缓慢滴加硫酸,溶液由黄色变为橙色。 | 增大 浓度,化学平衡向生成 浓度,化学平衡向生成 的方向移动。 的方向移动。 |
| D | 探究不同催化剂的催化效果 | 向两支试管中各加入2 10% 10% 溶液,再分别加入2滴1 溶液,再分别加入2滴1  溶液、2滴1 溶液、2滴1  溶液。 溶液。 | 滴加 溶液的试管产生气泡的速率快,说明 溶液的试管产生气泡的速率快,说明 的催化效果好。 的催化效果好。 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-11-12更新
|
127次组卷
|
2卷引用:河南省郑州市十校联考2023-2024学年高二上学期期中考试化学试题
名校
7 . 科学探究是化学学科核心素养之一,下列实验方案设计中,能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明浓度对平衡FeCl3+3KSCN Fe(SCN)3+3KCl的影响 Fe(SCN)3+3KCl的影响 | 向FeCl3和KSCN的混合溶液中,加入少量的KCl固体 |
| B | 氯气与水的反应存在限度 | 取两份新制氯水,分别滴加AgNO3溶液和KI溶液 |
| C | KI3溶液中存在平衡: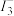  I2+I- I2+I- | 向盛有KI3溶液(显黄色)的①、②两支试管中分别滴加淀粉溶液、AgNO3溶液 |
| D | 证明HClO的酸性比CH3COOH弱 | 室温下,用pH试纸分别测定0.1mol·L-1的NaClO溶液和0.1mol·L-1的CH3COONa溶液的pH |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-11-12更新
|
156次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高二上学期11月期中化学试题
8 . 金属硫化物( )催化反应
)催化反应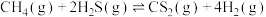
 ,既可以除去天然气中的
,既可以除去天然气中的 ,又可以获得
,又可以获得 。T℃时,该反应在某密闭容器中进行,下列有关说法正确的是
。T℃时,该反应在某密闭容器中进行,下列有关说法正确的是
 )催化反应
)催化反应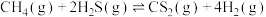
 ,既可以除去天然气中的
,既可以除去天然气中的 ,又可以获得
,又可以获得 。T℃时,该反应在某密闭容器中进行,下列有关说法正确的是
。T℃时,该反应在某密闭容器中进行,下列有关说法正确的是| A.平衡后通入Ne,反应速率增大 |
B.当 时,反应达到平衡状态 时,反应达到平衡状态 |
C.温度不变,压缩容器的容积,平衡逆向移动, 减小 减小 |
D.温度不变,改变条件使平衡常数 (浓度商),平衡正向移动 (浓度商),平衡正向移动 |
您最近半年使用:0次
名校
9 . 兴趣小组为探究FeCl3在溶液中显黄色的原因,进行如下实验。
下列说法不正确 的是
| 序号 | 操作 | 试剂a | 试剂b | 现象 |
| ① |  | 0.2mol/L FeCl3 | 蒸馏水 | 溶液为黄色 |
| ② | 0.2mol/L FeCl3 | 2mol/L盐酸 | 溶液为浅黄色 | |
| ③ | 0.2mol/L Fe(NO3)3 | 蒸馏水 | 溶液为浅黄色 | |
| ④ | 0.2mol/L Fe(NO3)3 | 2mol/L硝酸 | 溶液接近无色 |
| A.②中的溶液颜色比①中的浅,主要是因为Fe3+的水解平衡逆向移动 |
| B.由③④可知,Fe(NO3)3溶液显浅黄色与Fe3+水解有关 |
| C.由以上实验可推知,FeCl3溶液显黄色与Fe3+水解、Cl-存在均有关 |
| D.由以上实验可推知,导致②③溶液均为浅黄色的原因相同 |
您最近半年使用:0次
2023-11-02更新
|
370次组卷
|
6卷引用:河南省濮阳市油田第一中学2023-2024学年高三上学期培优测试理科综合化学试题
10 . 氯化法制备 TiCl4 的原理为:TiO2(s)+2Cl2(g)+2C(s)  TiCl4(g)+2CO(g) △H<0,下列有关该反应的说法正确的是
TiCl4(g)+2CO(g) △H<0,下列有关该反应的说法正确的是
 TiCl4(g)+2CO(g) △H<0,下列有关该反应的说法正确的是
TiCl4(g)+2CO(g) △H<0,下列有关该反应的说法正确的是A.其他条件不变,平衡后升温,会导致 |
| B.恒容条件下,将平衡体系中的 TiCl4(g)液化分离,体系的颜色不变 |
| C.该反应的反应物的总键能大于生成物的总键能 |
| D.恒温、恒压条件下,通入氩气会导致该平衡正向移动 |
您最近半年使用:0次



