11-12高二下·广东·期中
名校
解题方法
1 . 一定温度下,反应N2(g)+3H2(g) ⇌2NH3(g)的反应热和化学平衡常数分别为ΔH和K,则相同温度时反应4NH3(g)⇌2N2(g)+6H2(g)的反应热和化学平衡常数为
| A.2ΔH和2K | B.-2ΔH和K2 | C.2ΔH和-2K | D.-2ΔH和 |
您最近一年使用:0次
2023-09-05更新
|
250次组卷
|
21卷引用:甘肃省镇原县第二中学2021-2022学年高二上学期第一次月考化学试题
甘肃省镇原县第二中学2021-2022学年高二上学期第一次月考化学试题甘肃省兰州市联片办学2019-2020学年高二上学期期中考试化学(理)试题吉林省汪清县汪清四中2021-2022学年高二上学期第一次阶段考试化学试题福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题(已下线)2011-2012学年广东省三校高二下学期联考化学试卷2014-2015学年山东省济南一中高二上学期期中化学试卷2014-2015学年云南省曲靖市陆良县二中高二下期中化学试卷2015-2016学年安徽省郎溪中学高二上学期第一次月考化学试卷河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题黑龙江省鹤岗市第一中学2018-2019学年高一下学期期末化学试题陕西省黄陵中学2019-2020学年高二上学期期中考试化学试题江西省宜春市上高二中2019-2020学年高二上学期第二次月考化学试题湖南省长郡中学2019-2020学年高二上学期第三次月考化学试题贵州省毕节市民族中学2019-2020学年高二上学期第二次月考化学试题安徽省合肥市2019-2020学年高二上学期期末考试化学试题江西省赣州市会昌县会昌中学2020-2021学年高二上学期第一次月考化学试题重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题湖北省宜昌英杰学校2022-2023学年高二上学期10月测试化学试题新疆巴州第一中学2022-2023学年高二上学期10月月考化学试题四川省绵阳南山中学2023-2024学年高二上学期开学考试化学试题四川省南充市南部县第二中学2023-2024学年高二上学期10月月考化学试题
11-12高二·广东揭阳·阶段练习
名校
2 . 在一定温度时,将1molA(s)和2molB(g)置于容积为5L的某密闭容器中发生如下反应A(s)+2B(g)  C(g)+2D(g)5min后,测得容器内B(g)的浓度减少了0.2mol·L-1,则下列说法错误的是
C(g)+2D(g)5min后,测得容器内B(g)的浓度减少了0.2mol·L-1,则下列说法错误的是
 C(g)+2D(g)5min后,测得容器内B(g)的浓度减少了0.2mol·L-1,则下列说法错误的是
C(g)+2D(g)5min后,测得容器内B(g)的浓度减少了0.2mol·L-1,则下列说法错误的是| A.5min内,该反应用C(g)的浓度变化表示的反应速率为v(C)=0.02mol·L-1·min-1 |
| B.5min时,容器内D(g)的浓度为0.2mol·L-1 |
| C.该可逆反应达到限度之前,随着反应的进行,容器内压强逐渐增大 |
| D.5min时,容器内气体总的物质的量为3mol |
您最近一年使用:0次
2023-01-21更新
|
727次组卷
|
20卷引用:甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题
甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题甘肃省天水市田家炳中学2021-2022学年高二上学期高二第一阶段考试化学试题云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题(已下线)2012-2013学年广东省揭阳一中高二第一阶段考试化学试卷(已下线)2014年高一化学人教版必修二 2-3-2化学反应的限度练习卷2015-2016学年湖北省襄阳市四校高一下学期期中联考化学试卷江西省南康市南康中学2018-2019学年高二上学期第一次月考化学试题云南省会泽县茚旺高级中学2018-2019学年高二上学期12月月考化学试题福建省漳州市东山县第二中学2019届高三上学期第三次月考化学试题湖北省随州市第一中学2018-2019学年高一下学期期中考试化学试题河北省沧州市盐山中学2018-2019学年高一5月月考化学试题陕西省宝鸡市渭滨区2018-2019学年高一下学期期末考试化学试题宁夏回族自治区银川一中2019-2020学年高一下学期期中考试化学试题河北省保定市2019-2020学年高一下学期期末考试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期开学考试化学试题宁夏吴忠中学2020-2021学年高二10月月考理综化学试题宁夏银川市第二中学2021-2022学年高一下学期期中考试化学试题重庆市西南大学附属中学校2021-2022学年高一下学期期末考试化学试题辽宁省大连市第八中学2022-2023学年高一6月阶段测试化学试题四川省射洪中学2022—2023学年高一下学期(强基班)第三次月考化学试题
解题方法
3 . 在2L密闭容器中加入适量的氮气和氢气,发生反应N2(g)+3H2(g)  2NH3(g),10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol,n(H2)=1mol,n(NH3)=4mol,求:
2NH3(g),10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol,n(H2)=1mol,n(NH3)=4mol,求:
(1)N2的转化率和这段时间内NH3的化学反应速率分别是:____ 、____ ;
(2)平衡时压强与开始时压强的比值_______ ;
(3)该温度下反应的平衡常数_________ 。
 2NH3(g),10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol,n(H2)=1mol,n(NH3)=4mol,求:
2NH3(g),10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol,n(H2)=1mol,n(NH3)=4mol,求:(1)N2的转化率和这段时间内NH3的化学反应速率分别是:
(2)平衡时压强与开始时压强的比值
(3)该温度下反应的平衡常数
您最近一年使用:0次
2022-12-03更新
|
150次组卷
|
2卷引用:甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(A卷)试题
4 . Ⅰ.化学反应速率和化学平衡影响因素较多,经常采用变量控制思想分析问题。某小组利用 溶液和酸性
溶液和酸性 溶液反应来探究“条件对化学反应速率的影响”,进行如表中的实验:
溶液反应来探究“条件对化学反应速率的影响”,进行如表中的实验:
请回答:
(1)已知 酸性溶液与
酸性溶液与 溶液反应有
溶液反应有 生成,用化学方程式表示该实验的实验原理:
生成,用化学方程式表示该实验的实验原理:___________ 。
(2)根据表中的实验数据,可以得到的结论是___________ 。
(3)利用实验3中数据计算,用 溶液的浓度变化表示的反应速率为
溶液的浓度变化表示的反应速率为
___________ 。
Ⅱ.研究 的综合利用对促进“低碳经济”的发展有重要意义。工业上以
的综合利用对促进“低碳经济”的发展有重要意义。工业上以 、,为原料生产尿素
、,为原料生产尿素 ,
,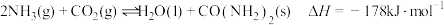 ,
,
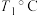 时,在1L的密闭容器中充入
时,在1L的密闭容器中充入 和模拟工业生产,
和模拟工业生产, ,图中是
,图中是 平衡转化率
平衡转化率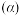 与
与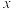 的关系。
的关系。
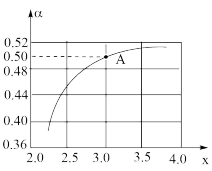
(4)图中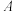 点
点 的平衡转化率
的平衡转化率
___________ %(结果保留3位有效数字)。
(5)当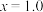 时,若起始的压强为
时,若起始的压强为 ,水为液态平衡时压强变为起始的
,水为液态平衡时压强变为起始的 ,则该反应的平衡常数
,则该反应的平衡常数 =
=___________ ( 为以分压表示的平衡常数,分压=总压
为以分压表示的平衡常数,分压=总压 体积分数)。
体积分数)。
 溶液和酸性
溶液和酸性 溶液反应来探究“条件对化学反应速率的影响”,进行如表中的实验:
溶液反应来探究“条件对化学反应速率的影响”,进行如表中的实验:| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
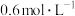  溶液 溶液 |  |   溶液 溶液 |  稀硫酸 稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
请回答:
(1)已知
 酸性溶液与
酸性溶液与 溶液反应有
溶液反应有 生成,用化学方程式表示该实验的实验原理:
生成,用化学方程式表示该实验的实验原理:(2)根据表中的实验数据,可以得到的结论是
(3)利用实验3中数据计算,用
 溶液的浓度变化表示的反应速率为
溶液的浓度变化表示的反应速率为
Ⅱ.研究
 的综合利用对促进“低碳经济”的发展有重要意义。工业上以
的综合利用对促进“低碳经济”的发展有重要意义。工业上以 、,为原料生产尿素
、,为原料生产尿素 ,
,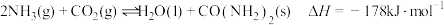 ,
,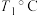 时,在1L的密闭容器中充入
时,在1L的密闭容器中充入 和模拟工业生产,
和模拟工业生产, ,图中是
,图中是 平衡转化率
平衡转化率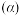 与
与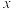 的关系。
的关系。
(4)图中
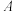 点
点 的平衡转化率
的平衡转化率
(5)当
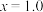 时,若起始的压强为
时,若起始的压强为 ,水为液态平衡时压强变为起始的
,水为液态平衡时压强变为起始的 ,则该反应的平衡常数
,则该反应的平衡常数 =
= 为以分压表示的平衡常数,分压=总压
为以分压表示的平衡常数,分压=总压 体积分数)。
体积分数)。
您最近一年使用:0次
5 . 根据所学知识回答问题:
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g) CH3OH(g) ,CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g) ,CO的平衡转化率与温度,压强的关系如图所示。

①A、B两点对应的压强大小关系是PA___________ PB(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是___________
(2)①在P1压强、T1℃时,该反应的平衡常数K=___________ ,再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大”、“不变”或“减小”)
② T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正___________ v逆(填>、<或=)。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)
 CH3OH(g) ,CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g) ,CO的平衡转化率与温度,压强的关系如图所示。
①A、B两点对应的压强大小关系是PA
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
(2)①在P1压强、T1℃时,该反应的平衡常数K=
② T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正
您最近一年使用:0次
6 . 回答下列问题:
(1)已知一定条件下的合成氨反应:N2(g)+3H2(g) 2NH3(g) △H=-92.4KJ•mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
2NH3(g) △H=-92.4KJ•mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。

t1____ ,t2____ ,t3____ ,t4____ ,写出t3至t4阶段达到平衡时反应的化学平衡常数的表达式K=____ 。
(2)现有可逆反应A(气)+B(气) 3C(气),图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
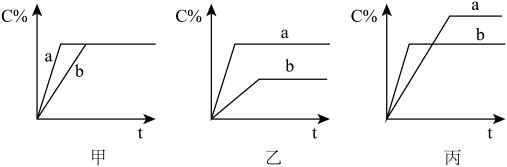
①若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则____ 曲线是表示有催化剂时的情况。
②若乙图中的a曲线表示200℃时的情况,b曲线表示100℃时的情况,则此可逆反应的正反应是___ 热反应。
③若丙图中两条曲线分别表示不同压强下的情况,则____ 曲线是表示压强较大的情况。
(1)已知一定条件下的合成氨反应:N2(g)+3H2(g)
 2NH3(g) △H=-92.4KJ•mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
2NH3(g) △H=-92.4KJ•mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
t1
(2)现有可逆反应A(气)+B(气)
 3C(气),图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
①若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则
②若乙图中的a曲线表示200℃时的情况,b曲线表示100℃时的情况,则此可逆反应的正反应是
③若丙图中两条曲线分别表示不同压强下的情况,则
您最近一年使用:0次
7 . 回答下列问题:
(1)在密闭容器中充入2.0molCO和10molH2O(g),发生反应:CO(g)+H2O(g) CO2(g)+H2(g),800℃时反应达平衡,若K=1。求平衡时CO气体的物质的量为
CO2(g)+H2(g),800℃时反应达平衡,若K=1。求平衡时CO气体的物质的量为____ 。
(2)PCl5的热分解反应如下:PCl5(g) PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
①写出反应的平衡常数表达式_____ 。
②已知某温度下,在容积为10.0L的密闭容器中充入2.00molPCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数为___ 。
(3)二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
II.2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),求:
①达平衡时,反应II中CH3OH的转化率a=____ 。
②反应I的平衡常数K=____ 。
(1)在密闭容器中充入2.0molCO和10molH2O(g),发生反应:CO(g)+H2O(g)
 CO2(g)+H2(g),800℃时反应达平衡,若K=1。求平衡时CO气体的物质的量为
CO2(g)+H2(g),800℃时反应达平衡,若K=1。求平衡时CO气体的物质的量为(2)PCl5的热分解反应如下:PCl5(g)
 PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。①写出反应的平衡常数表达式
②已知某温度下,在容积为10.0L的密闭容器中充入2.00molPCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数为
(3)二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I.CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)II.2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),求:
①达平衡时,反应II中CH3OH的转化率a=
②反应I的平衡常数K=
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.(化学与生活)2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
(1)汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为CO2和___________ (填化学式)。
(2)明矾可用作废水处理的混凝剂,Al3+水解生成的___________ (填化学式)胶体能吸附水中的悬浮颗粒,并使之沉降。
(3)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是___________ (填化学式)。在煤中加入适量石灰石,可以大大减少煤燃烧时SO2的排放,发生反应的化学方程式为___________ (请写出其总反应方程式)。
Ⅱ.(化学反应原理)
(4)对反应N2O4(g)⇌2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1___________ T2(填“>”“<”或“=”)。

(5)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为___________ 。
②该反应的平衡常数K的值为___________ 。(结果保留小数点后两位)
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是___________ mol/L。
(1)汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为CO2和
(2)明矾可用作废水处理的混凝剂,Al3+水解生成的
(3)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是
Ⅱ.(化学反应原理)
(4)对反应N2O4(g)⇌2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1

(5)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为
②该反应的平衡常数K的值为
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是
您最近一年使用:0次
名校
9 . 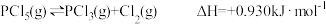 ,T℃时向2.0L恒容密闭容器中充入
,T℃时向2.0L恒容密闭容器中充入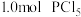 ,反应过程中测定的部分数据见下表,回答下列问题:
,反应过程中测定的部分数据见下表,回答下列问题:
(1)该反应在低温下___________ 自发进行(填“能”与“不能”)。
(2)反应在前 内的用
内的用 表示平均速率为
表示平均速率为___________ 。
(3)该反应平衡常数K=___________ 。
(4)体系平衡时与反应起始时的压强之比为___________ 。
(5)其它条件均不变,在上述平衡体系中再加入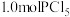 ,达到新平衡时,
,达到新平衡时,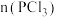
___________ 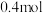 (填>,<,=)
(填>,<,=)
(6)相同温度下,起始时向容器中充入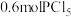 、
、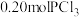 和
和 ,反应达到平衡前v(正)
,反应达到平衡前v(正)___________ v(逆)(填>,<,=)
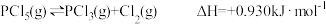 ,T℃时向2.0L恒容密闭容器中充入
,T℃时向2.0L恒容密闭容器中充入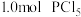 ,反应过程中测定的部分数据见下表,回答下列问题:
,反应过程中测定的部分数据见下表,回答下列问题:| t/s | 0 | 50 | 150 | 250 | 350 |
 | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(1)该反应在低温下
(2)反应在前
 内的用
内的用 表示平均速率为
表示平均速率为(3)该反应平衡常数K=
(4)体系平衡时与反应起始时的压强之比为
(5)其它条件均不变,在上述平衡体系中再加入
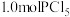 ,达到新平衡时,
,达到新平衡时,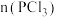
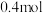 (填>,<,=)
(填>,<,=)(6)相同温度下,起始时向容器中充入
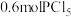 、
、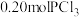 和
和 ,反应达到平衡前v(正)
,反应达到平衡前v(正)
您最近一年使用:0次
名校
解题方法
10 . 氮氧化物的处理是环境科学研究的热点课题。
(1)Ⅰ.
Ⅱ.
Ⅲ.
利用高效催化剂处理汽车尾气中的NO和CO,发生反应: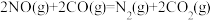 。
。
①该反应正反应的活化能为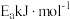 ,则逆反应的活化能为
,则逆反应的活化能为___________  。
。
②在 恒容密闭容器中加入
恒容密闭容器中加入 和
和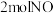 ,测得NO转化率与温度、时间的关系图:
,测得NO转化率与温度、时间的关系图:

T1温度下,上述反应平衡常数K=___________ ;若在T1温度下,向平衡后的容器中再加入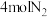 和
和 ,使平衡向右移动,则a的取值范围是
,使平衡向右移动,则a的取值范围是___________ 。
(2)向恒容密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应: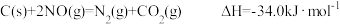
①若为绝热容器,下列表示该反应达到平衡状态的是___________ (填字母)。
A.混合气体的密度保持不变 B.混合气体的平均相对分子质量保持不变
C.NO和 的消耗速率之比为1:2 D.混合气体中
的消耗速率之比为1:2 D.混合气体中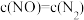
②恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间,测得NO的转化率随温度的变化如图所示:
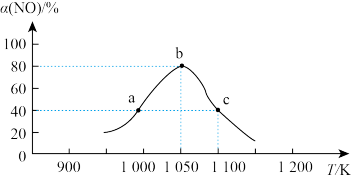
图中a、b、c三点中,达到平衡的点是___________ 。
(3)现代技术处理尾气的反应原理是 <0。500℃时,在2L恒容密闭容器中充入
<0。500℃时,在2L恒容密闭容器中充入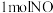 、
、 和
和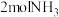 ,8min时反应达到平衡,此时
,8min时反应达到平衡,此时 的转化率为40%,体系压强为
的转化率为40%,体系压强为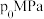 。500℃时该反应的平衡常数Kp=
。500℃时该反应的平衡常数Kp=___________ MPa(用含p0的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)Ⅰ.

Ⅱ.

Ⅲ.

利用高效催化剂处理汽车尾气中的NO和CO,发生反应:
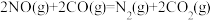 。
。①该反应正反应的活化能为
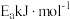 ,则逆反应的活化能为
,则逆反应的活化能为 。
。②在
 恒容密闭容器中加入
恒容密闭容器中加入 和
和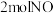 ,测得NO转化率与温度、时间的关系图:
,测得NO转化率与温度、时间的关系图:
T1温度下,上述反应平衡常数K=
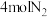 和
和 ,使平衡向右移动,则a的取值范围是
,使平衡向右移动,则a的取值范围是(2)向恒容密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应:
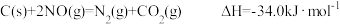
①若为绝热容器,下列表示该反应达到平衡状态的是
A.混合气体的密度保持不变 B.混合气体的平均相对分子质量保持不变
C.NO和
 的消耗速率之比为1:2 D.混合气体中
的消耗速率之比为1:2 D.混合气体中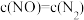
②恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间,测得NO的转化率随温度的变化如图所示:

图中a、b、c三点中,达到平衡的点是
(3)现代技术处理尾气的反应原理是
 <0。500℃时,在2L恒容密闭容器中充入
<0。500℃时,在2L恒容密闭容器中充入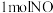 、
、 和
和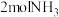 ,8min时反应达到平衡,此时
,8min时反应达到平衡,此时 的转化率为40%,体系压强为
的转化率为40%,体系压强为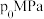 。500℃时该反应的平衡常数Kp=
。500℃时该反应的平衡常数Kp=
您最近一年使用:0次



