名校
解题方法
1 . 重铬酸钠晶体( )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
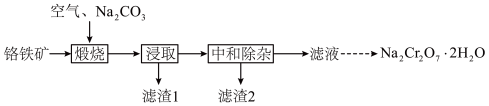
已知:① 在水溶液中常以
在水溶液中常以 、
、 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。
②酸性条件下, 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成 。
。
请回答下列问题:
(1)“煅烧”时, 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式_______ 。
(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液 约为7。
约为7。
①加热至接近沸腾的目的为_______ 。
②若持续加热较长时间,可以通过生成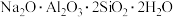 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式_______ 。
(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



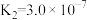
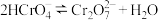
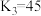
室温下,反应 的平衡常数
的平衡常数
_______ ;酸化 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是_______ 。
 )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
已知:①
 在水溶液中常以
在水溶液中常以 、
、 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。②酸性条件下,
 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成 。
。请回答下列问题:
(1)“煅烧”时,
 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液
 约为7。
约为7。①加热至接近沸腾的目的为
②若持续加热较长时间,可以通过生成
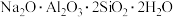 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



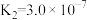
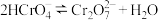
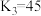
室温下,反应
 的平衡常数
的平衡常数
 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是
您最近一年使用:0次
2021-09-20更新
|
350次组卷
|
3卷引用:江苏省泰州中学2022届高三上学期期初检测化学试题
解题方法
2 . 大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI酸性溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程可发生如下反应:
②IO-(aq)+H+(aq) HOI(aq)
HOI(aq) 
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l)
I2(aq)+H2O(l) 
写出O3将I-氧化的总反应的热化学方程式为:____________ 。
(2)在溶液中存在化学平衡I2(aq)+I-(aq) I3-(aq),在反应的整个过程中I3-物质的量浓度变化情况是
I3-(aq),在反应的整个过程中I3-物质的量浓度变化情况是_______ 。
(3)为探究温度对I2(aq)+I-(aq) I3-(aq)
I3-(aq) 反应的影响。在某温度T1下,将NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应反应)。在t时刻,测得容器中I2(g)的浓度,然后分别在温度为T2、T3、T4、T5下,保证其他初始实验条件不变,重复上述实验,经过相同时间测得I2(g)的浓度。得到趋势图(如下图一所示)
反应的影响。在某温度T1下,将NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应反应)。在t时刻,测得容器中I2(g)的浓度,然后分别在温度为T2、T3、T4、T5下,保证其他初始实验条件不变,重复上述实验,经过相同时间测得I2(g)的浓度。得到趋势图(如下图一所示)

①若在T3时,容器中无O3,T4~T5温度区间容器内I2(g)浓度呈现如图一所示的变化趋势。则
______ 0(填“>0”、“=”或“<”);该条件下在温度T4时,将一定量的I2投入0.20
 溶液中充分反应,测得I-浓度变化如图二所示。在t2时刻,将该反应体系温度从T4上升到T5,并维持该温度。请在图二中画出t2时刻后溶液中I-浓度变化总趋势曲线
溶液中充分反应,测得I-浓度变化如图二所示。在t2时刻,将该反应体系温度从T4上升到T5,并维持该温度。请在图二中画出t2时刻后溶液中I-浓度变化总趋势曲线______ 。
②由I2(aq)+I-(aq) I3-(aq),在水溶液中难以准确测定I2的浓度。本实验将一定量的I2投入0.20
I3-(aq),在水溶液中难以准确测定I2的浓度。本实验将一定量的I2投入0.20
 溶液中充分反应,并在溶液中加入一定量的CCl4充分萃取后,测出CCl4中I2的浓度为0.11
溶液中充分反应,并在溶液中加入一定量的CCl4充分萃取后,测出CCl4中I2的浓度为0.11 ,此时溶液中I-为0.10
,此时溶液中I-为0.10 。查阅资料可知,在一定温度下,发生萃取后I2在CCl4中的浓度与I2在水中的浓度之比为一常数
。查阅资料可知,在一定温度下,发生萃取后I2在CCl4中的浓度与I2在水中的浓度之比为一常数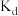 (已知
(已知 时,
时,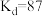 )。根据上述实验相关数据,计算温度为
)。根据上述实验相关数据,计算温度为 时,I2(aq)+I-(aq)
时,I2(aq)+I-(aq)  I3-(aq)反应的平衡常数K的值为
I3-(aq)反应的平衡常数K的值为___________ 。
③已知该反应中υ正=k正·c(I2)·c(I-),υ逆=k逆·c(I3-),其中 、
、 均为速率常数,则
均为速率常数,则 为
为________________ 。(以K和 表示)。
表示)。
(4)优质的锂电池可用于心脏起搏器延续患者的生命。它的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是固态薄膜状碘化锂。总反应为: P2VP·nI2+2Li=P2VP·(n-1)I2+2LiI。该电池的正极反应式为________ 。
(1)O3将I-氧化成I2的过程可发生如下反应:
①I-(aq)+O3(g)=IO-(aq)+O2(g) 
②IO-(aq)+H+(aq)
 HOI(aq)
HOI(aq) 
③HOI(aq)+I-(aq)+H+(aq)
 I2(aq)+H2O(l)
I2(aq)+H2O(l) 
写出O3将I-氧化的总反应的热化学方程式为:
(2)在溶液中存在化学平衡I2(aq)+I-(aq)
 I3-(aq),在反应的整个过程中I3-物质的量浓度变化情况是
I3-(aq),在反应的整个过程中I3-物质的量浓度变化情况是(3)为探究温度对I2(aq)+I-(aq)
 I3-(aq)
I3-(aq) 反应的影响。在某温度T1下,将NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应反应)。在t时刻,测得容器中I2(g)的浓度,然后分别在温度为T2、T3、T4、T5下,保证其他初始实验条件不变,重复上述实验,经过相同时间测得I2(g)的浓度。得到趋势图(如下图一所示)
反应的影响。在某温度T1下,将NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应反应)。在t时刻,测得容器中I2(g)的浓度,然后分别在温度为T2、T3、T4、T5下,保证其他初始实验条件不变,重复上述实验,经过相同时间测得I2(g)的浓度。得到趋势图(如下图一所示)
①若在T3时,容器中无O3,T4~T5温度区间容器内I2(g)浓度呈现如图一所示的变化趋势。则


 溶液中充分反应,测得I-浓度变化如图二所示。在t2时刻,将该反应体系温度从T4上升到T5,并维持该温度。请在图二中画出t2时刻后溶液中I-浓度变化总趋势曲线
溶液中充分反应,测得I-浓度变化如图二所示。在t2时刻,将该反应体系温度从T4上升到T5,并维持该温度。请在图二中画出t2时刻后溶液中I-浓度变化总趋势曲线②由I2(aq)+I-(aq)
 I3-(aq),在水溶液中难以准确测定I2的浓度。本实验将一定量的I2投入0.20
I3-(aq),在水溶液中难以准确测定I2的浓度。本实验将一定量的I2投入0.20
 溶液中充分反应,并在溶液中加入一定量的CCl4充分萃取后,测出CCl4中I2的浓度为0.11
溶液中充分反应,并在溶液中加入一定量的CCl4充分萃取后,测出CCl4中I2的浓度为0.11 ,此时溶液中I-为0.10
,此时溶液中I-为0.10 。查阅资料可知,在一定温度下,发生萃取后I2在CCl4中的浓度与I2在水中的浓度之比为一常数
。查阅资料可知,在一定温度下,发生萃取后I2在CCl4中的浓度与I2在水中的浓度之比为一常数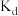 (已知
(已知 时,
时,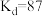 )。根据上述实验相关数据,计算温度为
)。根据上述实验相关数据,计算温度为 时,I2(aq)+I-(aq)
时,I2(aq)+I-(aq)  I3-(aq)反应的平衡常数K的值为
I3-(aq)反应的平衡常数K的值为③已知该反应中υ正=k正·c(I2)·c(I-),υ逆=k逆·c(I3-),其中
 、
、 均为速率常数,则
均为速率常数,则 为
为 表示)。
表示)。(4)优质的锂电池可用于心脏起搏器延续患者的生命。它的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是固态薄膜状碘化锂。总反应为: P2VP·nI2+2Li=P2VP·(n-1)I2+2LiI。该电池的正极反应式为
您最近一年使用:0次
名校
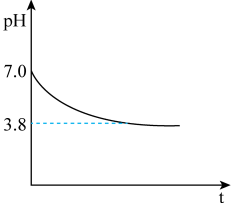
3 . 重铬酸钾(K2Cr2O7)有强氧化性,溶液中存在平衡:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+。取2.94 g重铬酸钾橙红色晶体,溶于100 mL水的同时利用数字传感器测定pH变化如图。下列说法正确的是
+2H+。取2.94 g重铬酸钾橙红色晶体,溶于100 mL水的同时利用数字传感器测定pH变化如图。下列说法正确的是
 +H2O⇌2CrO
+H2O⇌2CrO +2H+。取2.94 g重铬酸钾橙红色晶体,溶于100 mL水的同时利用数字传感器测定pH变化如图。下列说法正确的是
+2H+。取2.94 g重铬酸钾橙红色晶体,溶于100 mL水的同时利用数字传感器测定pH变化如图。下列说法正确的是
A.该溶液中含有Cr2O 离子数目为 0.01NA 离子数目为 0.01NA |
| B.Cr元素位于d区,基态原子有4个未成对电子 |
C.Cr2O +H2O⇌2CrO +H2O⇌2CrO +2H+的平衡常数K约为10-14.2 +2H+的平衡常数K约为10-14.2 |
| D.升高温度,溶液橙红色变浅,则该转化反应ΔH<0 |
您最近一年使用:0次
2021-12-02更新
|
184次组卷
|
2卷引用:辽宁省凌源市 2021-2022学年高二下学期开学考试化学试题
名校
解题方法
4 . 氮及其化合物一直为环境科学领域研究的重点。
(1)废水中的NH3可通过硝化作用消除,已知:
NH3(g)+ O2(g)=NO
O2(g)=NO (aq)+H+(aq)+H2O(l) △H=-273.5kJ/mol
(aq)+H+(aq)+H2O(l) △H=-273.5kJ/mol
NO (aq)+
(aq)+ O2(g)=NO
O2(g)=NO (aq) △H=-73.19kJ/mol
(aq) △H=-73.19kJ/mol
则NH3通过硝化作用转化为NO 的热化学方程式为
的热化学方程式为_______ 。
(2)某科研小组设计双阴极微生物燃料电池进行同步硝化和反硝化脱氮研究,如图所示,“厌氧阳极”的电极反应方程式为_______ ,若“好氧阴极”1molNH 完全硝化生成NO
完全硝化生成NO ,此时向该电极输送电子的物质的量为4mol,则“好氧阴极”区消耗的O2在标准状况的体积约为
,此时向该电极输送电子的物质的量为4mol,则“好氧阴极”区消耗的O2在标准状况的体积约为_______ L。

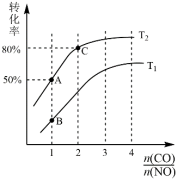
(3)汽车尾气中的CO、NO等气体可在催化剂表面发生氧化还原反应进行消除,主要原理如下:2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H<0,某小组模拟该反应,在1L恒容密闭容器内将气体总物质的量为6mol的CO和NO以不同的物质的量比 进行反应。
进行反应。
①平衡时某反应物的转化率与物质的量比及温度的关系如图,纵坐标表示_______ 的转化率,T1和T2关系为T1_______ T2(填“>”“<”或“=”),图中A、B、C三点对应反应速率v(NO)正最大的是_______ 点。
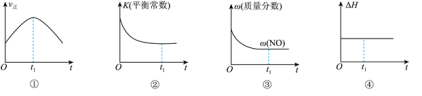
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______ 。
③已知:压强平衡常数Kp含义为:在平衡体系中用气体物质的分压(pi=p总×物质的量分数)代替浓度,计算得到的平衡常数。若容器内起始压强为p0,则C点的压强平衡常数_______ 。
(1)废水中的NH3可通过硝化作用消除,已知:
NH3(g)+
 O2(g)=NO
O2(g)=NO (aq)+H+(aq)+H2O(l) △H=-273.5kJ/mol
(aq)+H+(aq)+H2O(l) △H=-273.5kJ/molNO
 (aq)+
(aq)+ O2(g)=NO
O2(g)=NO (aq) △H=-73.19kJ/mol
(aq) △H=-73.19kJ/mol则NH3通过硝化作用转化为NO
 的热化学方程式为
的热化学方程式为(2)某科研小组设计双阴极微生物燃料电池进行同步硝化和反硝化脱氮研究,如图所示,“厌氧阳极”的电极反应方程式为
 完全硝化生成NO
完全硝化生成NO ,此时向该电极输送电子的物质的量为4mol,则“好氧阴极”区消耗的O2在标准状况的体积约为
,此时向该电极输送电子的物质的量为4mol,则“好氧阴极”区消耗的O2在标准状况的体积约为
(3)汽车尾气中的CO、NO等气体可在催化剂表面发生氧化还原反应进行消除,主要原理如下:2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H<0,某小组模拟该反应,在1L恒容密闭容器内将气体总物质的量为6mol的CO和NO以不同的物质的量比
 进行反应。
进行反应。①平衡时某反应物的转化率与物质的量比及温度的关系如图,纵坐标表示

②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是

③已知:压强平衡常数Kp含义为:在平衡体系中用气体物质的分压(pi=p总×物质的量分数)代替浓度,计算得到的平衡常数。若容器内起始压强为p0,则C点的压强平衡常数
您最近一年使用:0次
解题方法
5 . 工业生产硝酸铵的流程如下图所示:

(1)硝酸铵的水溶液呈________ (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为:_______________________ 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是___________。
②关于工业合成氨的反应,下列叙述正确的是____________。
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第___________ 步反应决定,总反应进行到_______ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=________________ 。
③在上面右图中画出第二步反应的平衡常数K随温度的变化的示意图_________ 。

(1)硝酸铵的水溶液呈
(2)已知N2(g)+3H2(g)
 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
①曲线a对应的温度是___________。
②关于工业合成氨的反应,下列叙述正确的是____________。
| A.及时分离出NH3可以提高H2的平衡转化率 |
| B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件 |
| C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N) |
| D.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93 |
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=
③在上面右图中画出第二步反应的平衡常数K随温度的变化的示意图
您最近一年使用:0次
6 . 2022年6月5日10时44分,神舟十四号载人飞船搭载3名航天员在酒泉卫星发射中心成功起航,航天员乘组将在空间站组合体工作生活6个月,空间站的水气整合系统利用“萨巴蒂尔反应”,将CO2转化为CH4和水蒸气,配合O2生成系统可实现O2的再生。回答下列问题:
Ⅰ.萨巴蒂尔反应为: CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
(1)常温常压下,已知:①H2和CH4的燃烧热(△H)分别为一285.5 kJ·mol-1和一890.0kJ·mol-1;
②H2O(g)=H2O(l) △H= -44.0kJ·mol-1,则△H1=_______ kJ·mol-1。
(2)研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“· ”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会_______ (填“放出热量”或“吸收热量”):反应历程中最小能垒(活化能)步骤的化学方程式为_______ 。

Ⅱ.实验证明CO2在一定条件下与H2O发生氧再生反应:CO2(g)+ 2H2O(g) CH4(g)+2O2(g) △H1= +802.3kJ · mol-1
CH4(g)+2O2(g) △H1= +802.3kJ · mol-1
(3)恒压P0条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。

350℃时,用平衡分压代替平衡浓度表示A点的化学平衡常数Kp=_______ (填计 算结果)[气体分压(P分)=气体总压(p总) ×气体物质的量分数];为了提高CO2的转化率,除改变温度外,还可采取的措施为_______ 。
(4)氧再生反应可以通过酸性条件下半导体光催化转化实现:反应机理如图所示:

①光催化CO2转化为CH4时,其阴极的电极反应式为_______ 。
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到 400℃之间,CH4生成速率加快的原因是_______ 。
Ⅰ.萨巴蒂尔反应为: CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1(1)常温常压下,已知:①H2和CH4的燃烧热(△H)分别为一285.5 kJ·mol-1和一890.0kJ·mol-1;
②H2O(g)=H2O(l) △H= -44.0kJ·mol-1,则△H1=
(2)研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“· ”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会

Ⅱ.实验证明CO2在一定条件下与H2O发生氧再生反应:CO2(g)+ 2H2O(g)
 CH4(g)+2O2(g) △H1= +802.3kJ · mol-1
CH4(g)+2O2(g) △H1= +802.3kJ · mol-1(3)恒压P0条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。

350℃时,用平衡分压代替平衡浓度表示A点的化学平衡常数Kp=
(4)氧再生反应可以通过酸性条件下半导体光催化转化实现:反应机理如图所示:

①光催化CO2转化为CH4时,其阴极的电极反应式为
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到 400℃之间,CH4生成速率加快的原因是
您最近一年使用:0次
2022-07-13更新
|
335次组卷
|
3卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期入学考试化学试题



