名校
解题方法
1 . 实验室模拟尿素法制备水合肼(N2H4·H2O)的流程如下:
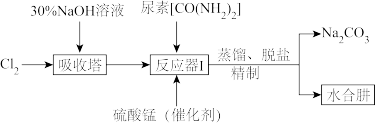
已知:①N2H4·H2O易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,将NaClO和NaOH的碱性混合溶液与尿素溶液反应生成N2H4·H2O。
回答下列问题:
(1)写出反应器1中生成水合肼反应的化学方程式:_______ 。
(2)反应器1要控制NaClO溶液的用量,其主要目的是_______ 。
(3)某实验室设计了如图所示装置制备N2H4。双极膜是阴、阳复合膜,层间的H2O解离成 和H+并可分别通过阴、阳膜定向移动。
和H+并可分别通过阴、阳膜定向移动。

①双极膜中产生的_______ (填“H+”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应式为_______ 。
(4)NO可被联氨(N2H4)或H2还原为N2,若在密闭容器中充入4molNO和5molH2,发生反应: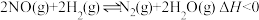 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
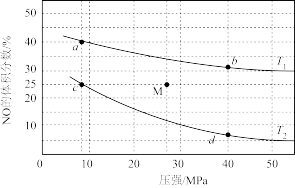
①下列物理量中,图中d点大于b点的是_______ (填字母)。
A.正反应速率 B.逆反应速率 C. N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为_______ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点_______ 。

已知:①N2H4·H2O易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,将NaClO和NaOH的碱性混合溶液与尿素溶液反应生成N2H4·H2O。
回答下列问题:
(1)写出反应器1中生成水合肼反应的化学方程式:
(2)反应器1要控制NaClO溶液的用量,其主要目的是
(3)某实验室设计了如图所示装置制备N2H4。双极膜是阴、阳复合膜,层间的H2O解离成
 和H+并可分别通过阴、阳膜定向移动。
和H+并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应式为
(4)NO可被联氨(N2H4)或H2还原为N2,若在密闭容器中充入4molNO和5molH2,发生反应:
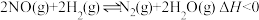 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.逆反应速率 C. N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点
您最近一年使用:0次
解题方法
2 . Ⅰ.探究实验。
(1)某化学兴趣小组设计实验探究 对
对 与
与 反应速率的影响:取等量
反应速率的影响:取等量 和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL
和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL  所需时间。
所需时间。
已知酸性条件下: 。
。
①表中
___________ mL。
②实验测得 ,则可得出的实验结论是
,则可得出的实验结论是___________ 。
(2)一定温度下,某密闭容器中发生反应 ,
,
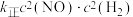 ,
,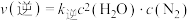 (
( 、
、 为速率常数)。该温度下该反应的平衡常数为
为速率常数)。该温度下该反应的平衡常数为___________ (用 、
、 表示)。
表示)。
Ⅱ.常温下,几种物质的溶度积常数如下表:
(3)某酸性 溶液中含少量的
溶液中含少量的 ,为制得纯净
,为制得纯净 溶液,宜加入
溶液,宜加入___________ 调至溶液pH=4,使 转化为
转化为 沉淀,此时溶液中
沉淀,此时溶液中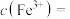
___________ 。
(4)过滤后,将所得滤液经过蒸发浓缩、冷却结晶,可得到 晶体。由
晶体。由 晶体得到纯的无水
晶体得到纯的无水 ,需要进行的操作是
,需要进行的操作是___________ 。
Ⅲ.加热饱和溶液,测得该溶液的pH变化如表所示:
(5)甲同学认为,该溶液pH升高的原因是 的水解程度增大,故碱性增强。而乙同学认为,该溶液pH升高的原因是
的水解程度增大,故碱性增强。而乙同学认为,该溶液pH升高的原因是 受热分解生成了
受热分解生成了 ,并推断
,并推断 的水解程度
的水解程度___________ (填“大于”或“小于”) 的。
的。
(6)丙同学认为甲、乙的判断都不充分。丙同学认为:将加热煮沸后的溶液冷却到10℃,若溶液的pH>8.3,则___________ (填“甲”或“乙”)同学判断正确。
(1)某化学兴趣小组设计实验探究
 对
对 与
与 反应速率的影响:取等量
反应速率的影响:取等量 和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL
和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL  所需时间。
所需时间。| 实验编号 | 1 | 2 | 3 | 4 |
10% 的体积/mL 的体积/mL | 10.0 | 10.0 | 10.0 |  |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | 1.5 |
| 水的体积/mL | 15.0 | 14.5 |  | 13.5 |
| 所需时间t/s |  |  |  |  |
 。
。①表中

②实验测得
 ,则可得出的实验结论是
,则可得出的实验结论是(2)一定温度下,某密闭容器中发生反应
 ,
,
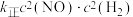 ,
,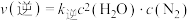 (
( 、
、 为速率常数)。该温度下该反应的平衡常数为
为速率常数)。该温度下该反应的平衡常数为 、
、 表示)。
表示)。Ⅱ.常温下,几种物质的溶度积常数如下表:
| 物质 |  |  | CuCl | CuI |
 | 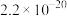 |  |  |  |
 溶液中含少量的
溶液中含少量的 ,为制得纯净
,为制得纯净 溶液,宜加入
溶液,宜加入 转化为
转化为 沉淀,此时溶液中
沉淀,此时溶液中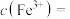
(4)过滤后,将所得滤液经过蒸发浓缩、冷却结晶,可得到
 晶体。由
晶体。由 晶体得到纯的无水
晶体得到纯的无水 ,需要进行的操作是
,需要进行的操作是Ⅲ.加热饱和溶液,测得该溶液的pH变化如表所示:
| 温度(℃) | 10 | 20 | 30 | 加热点沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
 的水解程度增大,故碱性增强。而乙同学认为,该溶液pH升高的原因是
的水解程度增大,故碱性增强。而乙同学认为,该溶液pH升高的原因是 受热分解生成了
受热分解生成了 ,并推断
,并推断 的水解程度
的水解程度 的。
的。(6)丙同学认为甲、乙的判断都不充分。丙同学认为:将加热煮沸后的溶液冷却到10℃,若溶液的pH>8.3,则
您最近一年使用:0次
名校
解题方法
3 . 重铬酸钠晶体( )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
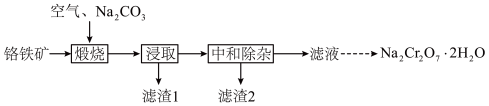
已知:① 在水溶液中常以
在水溶液中常以 、
、 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。
②酸性条件下, 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成 。
。
请回答下列问题:
(1)“煅烧”时, 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式_______ 。
(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液 约为7。
约为7。
①加热至接近沸腾的目的为_______ 。
②若持续加热较长时间,可以通过生成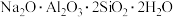 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式_______ 。
(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



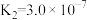
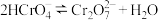
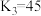
室温下,反应 的平衡常数
的平衡常数
_______ ;酸化 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是_______ 。
 )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
已知:①
 在水溶液中常以
在水溶液中常以 、
、 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。②酸性条件下,
 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成 。
。请回答下列问题:
(1)“煅烧”时,
 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液
 约为7。
约为7。①加热至接近沸腾的目的为
②若持续加热较长时间,可以通过生成
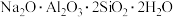 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



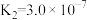
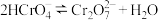
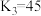
室温下,反应
 的平衡常数
的平衡常数
 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是
您最近一年使用:0次
2021-09-20更新
|
350次组卷
|
3卷引用:广东省茂名市第五中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
4 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此碳的利用、捕集和减排成了研究的重点。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-164.9kJ•mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
将CO2和H2按体积比1∶4混合(n总=5mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应I和反应II。反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。________ v逆(a)(填“>”“=”或“<”)。
②Ru/TiO2催化剂在较低温度主要选择_______ (填“反应I”或“反应II”)。
③350℃~400℃温度区间,CO2转化率呈现减小的变化趋势,其原因是_______ 。
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=_______ L2•mol-2。
(2)合成碳酸二甲酯的工作原理如图所示。_______ ,离子交换膜a为_______ (填“阳膜”、“阴膜”)。
(3)NaBH4在储氢材料、燃料电池等方面具有重要应用,合理使用可以减少碳排放。
①NaBH4中H元素的化合价为-1,具有强还原性。一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH 与Fe2+反应生成纳米铁粉、H2和B(OH)
与Fe2+反应生成纳米铁粉、H2和B(OH) ,参加反应的BH
,参加反应的BH 与生成的纳米铁粉的物质的量之比为
与生成的纳米铁粉的物质的量之比为_______ 。
②NaBH4燃料电池中,NaBH4转化为NaBO2,电解NaBO2溶液又可制得NaBH4,实现物质的循环利用,电解装置示意图如图所示。_______ 。两电极区间使用阳离子交换膜,不允许阴离子通过的原因是_______ 。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-164.9kJ•mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
将CO2和H2按体积比1∶4混合(n总=5mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应I和反应II。反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。

②Ru/TiO2催化剂在较低温度主要选择
③350℃~400℃温度区间,CO2转化率呈现减小的变化趋势,其原因是
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=
(2)合成碳酸二甲酯的工作原理如图所示。

(3)NaBH4在储氢材料、燃料电池等方面具有重要应用,合理使用可以减少碳排放。
①NaBH4中H元素的化合价为-1,具有强还原性。一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH
 与Fe2+反应生成纳米铁粉、H2和B(OH)
与Fe2+反应生成纳米铁粉、H2和B(OH) ,参加反应的BH
,参加反应的BH 与生成的纳米铁粉的物质的量之比为
与生成的纳米铁粉的物质的量之比为②NaBH4燃料电池中,NaBH4转化为NaBO2,电解NaBO2溶液又可制得NaBH4,实现物质的循环利用,电解装置示意图如图所示。

您最近一年使用:0次
名校
解题方法
5 . Ⅰ、O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g) △H1 ②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) △H3 总反应△H=
I2(aq)+H2O(l) △H3 总反应△H=______ 。
Ⅱ、用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用: H2O2+I-=H2O+IO-; H2O2+IO-=H2O+O2↑+I-。
总反应的化学方程式是__________ 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,

②无KI加入。下列判断正确的是___________ (填字母)。
a 加入KI后改变了反应的路径
b 加入KI后改变了总反应的能量变化
c H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到_____ ,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii.________ 。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是______ 。
(4)资料4:I-(aq)+I2(aq) I
I (aq) K=640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
(aq) K=640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
①a=______ 。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________ 。
①I-(aq)+O3(g)=IO-(aq)+O2(g) △H1 ②IO-(aq)+H+(aq)
 HOI(aq) △H2
HOI(aq) △H2③HOI(aq)+I-(aq)+H+(aq)
 I2(aq)+H2O(l) △H3 总反应△H=
I2(aq)+H2O(l) △H3 总反应△H=Ⅱ、用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用: H2O2+I-=H2O+IO-; H2O2+IO-=H2O+O2↑+I-。
总反应的化学方程式是
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,

②无KI加入。下列判断正确的是
a 加入KI后改变了反应的路径
b 加入KI后改变了总反应的能量变化
c H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii.
(4)资料4:I-(aq)+I2(aq)
 I
I (aq) K=640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
(aq) K=640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:| 微粒 | I- | I2 | I3- |
| 浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
6 . 工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
请回答下列问题:
(1)判断反应①是_____ (填“吸热”或“放热”)反应。
(2)据反应①与反应②可推导出K1、K2与K3之间的关系,则K3=_____ (用K1、K2表示)。
(3)某温度下反应①式中各物质的平衡浓度符合下式:20c(CH3OH)=3c(CO)×c2(H2),试判断此温度为_____ 。
(4)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.4mol/L、1mol/L、0.5mol/L、0.4mol/L,则此时v(正)_____ v(逆)(填“>”、“=”或“<”)。
(5)一定条件下将H2(g)和CO2(g)以体积比3:1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有_____ 。
(6)将甲醇用作燃料电池的燃料,可以大大提高能源的利用率。在碱性电解质溶液中,该电池工作时负极的电极反应式为_____ 。
| 化学反应 | 平衡常数 | 温度 | ||
| 500℃ | 700℃ | 800℃ | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1 | 1.7 | 2.52 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | |||
(1)判断反应①是
(2)据反应①与反应②可推导出K1、K2与K3之间的关系,则K3=
(3)某温度下反应①式中各物质的平衡浓度符合下式:20c(CH3OH)=3c(CO)×c2(H2),试判断此温度为
(4)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.4mol/L、1mol/L、0.5mol/L、0.4mol/L,则此时v(正)
(5)一定条件下将H2(g)和CO2(g)以体积比3:1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有
| A.体系密度保持不变 |
| B.H2和CO2的体积比保持不变 |
| C.混合气体的平均相对分子量不变时,反应一定达到平衡状态 |
| D.当CO2中2个碳氧双键断裂,同时H2O中2个氧氢键断裂,反应达到平衡状态 |
您最近一年使用:0次
7 . 重铬酸钾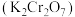 具有强氧化性,在实验室和工业中都有广泛的应用。
具有强氧化性,在实验室和工业中都有广泛的应用。 (黄色)和
(黄色)和 (橙色)在溶液中可相互转化。
(橙色)在溶液中可相互转化。
(1) 中元素铬(Cr)的化合价为
中元素铬(Cr)的化合价为_______ 。
(2)室温下,初始浓度为 的
的 溶液中
溶液中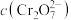 随
随 的变化如图所示。(忽略溶液体积变化)
的变化如图所示。(忽略溶液体积变化)

①用离子方程式表示 溶液中的转化反应
溶液中的转化反应_______ 。
②计算B点时 的转化率为
的转化率为_______ 。
③根据A点数据,计算上述反应的平衡常数_______ 。
(3)向橙色的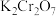 溶液中,滴加
溶液中,滴加 溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_______ ,用平衡移动的原理解释溶液pH变小的原因是_______ 。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定二价铁含量。
用 溶液滴定20.00mL未知浓度的含
溶液滴定20.00mL未知浓度的含 的溶液,恰好完全反应时消耗
的溶液,恰好完全反应时消耗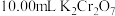 溶液,则溶液中
溶液,则溶液中 的物质的量浓度是
的物质的量浓度是_______ (已知: (未配平)。
(未配平)。
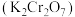 具有强氧化性,在实验室和工业中都有广泛的应用。
具有强氧化性,在实验室和工业中都有广泛的应用。 (黄色)和
(黄色)和 (橙色)在溶液中可相互转化。
(橙色)在溶液中可相互转化。(1)
 中元素铬(Cr)的化合价为
中元素铬(Cr)的化合价为(2)室温下,初始浓度为
 的
的 溶液中
溶液中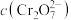 随
随 的变化如图所示。(忽略溶液体积变化)
的变化如图所示。(忽略溶液体积变化)
①用离子方程式表示
 溶液中的转化反应
溶液中的转化反应②计算B点时
 的转化率为
的转化率为③根据A点数据,计算上述反应的平衡常数
(3)向橙色的
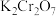 溶液中,滴加
溶液中,滴加 溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是(4)用重铬酸钾法(一种氧化还原滴定法)可测定二价铁含量。
用
 溶液滴定20.00mL未知浓度的含
溶液滴定20.00mL未知浓度的含 的溶液,恰好完全反应时消耗
的溶液,恰好完全反应时消耗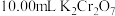 溶液,则溶液中
溶液,则溶液中 的物质的量浓度是
的物质的量浓度是 (未配平)。
(未配平)。
您最近一年使用:0次
2022-11-16更新
|
58次组卷
|
2卷引用:山西高中教育发展联盟2022-2023学年高二上学期11月份期中检测化学试题
8 . Ⅰ.天然气开采过程会产生大量含硫废水(硫元素的主要存在形式为 ),可采用
),可采用 氧化法对其进行处理。
氧化法对其进行处理。
(1)下列事实中,能够比较氢硫酸与亚硫酸的酸性强弱的是___________(填标号)。
Ⅱ.已知:氧化还原反应可拆分为氧化、还原两个半反应,电极电势分别表示为 和
和 ,电势差
,电势差 。如
。如 的
的 。两组电对的电势差越大,反应的自发程度越大。
。两组电对的电势差越大,反应的自发程度越大。
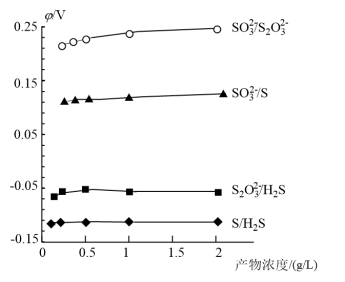
(2)各电对的电极电势与产物浓度的关系如图1所示,将体系中自发程度最大的反应记为ⅰ,反应ⅰ的离子方程式为___________ 。各微粒的相对能量如下表:
已知反应ⅰ为放热反应,当有 发生反应ⅰ时,释放的能量为
发生反应ⅰ时,释放的能量为___________  。(用含字母的代数式表示)
。(用含字母的代数式表示)
(3) 时,向浓度为
时,向浓度为 的
的 溶液中加入一定量
溶液中加入一定量 固体,在不同
固体,在不同 下的
下的 去除率随时间变化如图所示。
去除率随时间变化如图所示。
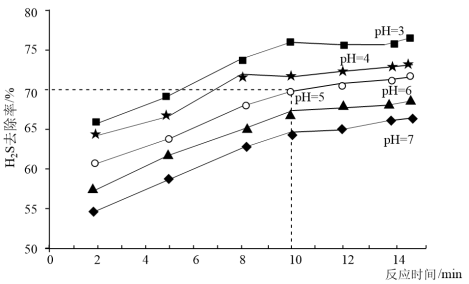
①实际生产中采取 的去除条件,而不选择更低
的去除条件,而不选择更低 的原因为
的原因为___________ 。
② 时,前
时,前 的去除速率
的去除速率
___________  ;实际生产中反应时间选择
;实际生产中反应时间选择 而不是更长,其原因为
而不是更长,其原因为___________ 。
(4)已知反应过程中还会发生如下两个反应(均未配平):
ⅱ.
ⅲ
实验测得,在 、
、 时,
时, 的投加量对平衡体系中部分微粒浓度的影响如图所示。
的投加量对平衡体系中部分微粒浓度的影响如图所示。
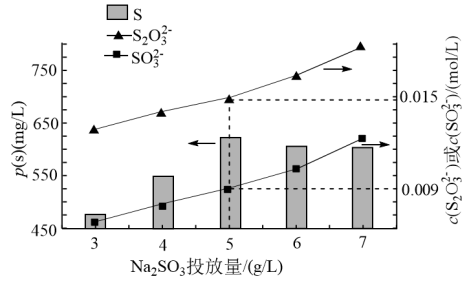
① 时,反应ⅲ的平衡常数
时,反应ⅲ的平衡常数
___________ 。
②结合反应ⅰ、ⅱ、ⅲ分析,当 投加量高于
投加量高于 时,单位体积内S的质量减小的原因为
时,单位体积内S的质量减小的原因为___________ 。
 ),可采用
),可采用 氧化法对其进行处理。
氧化法对其进行处理。(1)下列事实中,能够比较氢硫酸与亚硫酸的酸性强弱的是___________(填标号)。
| A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B.氢硫酸的导电能力低于亚硫酸 |
C.常温下, 的氢硫酸和亚硫酸的 的氢硫酸和亚硫酸的 分别为4.5和2.1 分别为4.5和2.1 |
| D.氢硫酸的还原性强于亚硫酸 |
Ⅱ.已知:氧化还原反应可拆分为氧化、还原两个半反应,电极电势分别表示为
 和
和 ,电势差
,电势差 。如
。如 的
的 。两组电对的电势差越大,反应的自发程度越大。
。两组电对的电势差越大,反应的自发程度越大。(2)各电对的电极电势与产物浓度的关系如图1所示,将体系中自发程度最大的反应记为ⅰ,反应ⅰ的离子方程式为
 |  | 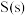 | 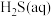 |  | 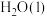 | |
相对能量 | a | b | 0 | c | d | e |
 发生反应ⅰ时,释放的能量为
发生反应ⅰ时,释放的能量为 。(用含字母的代数式表示)
。(用含字母的代数式表示) 
(3)
 时,向浓度为
时,向浓度为 的
的 溶液中加入一定量
溶液中加入一定量 固体,在不同
固体,在不同 下的
下的 去除率随时间变化如图所示。
去除率随时间变化如图所示。
①实际生产中采取
 的去除条件,而不选择更低
的去除条件,而不选择更低 的原因为
的原因为②
 时,前
时,前 的去除速率
的去除速率
 ;实际生产中反应时间选择
;实际生产中反应时间选择 而不是更长,其原因为
而不是更长,其原因为(4)已知反应过程中还会发生如下两个反应(均未配平):
ⅱ.

ⅲ

实验测得,在
 、
、 时,
时, 的投加量对平衡体系中部分微粒浓度的影响如图所示。
的投加量对平衡体系中部分微粒浓度的影响如图所示。
①
 时,反应ⅲ的平衡常数
时,反应ⅲ的平衡常数
②结合反应ⅰ、ⅱ、ⅲ分析,当
 投加量高于
投加量高于 时,单位体积内S的质量减小的原因为
时,单位体积内S的质量减小的原因为
您最近一年使用:0次
2021-12-03更新
|
1084次组卷
|
5卷引用:江苏省苏州实验中学2021-2022学年高二下学期期中考试化学试题
江苏省苏州实验中学2021-2022学年高二下学期期中考试化学试题河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题河北省石家庄市2022届高三上学期教学质量检测(一)化学试题山东省济南市外国语学校2022届高三12月月考化学试题(已下线)【直击双一流】01-备战2022年高考化学名校进阶模拟卷(通用版)
9 . 回答下列问题:
I.页岩气的主要成分为 ,还含有少量的
,还含有少量的 等气体,工业上可采用下列方法除去其中的
等气体,工业上可采用下列方法除去其中的 。
。
(1) 和
和 重整可制得合成气(CO、
重整可制得合成气(CO、 )。已知下列热化学反应方程式:
)。已知下列热化学反应方程式:
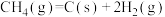 ;
;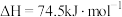
 ;
;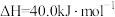
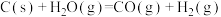 ;
;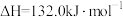
反应 的
的
___________  。
。
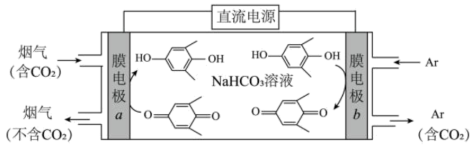
(2)利用电解转化法从烟气中分离 的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:
的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:___________ 。
Ⅱ. 是实验室中常用试剂,也是工业原料。
是实验室中常用试剂,也是工业原料。
(3)工业上常用纯碱法富集从海水中提取的溴。第一步,用纯碱溶液吸收空气吹出的溴蒸气,生成NaBr和 ,第二步,向吸收液中加入稀硫酸生成
,第二步,向吸收液中加入稀硫酸生成 。第二步的离子方程式为
。第二步的离子方程式为___________ 。
(4)利用溴化铜制备溴: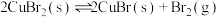 。在密闭容器中加入足量的
。在密闭容器中加入足量的 固体,发生上述反应。在温度为T℃时达到平衡,测得
固体,发生上述反应。在温度为T℃时达到平衡,测得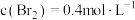 。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。
。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。
①在下图所示的坐标系中补充4min~10min之间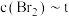 关系曲线
关系曲线___________ 。
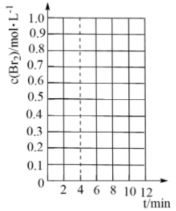
②下列固体物质的物理量不变时,能表示该反应已达到平衡状态的是___________ (填字母)。
a.总质量 b.总物质的量 c.平均摩尔质量
(5)已知:拟卤素,如 、
、 等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
①由此推知, 、
、 、
、 的氧化性强弱排序为
的氧化性强弱排序为___________ 。写出B试管中发生反应的离子方程式:___________ 。
②向含淀粉的KI溶液中滴加 溶液,可观察到现象是
溶液,可观察到现象是___________ 。
(6)T℃时,HBr(g)催化氧化反应为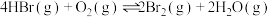 。在体积为VL的恒容密闭容器中充入4molHBr(g)和
。在体积为VL的恒容密闭容器中充入4molHBr(g)和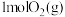 ,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=
,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=___________ 。
I.页岩气的主要成分为
 ,还含有少量的
,还含有少量的 等气体,工业上可采用下列方法除去其中的
等气体,工业上可采用下列方法除去其中的 。
。(1)
 和
和 重整可制得合成气(CO、
重整可制得合成气(CO、 )。已知下列热化学反应方程式:
)。已知下列热化学反应方程式: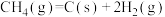 ;
;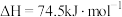
 ;
;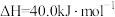
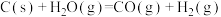 ;
;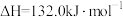
反应
 的
的
 。
。(2)利用电解转化法从烟气中分离
 的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:
的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:
Ⅱ.
 是实验室中常用试剂,也是工业原料。
是实验室中常用试剂,也是工业原料。(3)工业上常用纯碱法富集从海水中提取的溴。第一步,用纯碱溶液吸收空气吹出的溴蒸气,生成NaBr和
 ,第二步,向吸收液中加入稀硫酸生成
,第二步,向吸收液中加入稀硫酸生成 。第二步的离子方程式为
。第二步的离子方程式为(4)利用溴化铜制备溴:
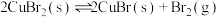 。在密闭容器中加入足量的
。在密闭容器中加入足量的 固体,发生上述反应。在温度为T℃时达到平衡,测得
固体,发生上述反应。在温度为T℃时达到平衡,测得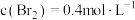 。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。
。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。①在下图所示的坐标系中补充4min~10min之间
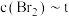 关系曲线
关系曲线
②下列固体物质的物理量不变时,能表示该反应已达到平衡状态的是
a.总质量 b.总物质的量 c.平均摩尔质量
(5)已知:拟卤素,如
 、
、 等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。①由此推知,
 、
、 、
、 的氧化性强弱排序为
的氧化性强弱排序为②向含淀粉的KI溶液中滴加
 溶液,可观察到现象是
溶液,可观察到现象是(6)T℃时,HBr(g)催化氧化反应为
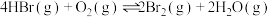 。在体积为VL的恒容密闭容器中充入4molHBr(g)和
。在体积为VL的恒容密闭容器中充入4molHBr(g)和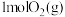 ,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=
,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=
您最近一年使用:0次
10 . 氯及其化合物在工业生产中具有很重要的作用。
(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:_______ 。要想得到纯净干燥的氯气,一般先通入饱和的食盐水,然后再通入浓硫酸中。饱和食盐水的作用:①_______ ②降低氯气在水中的溶解度。试通过平衡移动的原理分析饱和食盐水降低氯气在水中的溶解度。原因是:_______ 。
(2)氯的化合物 在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量
在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量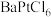 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、
、 和
和 ,T℃时平衡常数
,T℃时平衡常数 。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
_______ kPa,反应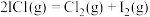 的平衡常数
的平衡常数
_______ 。
(3)氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:
①次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数 [
[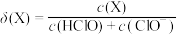 ,X为
,X为 或
或 与pH的关系如图所示。
与pH的关系如图所示。 的电离常数
的电离常数 值为
值为_______ 。

② 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,生成
溶液。上述过程中,生成 的反应属于歧化反应,每生成1mol
的反应属于歧化反应,每生成1mol 消耗
消耗 的量为
的量为_______ mol;产生“气泡”的化学方程式为_______ 。
③84消毒液的主要成分为 和
和 。已知25℃时,下列酸的电离平衡常数如下:
。已知25℃时,下列酸的电离平衡常数如下:
写出少量的 通入84消毒液中的离子方程式:
通入84消毒液中的离子方程式:_______ 。
④二氯异氰尿酸钠是一种常用的消毒剂,具有很强的氧化性,对各种致病性微生物如病毒、细菌芽孢、真菌等有很强的杀生作用,是一种适用范围广,高效的杀菌剂,二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。
已知:实验检测原理为:
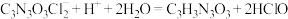



准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量 溶液,密封在暗处静置5min;用
溶液,密封在暗处静置5min;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
滴定终点的现象是:_______ ,该样品有效氯=_______ 。
(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:
(2)氯的化合物
 在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量
在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量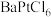 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、
、 和
和 ,T℃时平衡常数
,T℃时平衡常数 。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则
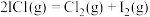 的平衡常数
的平衡常数
(3)氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:
①次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数
 [
[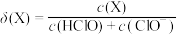 ,X为
,X为 或
或 与pH的关系如图所示。
与pH的关系如图所示。 的电离常数
的电离常数 值为
值为
②
 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,生成
溶液。上述过程中,生成 的反应属于歧化反应,每生成1mol
的反应属于歧化反应,每生成1mol 消耗
消耗 的量为
的量为③84消毒液的主要成分为
 和
和 。已知25℃时,下列酸的电离平衡常数如下:
。已知25℃时,下列酸的电离平衡常数如下:| 化学式 |  |  |  |
| 电离平衡常数 |  |   |  |
 通入84消毒液中的离子方程式:
通入84消毒液中的离子方程式:④二氯异氰尿酸钠是一种常用的消毒剂,具有很强的氧化性,对各种致病性微生物如病毒、细菌芽孢、真菌等有很强的杀生作用,是一种适用范围广,高效的杀菌剂,二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。
已知:实验检测原理为:
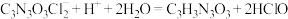



准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量
 溶液,密封在暗处静置5min;用
溶液,密封在暗处静置5min;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。滴定终点的现象是:
您最近一年使用:0次
2022-04-16更新
|
167次组卷
|
2卷引用:安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题



