1 . 下列表述中正确的是
| A.在恒压下,凡是自发的过程一定是放热的 |
| B.因为焓是状态函数,而恒压反应的焓变等于恒压反应热,所以热也是状态函数 |
C.单质的 和 和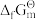 都为零 都为零 |
| D.在恒温恒压条件下,封闭体系自由能减少的过程是自发过程 |
您最近一年使用:0次
2021-08-13更新
|
252次组卷
|
2卷引用:第30届( 2016年)全国中学生化学竞赛(安徽赛区)初赛试题
2 . 氮气是空气的重要组成气体,氮气的综合利用在农业和国防中有着重要意义。
(1)合成氨从实验室研究到实现工业生产,大约经历了150 年。
①写出工业合成氨的化学方程式___________
②已知该反应的ΔH= -92.4 kJ/mol, ΔS (T =298K) =- 198.76 J·mol -1·K-1,试判断室温(即298K) 下,合成氨的反应能否自发进行?___________ (填“能”或“否”)
(2) NH3和CO2在120 °C,催化剂作用下可以合成尿素。
①写出该反应的化学方程式___________
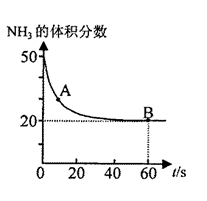
②混合气体中NH3 的含量变化关系如图所示(该条件下尿素为固体)。则A点的正反应速率v正 (CO2)___________ B点的逆反应速率为v逆(CO2) (填“大于”、“小于”或“等于”),NH3的平衡转化率为___________
(3) NH3可用工业上生产硝酸,其尾气中的NO2可用氨水吸收生成NH4NO3.25 °C时,将a mol NH4NO3溶于水,溶液显酸性,其原因是___________ (用离子方程式表示)向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将___________ (填 “正向”、“不”或“逆向”移动,所滴加氨水的浓度为___________ mol·L-1(25 °C时,NH3·H2O 的电离平衡常数取Kb= 2 ×10-5 mol·L-1)
(1)合成氨从实验室研究到实现工业生产,大约经历了150 年。
①写出工业合成氨的化学方程式
②已知该反应的ΔH= -92.4 kJ/mol, ΔS (T =298K) =- 198.76 J·mol -1·K-1,试判断室温(即298K) 下,合成氨的反应能否自发进行?
(2) NH3和CO2在120 °C,催化剂作用下可以合成尿素。
①写出该反应的化学方程式
②混合气体中NH3 的含量变化关系如图所示(该条件下尿素为固体)。则A点的正反应速率v正 (CO2)

(3) NH3可用工业上生产硝酸,其尾气中的NO2可用氨水吸收生成NH4NO3.25 °C时,将a mol NH4NO3溶于水,溶液显酸性,其原因是
您最近一年使用:0次
解题方法
3 . 潮湿的碳酸银在110°C用空气进行干燥。已知气体常数R=8.314J·mol-1·K-1。在25°C和100kPa下相关的热力学数据列表如下
(1)通过计算说明,如果避免碳酸银分解为氧化银和二氧化碳,则空气中CO2的分压至少应为_______ ?设反应的焓变与熵变不随温度变化。
(2)若反应系统中二氧化碳处于标态,判断此条件下上述分解反应的自发性_______ (填写对应的字母),并给出原因_______ 。
A.不自发 B.达平衡 C.自发
(3)如降低干燥的温度,则上述反应的标准平衡常数如何变化_______ (填写对应的字母),并给出原因_______
A.不变化 B.减小 C.增大
| Ag2CO3(s) | Ag2O(s) | CO2(g) | |
 /kJ·mol-1 /kJ·mol-1 | -501.66 | -29.08 | -393.45 |
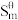 J·mol-1·K-1 J·mol-1·K-1 | 167.4 | 121.8 | 213.8 |
(2)若反应系统中二氧化碳处于标态,判断此条件下上述分解反应的自发性
A.不自发 B.达平衡 C.自发
(3)如降低干燥的温度,则上述反应的标准平衡常数如何变化
A.不变化 B.减小 C.增大
您最近一年使用:0次
4 . 下列说法不正确的是
| A.放热反应总是自发的,吸热反应总是非自发的 |
| B.冰的密度小于水,是因为冰中水分子的氢键降低了水分子的空间利用率 |
| C.石墨比金刚石稳定,从理论上说,石墨合成金刚石需要高温高压条件 |
| D.已知Ksp(MgCO3)=6.8×10-6,则在碳酸镁饱和溶液中,c(Mg2+)约为10-3mol·L-1量级 |
您最近一年使用:0次
名校
5 . 下列有关说法不正确的是( )
| A.铅蓄电池放电时的负极和正极的质量均增加 |
| B.CaCO3(s)=CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H>0 |
C.对于发应2H2O2 2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| D.H2O与金属Na反应生成1molH2,反应中转移的电子数为6.02×1023 |
您最近一年使用:0次
2020-05-17更新
|
152次组卷
|
3卷引用:甘肃省武威第七中学2021-2022学年高二下学期学科竞赛化学试题
19-20高二·浙江·期末
解题方法
6 . 甲醇是一种重要的化工原料,在生产中有着重要的应用。
(一) 和
和 可用于制备甲醇(
可用于制备甲醇( ),已知:
),已知:
反应Ⅰ: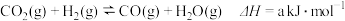
反应Ⅱ:
反应Ⅲ: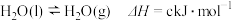
(1)则反应 的
的
___________ ,已知该反应能自发,则该反应在_____ (填“高温”、“低温”或“任何温度”)能自发进行。
(2)某温度下,将 和
和 以体积比1:1置于固定体积的密闭容器中,假设仅发生反应Ⅰ,其平衡常数为1.0,则该反应达到平衡时
以体积比1:1置于固定体积的密闭容器中,假设仅发生反应Ⅰ,其平衡常数为1.0,则该反应达到平衡时 的体积分数为
的体积分数为____________ 。
(二)工业上也可用天然气先制备合成气,反应Ⅳ: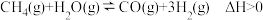 ,再合成甲醇。图1为在一定压强下,
,再合成甲醇。图1为在一定压强下,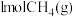 和
和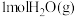 在三种不同催化剂作用下发生反应Ⅳ,经历相同时间时,
在三种不同催化剂作用下发生反应Ⅳ,经历相同时间时, 的物质的量(n)随温度变化的关系。
的物质的量(n)随温度变化的关系。
(3)下列说法正确的是_____________ 。
A.在相同条件下,三种催化剂1、2、3的催化效率由高到低的顺序是
B.温度低于700℃时,曲线②上的点有可能已经到达平衡
C.500℃时,不同催化剂(1、2、3)作用下到达平衡时的 的物质的量相同
的物质的量相同
D.若温度高于700℃时, 的物质的量保持不变
的物质的量保持不变
(4)曲线③中 的物质的量随温度变化的原因可能是
的物质的量随温度变化的原因可能是_______________ 。
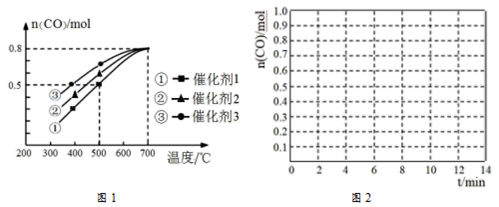
(5)500℃时,反应Ⅳ在催化剂1的作用下10min时达到平衡,请在图2中画出0至12min内 的物质的量的变化图
的物质的量的变化图_______________ 。
(一)
 和
和 可用于制备甲醇(
可用于制备甲醇( ),已知:
),已知:反应Ⅰ:
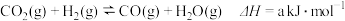
反应Ⅱ:

反应Ⅲ:
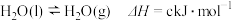
(1)则反应
 的
的
(2)某温度下,将
 和
和 以体积比1:1置于固定体积的密闭容器中,假设仅发生反应Ⅰ,其平衡常数为1.0,则该反应达到平衡时
以体积比1:1置于固定体积的密闭容器中,假设仅发生反应Ⅰ,其平衡常数为1.0,则该反应达到平衡时 的体积分数为
的体积分数为(二)工业上也可用天然气先制备合成气,反应Ⅳ:
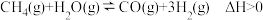 ,再合成甲醇。图1为在一定压强下,
,再合成甲醇。图1为在一定压强下,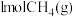 和
和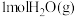 在三种不同催化剂作用下发生反应Ⅳ,经历相同时间时,
在三种不同催化剂作用下发生反应Ⅳ,经历相同时间时, 的物质的量(n)随温度变化的关系。
的物质的量(n)随温度变化的关系。(3)下列说法正确的是
A.在相同条件下,三种催化剂1、2、3的催化效率由高到低的顺序是

B.温度低于700℃时,曲线②上的点有可能已经到达平衡
C.500℃时,不同催化剂(1、2、3)作用下到达平衡时的
 的物质的量相同
的物质的量相同D.若温度高于700℃时,
 的物质的量保持不变
的物质的量保持不变(4)曲线③中
 的物质的量随温度变化的原因可能是
的物质的量随温度变化的原因可能是
(5)500℃时,反应Ⅳ在催化剂1的作用下10min时达到平衡,请在图2中画出0至12min内
 的物质的量的变化图
的物质的量的变化图
您最近一年使用:0次
2020-02-27更新
|
128次组卷
|
3卷引用:浙江省磐安县第二中学2021-2022学年高二10月份竞赛化学试题
名校
7 . 下列反应均可在室温下自发进行,其中△H>0,△S>0的是
| A.4Fe(s)+3O2(g)=2Fe2O3(s) |
| B.NH3(g)+HCl(g)=NH4Cl(s) |
| C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) |
| D.2Cu(s)+CO2(g)+O2(g)+H2O(g)=Cu2(OH)2CO3(s) |
您最近一年使用:0次
2019-07-06更新
|
284次组卷
|
5卷引用:广东省汕头市潮阳区河溪中学2022-2023学年高二上学期化学竞赛试题
广东省汕头市潮阳区河溪中学2022-2023学年高二上学期化学竞赛试题江苏省盐城市2018-2019学年高二下学期期末考试化学试题(已下线)2.4+化学反应进行的方向-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题安徽省亳州市第五完全中学2021-2022学年高二上学期期中考试化学试题
8 . 下列反应在常温下均为非自发反应,则在高温下仍为非自发的是
| A.2CO(g)=2 C(s)+ O2(g) |
| B.2CuO(s)=Cu2O(s)+1/2O2(g) |
| C.MgCO3(s)=MgO(s)+CO2 (g) |
| D.SnO2(s)+C(s)=Sn(s)+CO2 (g) |
您最近一年使用:0次
2016-12-09更新
|
123次组卷
|
2卷引用:甘肃省古浪县第二中学2019-2020学年高二12月基础知识竞赛化学试题
9 . 下列说法正确的是
| A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0 |
B.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除 |
您最近一年使用:0次
2016-12-09更新
|
218次组卷
|
2卷引用:第29届全国高中学生化学奥林匹克竞赛(江苏赛区)初赛试题
解题方法
10 . 下列有关说法正确的是
| A.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大 2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大 |
| D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0 |
您最近一年使用:0次
2016-12-09更新
|
242次组卷
|
2卷引用:第29届(2015年)中国化学奥林匹克竞赛浙江省预赛试题



