23-24高二·全国·假期作业
1 . 填空。
(1)(2023·湖北宜昌市协作体高二上学期期中)甲烷是重要的气体燃料和化工原料,由CH4制取合成气(CO、H2)的反应原理为CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0。当体系温度等于TK时ΔH−TΔS=0,温度大于T时ΔH−TΔS___________ (填“>”“<”或“=”)0。
(2)(2023·四川内江市高二上学期期末)反应I(2NH3(g)+CO2(g)⇌H2NCOONH4 ΔH1<0)在___________ (填“高温”、“低温”或“任何温度”)下能自发进行。
(3)(2023·新疆生产建设兵团部分名校高二上学期期中)已知:H2(g)+C2H4(g)⇌C2H6(g) ΔH=-137kJ·mol-1。该反应在___________ (填“低温”、“高温”或“任何温度”)下能自发进行。
(1)(2023·湖北宜昌市协作体高二上学期期中)甲烷是重要的气体燃料和化工原料,由CH4制取合成气(CO、H2)的反应原理为CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0。当体系温度等于TK时ΔH−TΔS=0,温度大于T时ΔH−TΔS
(2)(2023·四川内江市高二上学期期末)反应I(2NH3(g)+CO2(g)⇌H2NCOONH4 ΔH1<0)在
(3)(2023·新疆生产建设兵团部分名校高二上学期期中)已知:H2(g)+C2H4(g)⇌C2H6(g) ΔH=-137kJ·mol-1。该反应在
您最近一年使用:0次
解题方法
2 . 已知下列热化学方程式
①Ag+(aq)+Cl-(aq)= AgCl(s) ΔH=-51.1 kJ·mol-1
②2Mg(s)+O2(g)= 2MgO(s) ΔH=-1 203.2 kJ·mol-1
③K(s)+H2O(l)= K+(aq)+OH-(aq)+ H2(g) ΔH=-196.6 kJ·mol-1
H2(g) ΔH=-196.6 kJ·mol-1
(1)根据所学知识和生活经验,分析判断在常温下是否能自发进行,这些反应过程的焓变和熵变是否有利于反应自发进行?将其答案填入下表:
(2)由上表可知,要正确判断一个化学反应是否能自发进行的依据是___________ 。
①Ag+(aq)+Cl-(aq)= AgCl(s) ΔH=-51.1 kJ·mol-1
②2Mg(s)+O2(g)= 2MgO(s) ΔH=-1 203.2 kJ·mol-1
③K(s)+H2O(l)= K+(aq)+OH-(aq)+
 H2(g) ΔH=-196.6 kJ·mol-1
H2(g) ΔH=-196.6 kJ·mol-1(1)根据所学知识和生活经验,分析判断在常温下是否能自发进行,这些反应过程的焓变和熵变是否有利于反应自发进行?将其答案填入下表:
| 反应 | 方向性 | 焓变 | 熵变 |
| ①AgNO3溶液与NaCl溶液反应 | |||
| ②镁条置于空气中被氧化 | |||
| ③钾与水反应 |
您最近一年使用:0次
3 . 化学反应的自发性的判断依据
在恒温、恒压,非体积功为0的情况下,综合考虑焓变和熵变,可以判断反应能否自发进行。
在恒温、恒压,非体积功为0的情况下,综合考虑焓变和熵变,可以判断反应能否自发进行。
| 焓变ΔH | 熵变ΔS | ΔH-TΔS的值 | 反应能否自发进行 |
| <0 | >0 | <0 | |
| >0 | <0 | >0 | |
| <0 | <0 | 低温时<0 | |
| >0 | >0 | 高温时<0 |
您最近一年使用:0次
4 . 熵变与反应的自发性的关系
(1)熵的概念
自发过程的体系趋向于由___________ 转变为___________ ,体系的混乱度___________ 。
体系的混乱度常用熵来描述,熵的概念是衡量一个体系___________ 的物理量,其符号为S。熵值越大,体系的___________ 越大。
(2)影响熵大小的因素
①同一条件下,不同的物质熵值___________ 。
②同一物质的熵与其聚集状态及外界条件有关,如对同一种物质不同状态时熵值大小为S(g)___________ S(l) ___________ S(s)。
(3)熵判据
在与外界隔离的体系中,自发过程将导致体系的熵___________ ,这个原理叫做熵增原理。在用熵变来判断过程的方向时,就称为熵判据。
若化学反应为熵增(ΔS>0)反应,反应过程中反应体系的混乱度___________ ,在一定条件下能自发进行。
(4)自发反应与熵变的关系
反应熵变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
(1)熵的概念
自发过程的体系趋向于由
体系的混乱度常用熵来描述,熵的概念是衡量一个体系
(2)影响熵大小的因素
①同一条件下,不同的物质熵值
②同一物质的熵与其聚集状态及外界条件有关,如对同一种物质不同状态时熵值大小为S(g)
(3)熵判据
在与外界隔离的体系中,自发过程将导致体系的熵
若化学反应为熵增(ΔS>0)反应,反应过程中反应体系的混乱度
(4)自发反应与熵变的关系
反应熵变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
您最近一年使用:0次
5 . 焓变与反应的自发性的关系
(1)焓判据:
放热反应(ΔH___________ 0)在反应过程中体系能量___________ ,因此具有自发进行的倾向。
(2)自发反应与焓变的关系
多数自发进行的化学反应是___________ 反应,但也有很多___________ 反应能自发进行,因此,反应焓变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
(1)焓判据:
放热反应(ΔH
(2)自发反应与焓变的关系
多数自发进行的化学反应是
您最近一年使用:0次
6 . 合成氨反应的特点
合成氨反应:N2(g)+3H2(g)⇌2NH3(g)。已知298K时:ΔH=-92.4kJ·mol-1,ΔS=-198.2J·mol-1·K-1。
(1)自发性:常温(298K)下,___________ ,能自发进行。
(2)可逆性:反应为___________ 反应。
(3)体积变化(熵变):ΔS<0,正反应是气体体积___________ 的反应。
(4)焓变:ΔH<0,是___________ 反应。
合成氨反应:N2(g)+3H2(g)⇌2NH3(g)。已知298K时:ΔH=-92.4kJ·mol-1,ΔS=-198.2J·mol-1·K-1。
(1)自发性:常温(298K)下,
(2)可逆性:反应为
(3)体积变化(熵变):ΔS<0,正反应是气体体积
(4)焓变:ΔH<0,是
您最近一年使用:0次
7 . 我国对能源的需求量巨大,其中化石能源占比依然较高,因此发展新型清洁能源意义深远。甲醇汽油是将传统汽油与甲醇混合形成的一种新型燃料,煤可作为甲醇的生产原料。
(1)甲醇的合成可以来源于煤的气化和液化,已知该过程涉及以下反应:
Ⅰ.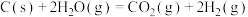

Ⅱ.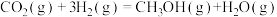

Ⅲ.

Ⅳ.
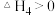

________ 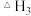 ,反应Ⅱ
,反应Ⅱ
________ 0,反应Ⅳ
________ 0(填序号)。
A.大于 B.小于 C.等于
(2)随着温度的变化,反应的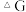 (自由能变化,也在变化,下图中可对应于步骤1的是
(自由能变化,也在变化,下图中可对应于步骤1的是________ 。

(3)汽油的主要成分之一是辛烷[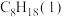 ]。已知:25℃、
]。已知:25℃、 时
时 完全燃烧生成气态二氧化碳和液态水,在该弹式热量计中完全燃烧,可以使得2kg的水升高66K(忽略弹式热量计自身部件吸热)。则
完全燃烧生成气态二氧化碳和液态水,在该弹式热量计中完全燃烧,可以使得2kg的水升高66K(忽略弹式热量计自身部件吸热)。则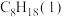 的燃烧热
的燃烧热
______ 。【已知:水的比热容是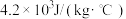 】
】
(1)甲醇的合成可以来源于煤的气化和液化,已知该过程涉及以下反应:
Ⅰ.
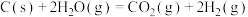

Ⅱ.
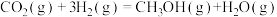

Ⅲ.


Ⅳ.

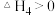

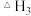 ,反应Ⅱ
,反应Ⅱ

A.大于 B.小于 C.等于
(2)随着温度的变化,反应的
 (自由能变化,也在变化,下图中可对应于步骤1的是
(自由能变化,也在变化,下图中可对应于步骤1的是
(3)汽油的主要成分之一是辛烷[
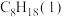 ]。已知:25℃、
]。已知:25℃、 时
时 完全燃烧生成气态二氧化碳和液态水,在该弹式热量计中完全燃烧,可以使得2kg的水升高66K(忽略弹式热量计自身部件吸热)。则
完全燃烧生成气态二氧化碳和液态水,在该弹式热量计中完全燃烧,可以使得2kg的水升高66K(忽略弹式热量计自身部件吸热)。则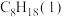 的燃烧热
的燃烧热
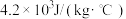 】
】
您最近一年使用:0次
名校
解题方法
8 . 化学反应方向的综合判据是判断反应能否白专进行的关键。由于反应的焓变、熵变随温度的变化较小,假设它们不随温度变化,根据下表数据。
(1)根据表中数据可知:反应①在______ 下(填“高温”、“低温”、“任何温度)正向能自发进行。
(2)有人提出采用适当的催化剂,用热分解法分解CO2,以减少CO2的排放,你认为是否可行?___________ (填“是”或“否”)。阐述判断的理由___________ 。
(3)利用综合判据,计算反应③能正向自发进行的温度范围___________ 。(写出过程)
| 化学反应 | AH/kJ·mol—1 | 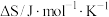 |
①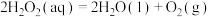 | -98 | 57.2 |
②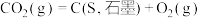 | 393.5 | -2.86 |
③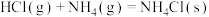 | -176 | -285 |
(2)有人提出采用适当的催化剂,用热分解法分解CO2,以减少CO2的排放,你认为是否可行?
(3)利用综合判据,计算反应③能正向自发进行的温度范围
您最近一年使用:0次
9 . 氢元素的单质及其化合物与人们的日常生活及化工生产息息相关。回答下列问题:
(1)已知氢气与氧气反应生成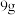 液态水时放出的热量为
液态水时放出的热量为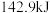 ,生成
,生成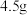 气态水时放出的热量为
气态水时放出的热量为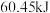 。
。
①写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:__________ 。
②

__________  。
。
(2)利用甲烷将氮的氧化物转化为 和
和 ,有关反应的热化学方程式为:
,有关反应的热化学方程式为:
ⅰ.
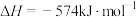 ;
;
ⅱ.
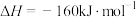
①反应ⅰ中生成物的总键能______ (填“>”“<”或“=”)反应物的总键能,利于该反应自发进行的条件为__________ (填“高温”“低温”或“任意条件”)。
② 直接将
直接将 还原为
还原为 并生成气态水的热化学方程式为
并生成气态水的热化学方程式为__________ 。
(3)在25℃、 下,
下,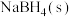 与
与 反应生成
反应生成 和
和 ,已知每消耗
,已知每消耗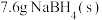 放热
放热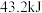 ,该反应的热化学方程式为
,该反应的热化学方程式为__________ 。
(1)已知氢气与氧气反应生成
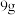 液态水时放出的热量为
液态水时放出的热量为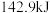 ,生成
,生成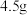 气态水时放出的热量为
气态水时放出的热量为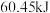 。
。①写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式:②


 。
。(2)利用甲烷将氮的氧化物转化为
 和
和 ,有关反应的热化学方程式为:
,有关反应的热化学方程式为:ⅰ.

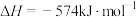 ;
;ⅱ.

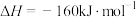
①反应ⅰ中生成物的总键能
②
 直接将
直接将 还原为
还原为 并生成气态水的热化学方程式为
并生成气态水的热化学方程式为(3)在25℃、
 下,
下,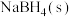 与
与 反应生成
反应生成 和
和 ,已知每消耗
,已知每消耗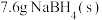 放热
放热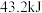 ,该反应的热化学方程式为
,该反应的热化学方程式为
您最近一年使用:0次
2023-05-24更新
|
176次组卷
|
2卷引用:江西省部分学校2023-2024学年高二上学期10月月考化学试题
10 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+172kJ•mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2=-51kJ•mol-1,Kp2=1.2×1012Pa
①对于直接氯化反应:增大压强,平衡______ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率______ (填“变大”“变小”或“不变”)。
②直接氯化的反应趋势远小于碳氯化,其原因是______ 。
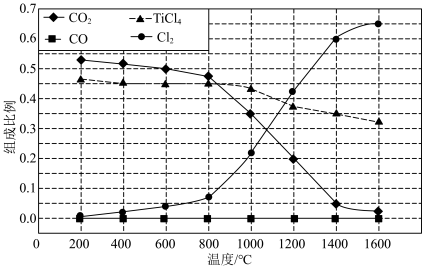
(2)在1.0×105Pa,将TiO2、C、Cl2按物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应 C(s)+
C(s)+ CO2(g)
CO2(g) CO(g)的平衡常数Kp(1400℃)=
CO(g)的平衡常数Kp(1400℃)=______ Pa(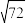 ≈8.5)。
≈8.5)。
②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是______ 。
(3)TiO2直接氯化和碳氯化都属于“气—固”反应,工业生产中有利于“气—固”充分接触的措施是______ 。
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+172kJ•mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2=-51kJ•mol-1,Kp2=1.2×1012Pa
①对于直接氯化反应:增大压强,平衡
②直接氯化的反应趋势远小于碳氯化,其原因是
(2)在1.0×105Pa,将TiO2、C、Cl2按物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①反应
 C(s)+
C(s)+ CO2(g)
CO2(g) CO(g)的平衡常数Kp(1400℃)=
CO(g)的平衡常数Kp(1400℃)=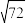 ≈8.5)。
≈8.5)。②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
(3)TiO2直接氯化和碳氯化都属于“气—固”反应,工业生产中有利于“气—固”充分接触的措施是
您最近一年使用:0次



