名校
1 . 利用化学原理研究对废气进行脱硝处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。合理应用和处理氮氧化合物,在生产生活中有着重要的意义。
I.
(1)闪电时空气中的 和
和 会发生反应:
会发生反应: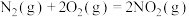
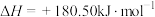 ,
,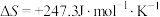 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
II.已知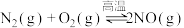 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。
(2)该温度下,向 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是___________ %(保留整数)。
(3)该温度下,某时刻测得容器内 、
、 、
、 的浓度分别为
的浓度分别为 、
、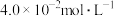 、
、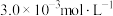 ,此时反应
,此时反应___________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。请说明理由___________ 。
(4)将 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是___________ 。
A.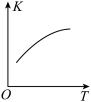 B.
B.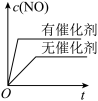 C.
C.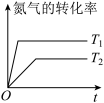
(5)向恒温恒容的密闭容器中充入等物质的量的 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数___________ (填“变大”“变小”或“不变”)。
I.
(1)闪电时空气中的
 和
和 会发生反应:
会发生反应: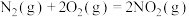
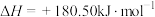 ,
,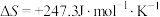 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。| A.在1000℃时,此反应能自发进行 |
| B.在1000℃时,此反应不能自发进行 |
| C.该反应能自发进行的最低温度约为730℃ |
D.该反应能自发进行的最高温度约为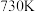 |
II.已知
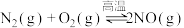 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。(2)该温度下,向
 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是(3)该温度下,某时刻测得容器内
 、
、 、
、 的浓度分别为
的浓度分别为 、
、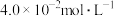 、
、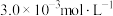 ,此时反应
,此时反应(4)将
 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是A.
 B.
B. C.
C.
(5)向恒温恒容的密闭容器中充入等物质的量的
 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数
您最近一年使用:0次
2023-04-15更新
|
402次组卷
|
3卷引用:上海市卢湾高级中学2022-2023学年高二下学期期中考试(等级考)化学试题
22-23高二上·浙江杭州·期中
2 . 按要求完成下列问题。
(1)汽油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知反应的△H>0,判断该设想能否实现________ (填“能”或“不能”),并简述原因________________ 。
(2)甲烷的烧热△H = - 890.3kJ/mol,写出甲烷的燃烧热的热化学方程式:__________________ 。
(1)汽油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知反应的△H>0,判断该设想能否实现
(2)甲烷的烧热△H = - 890.3kJ/mol,写出甲烷的燃烧热的热化学方程式:
您最近一年使用:0次
23-24高二上·全国·课时练习
3 . 请分析讨论在恒温下,压缩容器的体积,增大压强,下列三个反应浓度商Q的变化和平衡移动的方向,填写下表。
| 化学反应 | Q值变化 | Q与K关系 | 平衡移动方向 |
C(s)+H2O(g) CO(g)+H2(g) CO(g)+H2(g) | |||
N2(g)+3H2(g) 2NH3(g) 2NH3(g) | |||
N2(g)+O2(g) 2NO(g) 2NO(g) |
您最近一年使用:0次
名校
解题方法
4 . 按照要求回答下列问题:
(1)已知:①
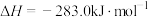
②
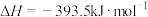
请写出C与 反应生成CO的热化学方程式:
反应生成CO的热化学方程式:_______ 。
(2)已知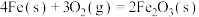
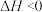 ,该反应的熵如何变化?
,该反应的熵如何变化?_______ (填“增大”、“减小”或“不变”),该反应在什么温度下可以自发进行?_______ (填“低温”、“高温”或“任何温度”)。
(3)盐碱地(含较多 、NaCl)不利于植物生长,盐碱地产生碱性的原因:
、NaCl)不利于植物生长,盐碱地产生碱性的原因:_______ (用离子方程式表示);农业上用石膏降低其碱性的反应原理:_______ (用化学方程式表示)。
(4)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m_______ n(填“>”、“<”或“=”)。
(1)已知:①

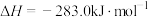
②

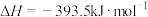
请写出C与
 反应生成CO的热化学方程式:
反应生成CO的热化学方程式:(2)已知
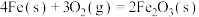
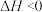 ,该反应的熵如何变化?
,该反应的熵如何变化?(3)盐碱地(含较多
 、NaCl)不利于植物生长,盐碱地产生碱性的原因:
、NaCl)不利于植物生长,盐碱地产生碱性的原因:(4)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m
您最近一年使用:0次
解题方法
5 . 化学反应都伴随着能量的变化。回答下列问题:
(1)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后嫡增的是___________(填字母)。
(2)一种分解海水制氢气的方法为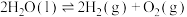 。如图为该反应的能量变化示意图,使用催化剂
。如图为该反应的能量变化示意图,使用催化剂 后,图中A点将
后,图中A点将___________ (填“升高”、“降低”或“不变”)。

(3)已知: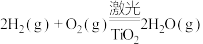
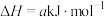
②部分化学键的键能数据如表:
由此计算x=___________ 。(用含a、c、d的代数式表示)
(4)火箭推进器中盛有强还原剂液态肼( )和强氧化剂液态过氧化氢。将16g液态肼和足量
)和强氧化剂液态过氧化氢。将16g液态肼和足量 ,混合完全反应,生成氮气和水蒸气,放出320.9kJ的热量(相当于25℃、101kPa下测得的热量),则该反应的热化学方程式为
,混合完全反应,生成氮气和水蒸气,放出320.9kJ的热量(相当于25℃、101kPa下测得的热量),则该反应的热化学方程式为___________ 。
(1)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后嫡增的是___________(填字母)。
A. | B. |
C. | D.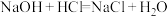 |
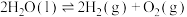 。如图为该反应的能量变化示意图,使用催化剂
。如图为该反应的能量变化示意图,使用催化剂 后,图中A点将
后,图中A点将
(3)已知:
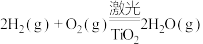
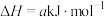
②部分化学键的键能数据如表:
| 化学键 |  |  |  |
 | x | c | d |
(4)火箭推进器中盛有强还原剂液态肼(
 )和强氧化剂液态过氧化氢。将16g液态肼和足量
)和强氧化剂液态过氧化氢。将16g液态肼和足量 ,混合完全反应,生成氮气和水蒸气,放出320.9kJ的热量(相当于25℃、101kPa下测得的热量),则该反应的热化学方程式为
,混合完全反应,生成氮气和水蒸气,放出320.9kJ的热量(相当于25℃、101kPa下测得的热量),则该反应的热化学方程式为
您最近一年使用:0次
解题方法
6 . 甲醇是一种重要的化工原料的具有开发和应用的广阔前景。工业上使用水煤气( CO 与H2的混合气体 )转化成甲醇,反应为CO(g)+2H2(g) CH3OH(g) △H。在体积可变的密闭容器中投入0.5mol CO和1.0 mol H2。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g) △H。在体积可变的密闭容器中投入0.5mol CO和1.0 mol H2。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
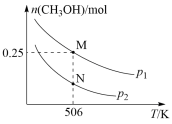
(1)根据图象判断△H_______ 0 (填“<”或“>”);该反应的自发的条件是__________ (填选项)。
a. 高温自发,低温不自发 b. 低温自发,高温不自发
c.高温、低温都自发 d. 高温、低温都不自发
(2)M点H2的转化率为__________ 。若点M对应混合气体的体积为1L,则506K时,该反应平衡常数K=__________ 。
(3)下列叙述能说明上述反应达到化学平衡状态的有__________ (填序号)。
a.v(H2)= 2v(CH3OH) b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.混合气体的平均摩尔质量不在改变
(4)平衡后再加入0. 5mol CO和1.0 mol H2后重新到达平衡,则CO的转化率__________ (填“增大”“不变”或“减小”)。
(5)试判断p1__________ p2(填 “ > ” 、“<” 或 “=”),判断的依据是__________ 。
 CH3OH(g) △H。在体积可变的密闭容器中投入0.5mol CO和1.0 mol H2。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g) △H。在体积可变的密闭容器中投入0.5mol CO和1.0 mol H2。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
(1)根据图象判断△H
a. 高温自发,低温不自发 b. 低温自发,高温不自发
c.高温、低温都自发 d. 高温、低温都不自发
(2)M点H2的转化率为
(3)下列叙述能说明上述反应达到化学平衡状态的有
a.v(H2)= 2v(CH3OH) b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.混合气体的平均摩尔质量不在改变
(4)平衡后再加入0. 5mol CO和1.0 mol H2后重新到达平衡,则CO的转化率
(5)试判断p1
您最近一年使用:0次
名校
解题方法
7 . 能源是现代社会发展的支柱之一,请按要求完成以下填空:
(1)下列反应中,属于放热反应的是_______ (填序号)。
a.Ba(OH)2•8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(2)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_______ 。
(3)实验测得,1g甲醇(CH3OH,常温下为液态)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇摩尔燃烧焓的热化学方程式:_______ 。
(4)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供。反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时放出161kJ的热量。试写出反应过程中的热化学方程式:_______ 。
(5)将 转化为
转化为 是工业冶炼金属钛的主要反应之一。已知:
是工业冶炼金属钛的主要反应之一。已知:

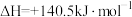
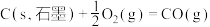
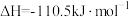
则反应 的
的 是
是_______
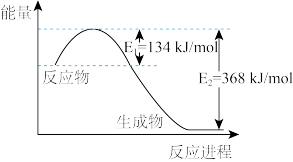
(6)工业上用二氧化碳催化加氢可合成乙醇,过程能量变化如图所示,其反应原理为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) △H。该反应的△H
C2H5OH(g)+3H2O(g) △H。该反应的△H_______ (填“>”、“<”或“=”)0;其正反应在_______ (填“高温”“低温”或“任何温度”)下能自发进行。
(1)下列反应中,属于放热反应的是
a.Ba(OH)2•8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(2)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(3)实验测得,1g甲醇(CH3OH,常温下为液态)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇摩尔燃烧焓的热化学方程式:
(4)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供。反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时放出161kJ的热量。试写出反应过程中的热化学方程式:
(5)将
 转化为
转化为 是工业冶炼金属钛的主要反应之一。已知:
是工业冶炼金属钛的主要反应之一。已知:
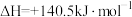
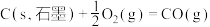
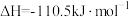
则反应
 的
的 是
是(6)工业上用二氧化碳催化加氢可合成乙醇,过程能量变化如图所示,其反应原理为2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) △H。该反应的△H
C2H5OH(g)+3H2O(g) △H。该反应的△H
您最近一年使用:0次
名校
8 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为: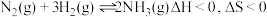 。
。
(1)下列关于工业合成氨的说法正确的是_______。
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______。
(3)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:
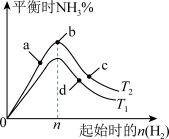
①图像中 和
和 的关系是:
的关系是:
_______  (填“>,<或=”)。
(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是:
的转化率最高的是:_______ 。
③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是_______ 。
(4)恒温下,向一个4L的恒容密闭容器中充入 和
和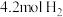 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测
①20min后,反应达平衡,氨气的浓度为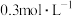 ,用
,用 表示的平均反应速率为
表示的平均反应速率为_______ 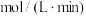 。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
_______ [对于气相反应,用某组分B的平衡压强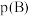 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作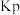 ,如
,如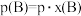 ,p为平衡总压强,
,p为平衡总压强,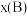 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。
②若维持容器体积不变,温度不变,向原平衡体系中再加入 和
和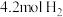 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度_______  (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
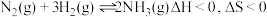 。
。(1)下列关于工业合成氨的说法正确的是_______。
A.因为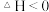 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
B.因为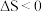 ,所以该反应一定不能自发进行 ,所以该反应一定不能自发进行 |
| C.在高温下进行是为了提高反应物的转化率 |
| D.该反应在低温下能自发进行 |
A.容器内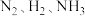 的浓度之比为1∶3∶2 的浓度之比为1∶3∶2 |
B. 百分含量保持不变 百分含量保持不变 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |

①图像中
 和
和 的关系是:
的关系是:
 (填“>,<或=”)。
(填“>,<或=”)。②a、b、c、d四点所处的平衡状态中,反应物
 的转化率最高的是:
的转化率最高的是:③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是
(4)恒温下,向一个4L的恒容密闭容器中充入
 和
和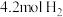 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测①20min后,反应达平衡,氨气的浓度为
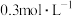 ,用
,用 表示的平均反应速率为
表示的平均反应速率为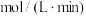 。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
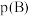 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作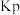 ,如
,如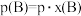 ,p为平衡总压强,
,p为平衡总压强,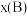 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。②若维持容器体积不变,温度不变,向原平衡体系中再加入
 和
和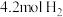 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度 (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
您最近一年使用:0次
2022-12-07更新
|
705次组卷
|
3卷引用:重庆市渝东六校共同体2022-2023学年高二上学期联合诊断考试化学试题
解题方法
9 . 回答下列问题:
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:
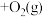 ,该反应的∆H
,该反应的∆H________ (填“>”或“<”,下同)0,∆S_______ 0,在低温下,该反应________ (填“能”或“不能”)自发进行。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为 。反应在常温下能够自发进行,则反应的∆H
。反应在常温下能够自发进行,则反应的∆H______ (填“>”或“<”)0。
(3)已知在 、
、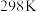 时石灰石分解反应
时石灰石分解反应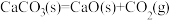 的
的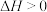 、
、 。常温下,该反应
。常温下,该反应________ (填“能”或“不能”)自发进行。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:

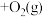 ,该反应的∆H
,该反应的∆H(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为
 。反应在常温下能够自发进行,则反应的∆H
。反应在常温下能够自发进行,则反应的∆H(3)已知在
 、
、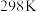 时石灰石分解反应
时石灰石分解反应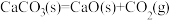 的
的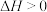 、
、 。常温下,该反应
。常温下,该反应
您最近一年使用:0次
解题方法
10 . 完成下列问题:
(1)用离子方程式表示碳酸钠溶液显碱性的原因:_______ 。
(2)汽油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),判断该设想能否实现,并简述原因:_______ 。
(3)25℃时,在1L0.1mol/L的HA溶液中,有0.001mol的HA电离成离子,则该温度下的电离平衡常数为_______ 。
(4)在25℃时,将pH=11 的Ba(OH)2溶液Va L与 pH=2 的HCl溶液Vb L混合,若所得溶液为中性,则Va :Vb=_______ 。
(5)常温下将10 mL 0.1 mol/L的NaOH溶液与10 mL 0.2 mol/L的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为_______ 。
(6)已知常温下部分弱电解质的电离平衡常数如下表:
常温下,pH相同的三种溶液①NaF溶液;②NaClO溶液;③Na2CO3溶液,其物质的量浓度由大到小的顺序是_______ (填序号)。
(7)已知25℃时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32。则使Cr3+恰好完全沉淀,即溶液中c(Cr3+)=1.0×10-5mol/L时,应调节pH的最小值a为多少_______
(1)用离子方程式表示碳酸钠溶液显碱性的原因:
(2)汽油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),判断该设想能否实现,并简述原因:
(3)25℃时,在1L0.1mol/L的HA溶液中,有0.001mol的HA电离成离子,则该温度下的电离平衡常数为
(4)在25℃时,将pH=11 的Ba(OH)2溶液Va L与 pH=2 的HCl溶液Vb L混合,若所得溶液为中性,则Va :Vb=
(5)常温下将10 mL 0.1 mol/L的NaOH溶液与10 mL 0.2 mol/L的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为
(6)已知常温下部分弱电解质的电离平衡常数如下表:
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
(7)已知25℃时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32。则使Cr3+恰好完全沉淀,即溶液中c(Cr3+)=1.0×10-5mol/L时,应调节pH的最小值a为多少
您最近一年使用:0次



