名校
1 . 按要求回答下列问题。
(1)汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应N2(g)+O2(g)⇌2NO(g)是导致汽车尾气中含有NO的原因之一、已知H2可以催化还原NO达到消除污染的目的。
N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ∙mol-1
2H2(g)+O2(g)⇌2H2O(l) △H=-571.6kJ∙mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___________ ,判断该反应自发进行的条件:___________ 。(填“高温自发”或“低温自发”)
(2)已知H2S为二元弱酸,欲使0.1mol•L-1的H2S溶液中 的比值变大,下列措施可行的是
的比值变大,下列措施可行的是___________
a.加入H2O b.通入少量H2S c.通入少量HCl d.加入少量NaOH固体
(3)有下列物质:①Zn②KAl(SO4)2∙12H2O③Ba(OH)2④乙醇⑤冰醋酸⑥盐酸⑦Cu(NO3)2溶液⑧熔融态AlCl3⑨NH3∙H2O⑩熔融态CH3COONa⑪NaHCO3。其中属于能导电的电解质的是___________ (填编号)属于弱电解质的是___________ (填编号)
(4)若向0.1mol∙L-1的弱碱MOH溶液中逐滴加入0.1mol∙L-1的弱酸HB至恰好反应,溶液的导电性变化规律是___________ (填“逐渐变强”、“逐渐变弱”、“先变强后变弱”、“先变弱后变强”和“几乎不变”)
(1)汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应N2(g)+O2(g)⇌2NO(g)是导致汽车尾气中含有NO的原因之一、已知H2可以催化还原NO达到消除污染的目的。
N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ∙mol-1
2H2(g)+O2(g)⇌2H2O(l) △H=-571.6kJ∙mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
(2)已知H2S为二元弱酸,欲使0.1mol•L-1的H2S溶液中
 的比值变大,下列措施可行的是
的比值变大,下列措施可行的是a.加入H2O b.通入少量H2S c.通入少量HCl d.加入少量NaOH固体
(3)有下列物质:①Zn②KAl(SO4)2∙12H2O③Ba(OH)2④乙醇⑤冰醋酸⑥盐酸⑦Cu(NO3)2溶液⑧熔融态AlCl3⑨NH3∙H2O⑩熔融态CH3COONa⑪NaHCO3。其中属于能导电的电解质的是
(4)若向0.1mol∙L-1的弱碱MOH溶液中逐滴加入0.1mol∙L-1的弱酸HB至恰好反应,溶液的导电性变化规律是
您最近一年使用:0次
名校
解题方法
2 . 二甲醚是一种重要的清洁燃料,工业上可以通过 、合成气(主要成分是一氧化碳和氢气)制得。
、合成气(主要成分是一氧化碳和氢气)制得。
I. 分子间脱水制二甲醚
分子间脱水制二甲醚

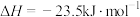 。在
。在 ℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
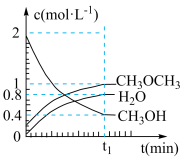
(1) 时刻反应达平衡后,其他条件不变,升高温度,平衡
时刻反应达平衡后,其他条件不变,升高温度,平衡___________ (填“向右”、“向左”或“不发生”)移动, 将
将___________ (填“增大”或“减小”)
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为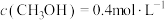 、
、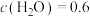
 、
、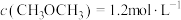 ,此时
,此时
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅱ.合成气制取二甲醚的原理如下:
反应1:
反应2:
(3)500K时,在2L密闭容器中充入4
 和8
和8
 ,4min达到平衡,平衡时
,4min达到平衡,平衡时 的转化率为80%,且
的转化率为80%,且 ,则反应2中
,则反应2中 的转化率
的转化率
___________ ,反应1的平衡常数
___________ (结果需化成最简比)。
 、合成气(主要成分是一氧化碳和氢气)制得。
、合成气(主要成分是一氧化碳和氢气)制得。I.
 分子间脱水制二甲醚
分子间脱水制二甲醚
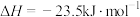 。在
。在 ℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
(1)
 时刻反应达平衡后,其他条件不变,升高温度,平衡
时刻反应达平衡后,其他条件不变,升高温度,平衡 将
将(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为
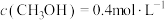 、
、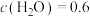
 、
、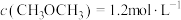 ,此时
,此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。Ⅱ.合成气制取二甲醚的原理如下:
反应1:

反应2:

(3)500K时,在2L密闭容器中充入4

 和8
和8
 ,4min达到平衡,平衡时
,4min达到平衡,平衡时 的转化率为80%,且
的转化率为80%,且 ,则反应2中
,则反应2中 的转化率
的转化率

您最近一年使用:0次
名校
解题方法
3 . 填空。
(1)已知2CO(g)⇌C(s)+CO2(g),T=980K时,ΔH-TΔS=0。当体系温度低于980K时,估计ΔH-TΔS的正负符号为___________ ;当体系温度高于980K时,估计ΔH-TΔS的正负符号为___________ 。在冶金工业中,以C作还原剂,温度高于980K时的氧化产物是以___________ 为主。
(2)在一定温度下的定容容器中,当下列物理量不再发生变化时:
①混合气体的压强
②混合气体的密度
③混合气体的总物质的量
④混合气体的平均相对分子质量
⑤混合气体的颜色
⑥各反应物或生成物的浓度之比等于系数之比
⑦某种气体的百分含量
a.能说明C(s)+H2O(g)⇌CO(g)+H2(g)达到平衡状态的是___________ 。
b.能说明I2(g)+H2(g)⇌2HI(g)达到平衡状态的是___________ 。
(3)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为___________ 。
(1)已知2CO(g)⇌C(s)+CO2(g),T=980K时,ΔH-TΔS=0。当体系温度低于980K时,估计ΔH-TΔS的正负符号为
(2)在一定温度下的定容容器中,当下列物理量不再发生变化时:
①混合气体的压强
②混合气体的密度
③混合气体的总物质的量
④混合气体的平均相对分子质量
⑤混合气体的颜色
⑥各反应物或生成物的浓度之比等于系数之比
⑦某种气体的百分含量
a.能说明C(s)+H2O(g)⇌CO(g)+H2(g)达到平衡状态的是
b.能说明I2(g)+H2(g)⇌2HI(g)达到平衡状态的是
(3)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为
您最近一年使用:0次
名校
解题方法
4 . 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。
(1)已知,该反应ΔS_____ 0(填“<”“>”或“=”)。
(2)在300℃,5 MPa条件下,将0.20 mol的CO与0.58 mol H2的混合气体充入2L密闭容器中发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
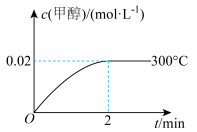
①在0~2min内,以H2表示的平均反应速率为_______ mol·L-1·min-1。
②300℃时该反应的平衡常数K=_______ 。
 CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。(1)已知,该反应ΔS
(2)在300℃,5 MPa条件下,将0.20 mol的CO与0.58 mol H2的混合气体充入2L密闭容器中发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。

①在0~2min内,以H2表示的平均反应速率为
②300℃时该反应的平衡常数K=
您最近一年使用:0次
名校
5 . 乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。
(1)甲醇制备乙烯的主要反应:
i.2CH3OH(g)=C2H4(g)+2H2O(g) ∆H1=−20.9 kJ/mol
ii.3CH3OH(g)=C3H6(g)+3H2O(g) ∆H2=−98.1 kJ/mol
iii.4CH3OH(g)=C4H8(g)+4H2O(g) ∆H3=−118.1 kJ/mol
①C3H6转化为C2H4的热化学方程式iv:2C3H6(g) =3C2H4(g) ∆H4=___________ ,该反应能自发进行的条件是___________ (填“较低”“较高”或“任意”)温度。
②恒温恒压下充入N2,反应i中C2H4的平衡产率将___________ (填“增大”、减小”或“不变”)。
(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用*标注。

上述反应为___________ (填“放热”或“吸热”)反应,历程最小能垒(活化能)为___________ kJ/mol,该步骤的化学方程式为___________ 。
(1)甲醇制备乙烯的主要反应:
i.2CH3OH(g)=C2H4(g)+2H2O(g) ∆H1=−20.9 kJ/mol
ii.3CH3OH(g)=C3H6(g)+3H2O(g) ∆H2=−98.1 kJ/mol
iii.4CH3OH(g)=C4H8(g)+4H2O(g) ∆H3=−118.1 kJ/mol
①C3H6转化为C2H4的热化学方程式iv:2C3H6(g) =3C2H4(g) ∆H4=
②恒温恒压下充入N2,反应i中C2H4的平衡产率将
(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用*标注。

上述反应为
您最近一年使用:0次
名校
6 . 室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:① ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。
。反应体系中组分M、Z的浓度随时间变化情况如图所示。
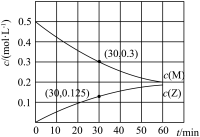
(1) 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为___________ 。
(2)其中,反应①的速率可以表示为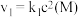 ,反应②的速率可以表示为
,反应②的速率可以表示为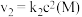 (
( 、
、 为速率常数)。下列说法正确的是___________。
为速率常数)。下列说法正确的是___________。
 ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。
。反应体系中组分M、Z的浓度随时间变化情况如图所示。
(1)
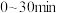 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为(2)其中,反应①的速率可以表示为
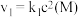 ,反应②的速率可以表示为
,反应②的速率可以表示为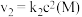 (
( 、
、 为速率常数)。下列说法正确的是___________。
为速率常数)。下列说法正确的是___________。A.反应开始后,系统中 和 和 的浓度之比保持不变 的浓度之比保持不变 |
B.如果反应能进行到底,则反应结束时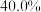 的M能转化为 的M能转化为 |
C.该温度下,两个反应的 与 与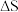 一定都小于0 一定都小于0 |
D.该温度下,两个反应 |
您最近一年使用:0次
名校
7 . 一碳化学是以分子中只含一个碳原子的化合物为原料生产化工产品的方法。合成气( 和
和 的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:
的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:
I:
II: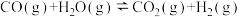
III:
(1)当反应I达到平衡后,下列措施可提高正反应速率的是_______(填标号)。
(2)若在恒温恒容容器中仅发生反应II,则下列能说明反应达到平衡状态的是_______。
(3)向容积为 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应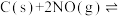
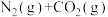 ,
, 和
和 的物质的量变化如下表所示。
的物质的量变化如下表所示。
①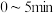 内,以
内,以 表示的该反应速率
表示的该反应速率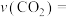
___________ ,最终达平衡时 的转化率
的转化率
___________ ,该温度 ℃下的平衡常数
℃下的平衡常数
___________ 。
②保持温度 ℃不变,向该
℃不变,向该 密闭容器中加入该四种反应混合物各
密闭容器中加入该四种反应混合物各 ,该时刻,正、逆反应速率的大小关系为:
,该时刻,正、逆反应速率的大小关系为: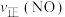
___________ 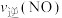 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)已知4CO(g) +2NO2(g) 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行。
 和
和 的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:
的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:I:

II:
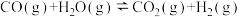
III:

(1)当反应I达到平衡后,下列措施可提高正反应速率的是_______(填标号)。
| A.加入焦炭 | B.通入CO | C.升高温度 | D.分离出氢气 |
| A.容器内气体的压强不变 |
| B.容器内气体的总质量不变 |
| C.容器内气体的平均相对分子质量不变 |
D.单位时间内,每有2 mol 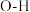 键断裂,同时有1 mol 键断裂,同时有1 mol  键断裂 键断裂 |
 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应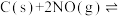
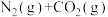 ,
, 和
和 的物质的量变化如下表所示。
的物质的量变化如下表所示。| 条件 | 保持温度为 /℃ /℃ | ||||||
| 时间 | 0 | 5min | 10min | 15min | 20min | 25min | 30min |
 物质的量 物质的量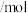 | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
 物质的量 物质的量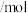 | 0 | 0.3 | 0.50 | 0.65 | 0.75 | 0.80 | 0.80 |
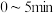 内,以
内,以 表示的该反应速率
表示的该反应速率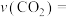
 的转化率
的转化率
 ℃下的平衡常数
℃下的平衡常数
②保持温度
 ℃不变,向该
℃不变,向该 密闭容器中加入该四种反应混合物各
密闭容器中加入该四种反应混合物各 ,该时刻,正、逆反应速率的大小关系为:
,该时刻,正、逆反应速率的大小关系为: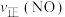
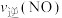 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)已知4CO(g) +2NO2(g)
 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
您最近一年使用:0次
2023-12-14更新
|
178次组卷
|
3卷引用:广西百色市德保高中2023-2024学年高二上学期11月期中考试化学试题
名校
8 . 根据所学知识完成下列问题:
(1)某小组同学用量筒分别量取50mL的0.50mol∙L-1HC1溶液与50mL的0.55mol∙L-1NaOH溶液来测定中和热。
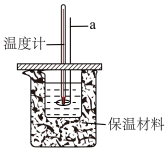
①仪器a是___________ (填名称)。
②近似认为0.55mol/L的NaOH溶液和0.50mol/L的HCl溶液的密度都是1g/mL,中和后生成溶液的比热容c=4.18J∙g-1∙℃-1,并忽略量热计的比热容;测得反应前、后体系的温度值(℃)分别为T0、T1,则所测中和热为△H=___________ kJ·mol-1(用含T0、T1的代数式表示)。
③若量取盐酸时候俯视刻度线,且其他操作无误,最终会使测得的中和热△H___________ (填“不变”、“变大”或“变小”)。
(2)研究氮和硫的氧化物的无害化处理对治理大气污染有着重要意义:
①已知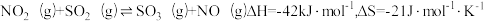 ,该反应能够自发进行的温度条件是
,该反应能够自发进行的温度条件是___________ K。
②将NO2和SO2以物质的量比1:2置于一体积不变的密闭容器中,在绝热条件下发生上述反应,下列不能说明该反应到达平衡状态的是:___________
a.每消耗1molNO2同时生成1molSO3 b.混合气体的颜色保持不变
c.体系的压强保持不变 d.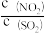 保持不变
保持不变
e.混合气体的平均摩尔质量保持不变
(3)HCN的电子式为___________ 。25℃时,HCN溶液与同浓度同体积的NaOH溶液充分反应后,最终pH为11.9,用离子方程式说明最终溶液虽碱性的原因:___________ 。
(4)阻燃剂Sb2O3(三氧化二铋)一般由SbCl3水解制备。实验室模拟制备过程如下:先将SbC13于一定条件下水解生成SbOC1白色沉淀,这一步的化学方程式为___________ ,再往其中加入少量氨水并搅拌,最终生成Sb2O3。
(1)某小组同学用量筒分别量取50mL的0.50mol∙L-1HC1溶液与50mL的0.55mol∙L-1NaOH溶液来测定中和热。

①仪器a是
②近似认为0.55mol/L的NaOH溶液和0.50mol/L的HCl溶液的密度都是1g/mL,中和后生成溶液的比热容c=4.18J∙g-1∙℃-1,并忽略量热计的比热容;测得反应前、后体系的温度值(℃)分别为T0、T1,则所测中和热为△H=
③若量取盐酸时候俯视刻度线,且其他操作无误,最终会使测得的中和热△H
(2)研究氮和硫的氧化物的无害化处理对治理大气污染有着重要意义:
①已知
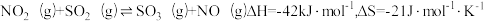 ,该反应能够自发进行的温度条件是
,该反应能够自发进行的温度条件是②将NO2和SO2以物质的量比1:2置于一体积不变的密闭容器中,在绝热条件下发生上述反应,下列不能说明该反应到达平衡状态的是:
a.每消耗1molNO2同时生成1molSO3 b.混合气体的颜色保持不变
c.体系的压强保持不变 d.
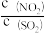 保持不变
保持不变e.混合气体的平均摩尔质量保持不变
(3)HCN的电子式为
(4)阻燃剂Sb2O3(三氧化二铋)一般由SbCl3水解制备。实验室模拟制备过程如下:先将SbC13于一定条件下水解生成SbOC1白色沉淀,这一步的化学方程式为
您最近一年使用:0次
2023-12-13更新
|
143次组卷
|
2卷引用:广东省东莞市东莞中学2023-2024学年高二上学期期中考试化学试题
9 . 在恒温下,向容积为2L的恒容容器中加入一定量的碳单质和2molH2O(g),初始压强为105Pa。发生反应: ∆H>0。经过2min后达到平衡,容器的压强增加了20%。
∆H>0。经过2min后达到平衡,容器的压强增加了20%。
(1)该反应自发进行的条件是__________ 。(填“高温”或“低温”或“任意条件”)
(2)2min内H2O的平均反应速率为__________ mol/(L·min)。
(3)2min平衡时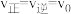 ,采取下列措施后,使
,采取下列措施后,使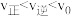 的是__________。
的是__________。
(4)平衡常数Kp=__________ Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)下列说法正确的是__________。
 ∆H>0。经过2min后达到平衡,容器的压强增加了20%。
∆H>0。经过2min后达到平衡,容器的压强增加了20%。(1)该反应自发进行的条件是
(2)2min内H2O的平均反应速率为
(3)2min平衡时
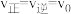 ,采取下列措施后,使
,采取下列措施后,使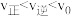 的是__________。
的是__________。| A.恒温恒容下,除去部分H2O | B.降低温度 |
| C.恒温恒容下,充入Ar | D.恒温恒压下,充入Ar |
(5)下列说法正确的是__________。
| A.增加碳单质,可以加快该反应速率 |
| B.2min时,H2O的转化率为20% |
| C.当混合气体的平均摩尔质量不再变化时,可以判断该反应达到了平衡 |
| D.平衡后向体系内补加0.4molH2O(g)和0.4molCO(g),反应向逆反应方向进行 |
您最近一年使用:0次
2023-12-11更新
|
177次组卷
|
2卷引用:浙江省绍兴市第一中学2023-2024学年高二上学期11月期中考试(平行班)化学试题
名校
10 . 回答下列问题。
(1)下列反应中,在高温下不能自发进行的是____________ (填字母)。
a.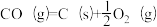
b .
c.
d.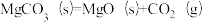
(2)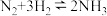 △H<0。T°C时,在有催化剂的恒容密闭容器中充入N2和H2。下图为不同投料比[
△H<0。T°C时,在有催化剂的恒容密闭容器中充入N2和H2。下图为不同投料比[ ]时某反应物X的平衡转化率变化曲线。反应物X是
]时某反应物X的平衡转化率变化曲线。反应物X是_______________ (填“N2或H2”)。
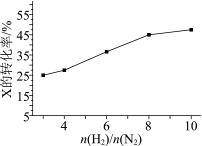
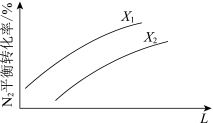
(3)在其他条件相同时,下图为分别测定不同压强、不同温度下,N2的平衡转化率。L表示_____________ ,其中X1__________ X2(填“>”或“<”)
(1)下列反应中,在高温下不能自发进行的是
a.
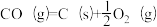
b .

c.

d.
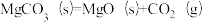
(2)
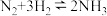 △H<0。T°C时,在有催化剂的恒容密闭容器中充入N2和H2。下图为不同投料比[
△H<0。T°C时,在有催化剂的恒容密闭容器中充入N2和H2。下图为不同投料比[ ]时某反应物X的平衡转化率变化曲线。反应物X是
]时某反应物X的平衡转化率变化曲线。反应物X是
(3)在其他条件相同时,下图为分别测定不同压强、不同温度下,N2的平衡转化率。L表示

您最近一年使用:0次



