1 . 1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才,现将1molN2和3molH2投入1L的密闭容器,在一定条件下,利用反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H<0. 回答下列问题:
H<0. 回答下列问题:
(1)合成氨反应平衡常数的表达式为_______ 。温度升高,K值_______ (填“增大”“减小”或“不变"):使用催化剂,K值_______ (填“增大“减小”或“不变”)。
(2)反应的 S
S_______ 0(填“>”“<"或“=”)
(3)有利于提高平衡混合物中氨含量的条件有_______ (填序号)。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(4)当反应达到平衡后,向体系中充入N2的,平衡_______ 移动(填“正向”“逆向”或“不”);给体系升温,
_______ (填“增大”“减小”或不变”),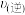
_______ (填“增大”“减小”或“不变”),平衡_______ 移动(填“正向”“逆向”或“不”)。
 2NH3(g)
2NH3(g)  H<0. 回答下列问题:
H<0. 回答下列问题:(1)合成氨反应平衡常数的表达式为
(2)反应的
 S
S(3)有利于提高平衡混合物中氨含量的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(4)当反应达到平衡后,向体系中充入N2的,平衡

您最近一年使用:0次
解题方法
2 . 某一化学反应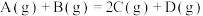
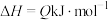 ,一定条件下反应过程中的能量变化如图所示。
,一定条件下反应过程中的能量变化如图所示。

请回答下列问题:
(1)Q_____ 0(填“>”“<”或“=”)。
(2)熵变
_____ 0(填“>”“<”或“=”)。
(3)该反应_____ 自发进行;若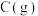 改为
改为 其他不变,该反应
其他不变,该反应_____ 自发进行。(填“能”、“不能”或“可能”)。
(4)反应物键能之和数值_____ 生成物键能之和(填“>”“<”或“=”)
(5)该反应_____ 氧化还原反应(填“是”“不是”或“可能是”)
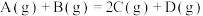
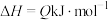 ,一定条件下反应过程中的能量变化如图所示。
,一定条件下反应过程中的能量变化如图所示。
请回答下列问题:
(1)Q
(2)熵变

(3)该反应
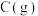 改为
改为 其他不变,该反应
其他不变,该反应(4)反应物键能之和数值
(5)该反应
您最近一年使用:0次
解题方法
3 . 当∆H_____ 0,∆S_____ 0时,反应在低温条件下才自发进行;
当∆H_____ 0,∆S_____ 0时,反应在高温条件下才能自发进行;
当∆H_____ 0,∆S_____ 0时,反应在任意温度下都能自发进行;
当∆H_____ 0,∆S_____ 0时,反应在任意温度下都不能自发进行。
当∆H
当∆H
当∆H
您最近一年使用:0次
解题方法
4 . 焓变和熵变综合判据为∆G=_____ 。∆G_____ 0反应正向能自发进行;∆G_____ 0反应达到平衡状态;∆G_____ 0反应正向不能自发进行。
您最近一年使用:0次
解题方法
5 . 自发进行的化学反应大多数是熵_____ 的反应,也有些是熵_____ 的反应。(填“增加”或“减小”)
您最近一年使用:0次
解题方法
6 . 自发进行的化学反应大多数是_____ 反应,也有些是_____ 反应。(填“吸热”或“放热”)
您最近一年使用:0次
名校
7 . I.肼可作氢气“储蓄罐”。Ni-Pt/La2O3是一种高选择性的肼分解制氢催化剂,催化反应机理如图所示,反应如下:

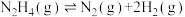
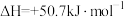
(1)根据上述信息,推测Ni-Pt/La2O3___________。
Ⅱ.肼类燃烧剂曾是火箭的“粮食”,但会造成污染,正逐渐被淘汰。新一代运载火箭采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①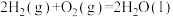
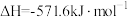 '
'
②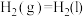

③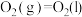
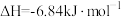
④

(2)请写出相同条件下液氢和液氧生成气态水的热化学方程式:___________ 。
(3)根据上述信息,以下说法正确的是___________。

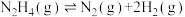
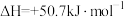
(1)根据上述信息,推测Ni-Pt/La2O3___________。
| A.能够有效降低制氢反应的反应热 |
| B.同时提高制氢正反应和逆反应的速率 |
| C.改变了制氢反应的反应历程 |
| D.不参与化学反应,使用一段时间后无需补加 |
Ⅱ.肼类燃烧剂曾是火箭的“粮食”,但会造成污染,正逐渐被淘汰。新一代运载火箭采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①
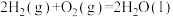
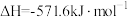 '
'②
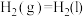

③
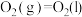
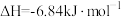
④


(2)请写出相同条件下液氢和液氧生成气态水的热化学方程式:
(3)根据上述信息,以下说法正确的是___________。
| A.变化④为低温自发的过程 |
| B.液氢液氧不点燃观察不到水生成,故该反应无法自发进行 |
| C.0.5mol液态氢气的能量高于0.5mol气态氢气的能量 |
| D.液氢和液氧作为火箭推进剂符合绿色化学理念 |
您最近一年使用:0次
8 . 利用 催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
反应I:

反应Ⅱ: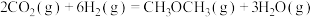

请回答:
(1)反应I的平衡常数表达式为
__________ ;反应Ⅱ发生自发反应的条件是__________ 。
(2)在一定温度和恒容条件下,可以作为判断上述两个反应均达到平衡状态的依据是__________。
(3)在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)

①对于反应I,图中A点时,
__________  (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
②可能有利于提高 平衡产率的措施有
平衡产率的措施有__________ 。
A.缩小容器的体积 B.升高反应的温度
C.选择更合适于反应Ⅱ的催化剂 D.适当调整 和
和 起始量的比例
起始量的比例
③图中温度高于300℃, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是__________ 。
 催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:反应I:


反应Ⅱ:
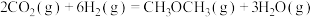

请回答:
(1)反应I的平衡常数表达式为

(2)在一定温度和恒容条件下,可以作为判断上述两个反应均达到平衡状态的依据是__________。
| A.体系内的压强保持不变 | B.两个反应的平衡常数不变 |
C. | D.反应体系中各物质的浓度不变 |
(3)在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
①对于反应I,图中A点时,

 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②可能有利于提高
 平衡产率的措施有
平衡产率的措施有A.缩小容器的体积 B.升高反应的温度
C.选择更合适于反应Ⅱ的催化剂 D.适当调整
 和
和 起始量的比例
起始量的比例③图中温度高于300℃,
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是
您最近一年使用:0次
解题方法
9 . 利用甲烷制取氢气等气体是科学家研究的热点课题。
(1)一定条件下, 分解反应
分解反应 的部分反应历程如下图所示。
的部分反应历程如下图所示。
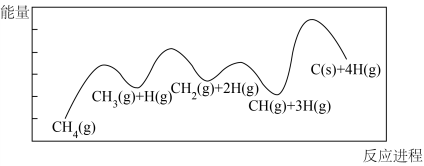
①该历程图表示___________ 步反应,其中正反应活化能最大步骤的反应方程式为___________ 。
② 分解反应
分解反应___________ 。
A.高温下能自发进行 B.低温下能自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(2)科学家提出以吸附性活性炭 为催化剂,利用
为催化剂,利用 与
与 制备“合成气”(
制备“合成气”( 、
、 )。其反应历程分两步,反应历程的能量变化如下图:
)。其反应历程分两步,反应历程的能量变化如下图:
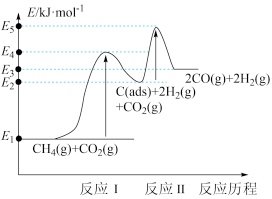
反应Ⅰ: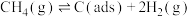 (慢反应)
(慢反应)
反应Ⅱ: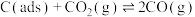 (快反应)
(快反应)
①加入活性炭C(ads)使该反应的活化能___________ (填“升高”“降低”或“不变”)。
② 与
与 制备“合成气”的反应为
制备“合成气”的反应为___________ 反应(填“放热”或“吸热”),其热化学方程式为___________ ( 用
用 表示),能量变化图中:
表示),能量变化图中:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)一定条件下,
 分解反应
分解反应 的部分反应历程如下图所示。
的部分反应历程如下图所示。
①该历程图表示
②
 分解反应
分解反应A.高温下能自发进行 B.低温下能自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(2)科学家提出以吸附性活性炭
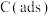 为催化剂,利用
为催化剂,利用 与
与 制备“合成气”(
制备“合成气”( 、
、 )。其反应历程分两步,反应历程的能量变化如下图:
)。其反应历程分两步,反应历程的能量变化如下图:
反应Ⅰ:
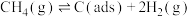 (慢反应)
(慢反应)反应Ⅱ:
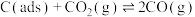 (快反应)
(快反应)①加入活性炭C(ads)使该反应的活化能
②
 与
与 制备“合成气”的反应为
制备“合成气”的反应为 用
用 表示),能量变化图中:
表示),能量变化图中:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解题方法
10 . 含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l) ΔH=−11.9kJ·mol-1。判断该反应的自发性并说明理由___________ 。
(2)已知2SO2(g)+O2 2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
①反应开始到第10分钟,SO3反应速率为________ 。
②该温度下反应的平衡常数为________ 。
③平衡时SO2的转化率为________ 。
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是______ 。
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是______ 。
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)_____ kPa,Kp(Ⅰ)随反应温度升高而_____ (填“增大”“减小”或“不变”)。
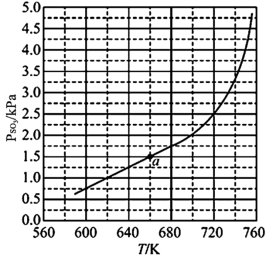
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l) ΔH=−11.9kJ·mol-1。判断该反应的自发性并说明理由
(2)已知2SO2(g)+O2
 2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。①反应开始到第10分钟,SO3反应速率为
②该温度下反应的平衡常数为
③平衡时SO2的转化率为
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s)
 Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
您最近一年使用:0次



