1 . 一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸
(1)当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是___________ (用a、b、c表示)。
(2)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是___________ (用a、b、c表示)。
(3)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为___________ (用a、b、c表示)。
(1)当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是
(2)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是
(3)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为
您最近一年使用:0次
名校
2 .  可以看成一种二元弱酸,写出第一步电离的电离方程式
可以看成一种二元弱酸,写出第一步电离的电离方程式___________ 。
 可以看成一种二元弱酸,写出第一步电离的电离方程式
可以看成一种二元弱酸,写出第一步电离的电离方程式
您最近一年使用:0次
3 . 研究水溶液中的粒子行为在研究中具有重要价值。
根据下表所列三种溶液在25℃时的相关数据,按要求填空:
(1)用离子方程式表示CH3COOH溶液显酸性的原因 ___________ 。
(2)比较溶液(Ⅱ)、(Ⅲ)中 的大小关系是(Ⅱ)
的大小关系是(Ⅱ)___________ (Ⅲ)(填“>”、“<”或“=”)。
(3)溶液(Ⅱ)中各离子浓度由大到小的顺序是___________ 。
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的 之比是
之比是 ___________ 。
根据下表所列三种溶液在25℃时的相关数据,按要求填空:
| 溶液 | 物质的量浓度 | pH | 用离子方程式表示溶液显酸性的原因 |
| (Ⅰ)CH3COOH | 0.1mol/L | 3 | _______ |
| (Ⅱ)NH4Cl | 0.1mol/L | 6 | / |
| (Ⅲ)NH4HSO4 | 0.1mol/L | 1 | / |
(2)比较溶液(Ⅱ)、(Ⅲ)中
 的大小关系是(Ⅱ)
的大小关系是(Ⅱ)(3)溶液(Ⅱ)中各离子浓度由大到小的顺序是
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的
 之比是
之比是
您最近一年使用:0次
4 . 已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表:
(1)写出碳酸的第一步电离方程式 ___________ 。
(2) 的盐酸与醋酸溶液分别加蒸馏水稀释至
的盐酸与醋酸溶液分别加蒸馏水稀释至 ,稀释后溶液的
,稀释后溶液的 ,前者
,前者 ___________ 后者(填“>”、“<”或“=”)。
(3)25℃时,等浓度的三种溶液a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液, 由大到小的顺序为
由大到小的顺序为 ___________  填序号
填序号 。
。
(4)25℃时,向 溶液中通入少量
溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为 ___________ 。
| 醋酸 | 碳酸 | 氢氰酸 |
 |  、 、 |  |
(2)
 的盐酸与醋酸溶液分别加蒸馏水稀释至
的盐酸与醋酸溶液分别加蒸馏水稀释至 ,稀释后溶液的
,稀释后溶液的 ,前者
,前者 (3)25℃时,等浓度的三种溶液a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,
 由大到小的顺序为
由大到小的顺序为  填序号
填序号 。
。(4)25℃时,向
 溶液中通入少量
溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
名校
5 . 水溶液存在离子平衡,回答下列问题:
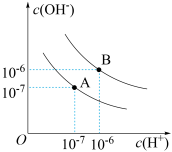
(1)水的电离平衡曲线如图所示。若以A点表示25°C时水在电离平衡时的离子浓度。当温度升到100°C时,水的电离平衡状态到B点,该温度时0.1mol/LNaOH溶液pH为___________ 。___________ (填“正”或“逆”)反应方向移动:水的电离程度将___________ (填“增大”、“减小”或“不变”)。
(3)常温下向20.00mL0.100mol/LHX(一元酸)溶液中滴加0.100mol/LNaOH的pH变化如图所示。___________ 。
②C点溶液中c(X-)___________ c(Na+)(填“>”、“<”或“=”)。
(1)水的电离平衡曲线如图所示。若以A点表示25°C时水在电离平衡时的离子浓度。当温度升到100°C时,水的电离平衡状态到B点,该温度时0.1mol/LNaOH溶液pH为
(3)常温下向20.00mL0.100mol/LHX(一元酸)溶液中滴加0.100mol/LNaOH的pH变化如图所示。

②C点溶液中c(X-)
您最近一年使用:0次
6 . 下表是几种弱酸常温下的电离常数:
(1)写出 的电离方程式
的电离方程式___________ 。
(2) 四种酸的酸性由强到弱的顺序为
四种酸的酸性由强到弱的顺序为___________ 。
(3)写出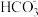 的水解方程式
的水解方程式___________ 。
(4)同浓度的 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为___________ 。
 |  |  |  |
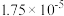 | 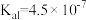 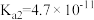 | 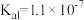 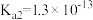 |  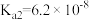 |
(1)写出
 的电离方程式
的电离方程式(2)
 四种酸的酸性由强到弱的顺序为
四种酸的酸性由强到弱的顺序为(3)写出
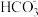 的水解方程式
的水解方程式(4)同浓度的
 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为
您最近一年使用:0次
解题方法
7 . 现有物质
①硫酸铜晶体 ②碳酸钙固体③纯磷酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁
⑦石墨 ⑧固态苛性钾 ⑨氨水 ⑩熟石灰固体 ⑪液态HCl ⑫液态
按下列要求填空。
(1)属于强电解质的是_____ (填序号,下同);
(2)属于弱电解质的是_____ ;
(3)属于非电解质的是_____ ;
①硫酸铜晶体 ②碳酸钙固体③纯磷酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁
⑦石墨 ⑧固态苛性钾 ⑨氨水 ⑩熟石灰固体 ⑪液态HCl ⑫液态

按下列要求填空。
(1)属于强电解质的是
(2)属于弱电解质的是
(3)属于非电解质的是
您最近一年使用:0次
8 . 下表是几种常见弱酸的电离平衡常数(25℃)。
回答下列各题:
(1)当温度升高时, 值
值_____ (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的 值不同,那么
值不同,那么 值的大小与酸性的相对强弱有何关系?
值的大小与酸性的相对强弱有何关系?_____ 。
(3)若把 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是_____ ,最弱的是_____ 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的 、
、 、
、 之间存在着数量上的规律,此规律是
之间存在着数量上的规律,此规律是_____ ,产生此规律的原因是_____ 。
(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实_____ (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案:_____ 。
| 酸 | 电离方程式 | 电离平衡常数K |
 |  |  |
 |   | 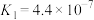  |
 | 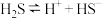  | 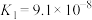 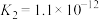 |
 | 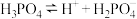   | 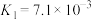 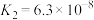 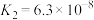 |
(1)当温度升高时,
 值
值(2)在温度相同时,各弱酸的
 值不同,那么
值不同,那么 值的大小与酸性的相对强弱有何关系?
值的大小与酸性的相对强弱有何关系?(3)若把
 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的
 、
、 、
、 之间存在着数量上的规律,此规律是
之间存在着数量上的规律,此规律是(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实
您最近一年使用:0次
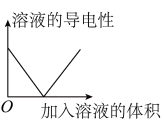
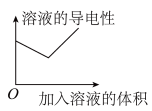
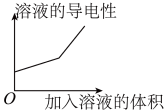
9 . 向醋酸溶液中滴加等浓度的氨水至过量,此过程中溶液导电性变化符合图像C,解释开始阶段溶液导电性为何会上升___________ ;如果在氨水滴入等浓度的盐酸溶液,则溶液导电性变化应符合图像为___________ 。
|
|
|
|
| A | B | C | D |
您最近一年使用:0次
解题方法
10 . 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为0.1mol/L的下列四种溶液:pH由小到大排列的顺序是___________ 。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________ (填序号)。
A. B.
B.  C.
C. 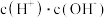 D.
D.  E.
E. 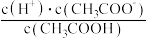
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_____________ 。
(4)25℃时,将amol/L的醋酸溶液与bmol/L氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数Ka=_________ (用含a、b的代数式表示)。
(5)标准状况下将1.12LCO2通入100mL1mol/LNaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+___________ 。
(6)将碳酸钠溶液与次氯酸溶液混合,________ (填“是”或“否”)发生反应,若反应请写出反应的离子方程式:_______________ 。(不反应此问不答)
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A.
 B.
B.  C.
C. 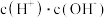 D.
D.  E.
E. 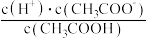
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,将amol/L的醋酸溶液与bmol/L氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数Ka=
(5)标准状况下将1.12LCO2通入100mL1mol/LNaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+
(6)将碳酸钠溶液与次氯酸溶液混合,
您最近一年使用:0次