解题方法
1 . 现有常温下浓度均为1mol•L-1的下列四种溶液:①H2SO4溶液②NaHCO3溶液③NH4Cl溶液④NaOH溶液⑤(NH4)2SO4溶液。
(1)这5种溶液pH由大到小的顺序是______ 。(填序号)
(2)②中各离子浓度由大到小的顺序是_______ ,NaHCO3的水解平衡常数Kh=______ 。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时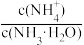 的值
的值______ (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______ ④的体积(填“大于”、“小于”或“等于”)。
(5)一定量的稀H2SO4溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是______ (填字母)。
A.加CH3COONa固体 B.加NH4Cl固体 C.加Ba(NO3)2溶液 D.加氨水 E.加Na2SO4溶液
(6)常温下,向FeCl3溶液中加入NaHCO3溶液发生反应的离子方程式为______ ,若将所得悬浊液的pH值调整为4,则溶液中Fe3+的溶液为_____ mol/L(已知常温下Ksp[Fe(OH)3]=4.0×10-38)。
(1)这5种溶液pH由大到小的顺序是
(2)②中各离子浓度由大到小的顺序是
(3)向③中通入少量氨气,此时
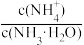 的值
的值(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积
(5)一定量的稀H2SO4溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是
A.加CH3COONa固体 B.加NH4Cl固体 C.加Ba(NO3)2溶液 D.加氨水 E.加Na2SO4溶液
(6)常温下,向FeCl3溶液中加入NaHCO3溶液发生反应的离子方程式为
您最近一年使用:0次
2 . 已知: ,电离度可表示电解质的相对强弱,电离度
,电离度可表示电解质的相对强弱,电离度 (已电离的电解质/原有电解质)×100%。已知25℃时醋酸的电离度是ɑ,
(已电离的电解质/原有电解质)×100%。已知25℃时醋酸的电离度是ɑ,
(1)电离平衡常数 的表达式是
的表达式是_____ ,
(2)物质的量浓度为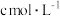 的醋酸的电离平衡常数
的醋酸的电离平衡常数 与电离度α的关系为
与电离度α的关系为
_____ (用含 的计算式表示)。
的计算式表示)。
 ,电离度可表示电解质的相对强弱,电离度
,电离度可表示电解质的相对强弱,电离度 (已电离的电解质/原有电解质)×100%。已知25℃时醋酸的电离度是ɑ,
(已电离的电解质/原有电解质)×100%。已知25℃时醋酸的电离度是ɑ,(1)电离平衡常数
 的表达式是
的表达式是(2)物质的量浓度为
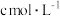 的醋酸的电离平衡常数
的醋酸的电离平衡常数 与电离度α的关系为
与电离度α的关系为
 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
3 . 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如表所示:
(1)醋酸在水溶液中的电离方程式为:_______ ,根据上表可知,酸性H2CO3_______ H2SO3(填“>”“<”或“=”,下同),在相同条件下,试比较同浓度Na2CO3、Na2SO3溶液的pH:Na2CO3_______ Na2SO3。
(2)向0.1mol/L的CH3COONa溶液中加入少量下列物质,其水解程度增大的是_______(填字母)。
(3)NaHSO3是中学化学常见的物质。HSO 在水溶液中存在两个平衡:
在水溶液中存在两个平衡:
HSO
 H+SO
H+SO Ka2
Ka2
HSO +H2O
+H2O H2SO3+OH- Kh2
H2SO3+OH- Kh2
已知25℃时,Ka2>Kh2,则0.1mol/L NaHSO3溶液:
①溶液呈_______ (填“酸性”“碱性”或“中性”)。
②溶液中 c(Na+)_______ c(HSO )。(填“>”“<”或“=”)
)。(填“>”“<”或“=”)
| 酸 | 电离平衡常数 |
| 醋酸 | K=1.75× 10-5 |
| 碳酸 | K1=4.5×10-7 K2=4.7×10-11 |
| 亚硫酸 | K1=1.4×10-2 K2=6.0×10-8 |
(2)向0.1mol/L的CH3COONa溶液中加入少量下列物质,其水解程度增大的是_______(填字母)。
| A.NaCl溶液 | B.Na2CO3固体 |
| C.NH4Cl溶液 | D.CH3COONa固体 |
 在水溶液中存在两个平衡:
在水溶液中存在两个平衡:HSO

 H+SO
H+SO Ka2
Ka2HSO
 +H2O
+H2O H2SO3+OH- Kh2
H2SO3+OH- Kh2已知25℃时,Ka2>Kh2,则0.1mol/L NaHSO3溶液:
①溶液呈
②溶液中 c(Na+)
 )。(填“>”“<”或“=”)
)。(填“>”“<”或“=”)
您最近一年使用:0次
4 . 已知常温下几种弱酸的电离平衡常数,根据溶液中的离子反应,回答下列问题:
(1)写出HClO的电离方程式:___________ 。
(2)该温度下CH3COONH4溶液呈___________ (填“酸性”、“碱性”、“中性”)。
(3)常温下,0.01mol·L−1盐酸与pH=12的氨水等体积混合后所得溶液中存在的离子,其浓度由大到小顺序为___________ 。
(4)该温度下Na2CO3的水解反应的平衡常数Kh=___________ 。
(5)写出少量CO2通入NaClO溶液中发生反应的离子方程式为___________ 。
| H2CO3 | CH3COOH | HClO | NH3·H2O |
| Ka1=4.4×10-7 | Ka=1.8×10-5 | Ka=2.95×10-8 | Kb=1.8×10-5 |
| Ka2=5.0×10-11 |
(2)该温度下CH3COONH4溶液呈
(3)常温下,0.01mol·L−1盐酸与pH=12的氨水等体积混合后所得溶液中存在的离子,其浓度由大到小顺序为
(4)该温度下Na2CO3的水解反应的平衡常数Kh=
(5)写出少量CO2通入NaClO溶液中发生反应的离子方程式为
您最近一年使用:0次
解题方法
5 . I.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过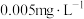 。处理含镉废水可采用化学沉淀法。已知:常温下,
。处理含镉废水可采用化学沉淀法。已知:常温下, ,
,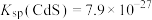 ,
,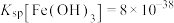 ,
, 。试回答下列问题:
。试回答下列问题:
(1)含浓度均为 的
的 、
、 的废液中,通过调pH的方式将
的废液中,通过调pH的方式将 完全沉淀出来而不损失
完全沉淀出来而不损失 的量(通常认为残留在溶液中的离子浓度小于
的量(通常认为残留在溶液中的离子浓度小于 时即完全沉淀),pH的取值范围为
时即完全沉淀),pH的取值范围为_______ 。
Ⅱ.氯化铁是一种强氧化剂和混凝剂,常用于污水处理、肝素制造、废气净化、雾霾治理等领域。
(2)用离子方程式解释 溶液可以用来净水的原理:
溶液可以用来净水的原理:_______ 。 的
的 溶液甲稀释为
溶液甲稀释为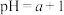 的溶液乙,则
的溶液乙,则
_______ 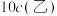 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(3)已知部分弱电解质的电离常数如下表(均为常温下的数据):
①100mL HB溶液中加入50mL等浓度的NaOH溶液,写出溶液中离子浓度大小关系:
HB溶液中加入50mL等浓度的NaOH溶液,写出溶液中离子浓度大小关系:_______ 。
②RA溶液中: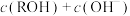
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
③比较结合 能力大小:
能力大小: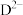
_____  (填“>”“=”或“<”),并用一个离子方程式证明:
(填“>”“=”或“<”),并用一个离子方程式证明:____ 。
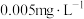 。处理含镉废水可采用化学沉淀法。已知:常温下,
。处理含镉废水可采用化学沉淀法。已知:常温下, ,
, ,
,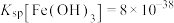 ,
, 。试回答下列问题:
。试回答下列问题:(1)含浓度均为
 的
的 、
、 的废液中,通过调pH的方式将
的废液中,通过调pH的方式将 完全沉淀出来而不损失
完全沉淀出来而不损失 的量(通常认为残留在溶液中的离子浓度小于
的量(通常认为残留在溶液中的离子浓度小于 时即完全沉淀),pH的取值范围为
时即完全沉淀),pH的取值范围为Ⅱ.氯化铁是一种强氧化剂和混凝剂,常用于污水处理、肝素制造、废气净化、雾霾治理等领域。
(2)用离子方程式解释
 溶液可以用来净水的原理:
溶液可以用来净水的原理: 的
的 溶液甲稀释为
溶液甲稀释为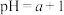 的溶液乙,则
的溶液乙,则
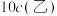 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(3)已知部分弱电解质的电离常数如下表(均为常温下的数据):
| 酸/碱 | 电离常数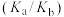 |
| HA |  |
| HB |  |
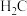 | 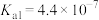 ; ; |
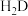 |  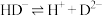 ; ; |
 |  |
 HB溶液中加入50mL等浓度的NaOH溶液,写出溶液中离子浓度大小关系:
HB溶液中加入50mL等浓度的NaOH溶液,写出溶液中离子浓度大小关系:②RA溶液中:
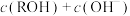
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。③比较结合
 能力大小:
能力大小: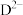
 (填“>”“=”或“<”),并用一个离子方程式证明:
(填“>”“=”或“<”),并用一个离子方程式证明:
您最近一年使用:0次
6 . Ⅰ.中国“奋斗号”载人潜水器在马里亚纳海沟成功坐底深度10909米,挑战了全球海洋最深处。国产新型钛合金、能源供给锂电池等功不可没。磷酸亚铁锂(LiFePO4)可作为锂电池的正极材料,请回答下列问题:
(1)潜水器外壳使用的钛合金
| A.耐高压 | B.耐腐蚀 | C.硬度小 | D.密度小 |
(2)磷酸亚铁锂(LiFePO4)中Fe的化合价为
(3)铁元素的相关信息如图所示,其相对原子质量是

(4)有关铁的性质,说法正确的是________。
| A.在空气中,加热Fe(OH)2可得FeO |
| B.一定条件下,Fe 能与水蒸气反应生成H2 |
| C.常温下,Fe与浓硫酸能反应生成SO2 |
| D.实验室用FeCl3溶液与NaOH溶液反应制备Fe(OH)3胶体 |
(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是________。
| A.Fe | B.FeO | C.Fe2O3 | D.Fe3O4 |
(6)要检验Fe3+,可选用的试剂是________。
| A.KSCN 溶液 | B.KMnO4溶液 | C.稀硝酸 | D.BaCl2溶液 |
Ⅱ.钠是生活中常见的金属元素,其多种化合物因其特殊性质在生活中都有广泛应用,例如,NaHCO3可用作食品膨松剂、Na2O2可用作供氧剂等。
(7)NaHCO3可用作膨松剂,原因是
(8)下列电离方程式正确的是________。
| A.NaOH = Na+ + O2-+ H+ | B.H2O = H+ + OH- |
C.HClO ClO-+ H+ ClO-+ H+ | D.CH3COONH4 CH3COO-+ NH4+ CH3COO-+ NH4+ |
(9)钠与滴加酚酞的水反应时
| A.钠浮在水面上 | B.钠熔成小球 | C.钠静止在水面上 | D.溶液变为红色 |
(10)Na2O2可作载人潜水器供氧剂,下列关于Na2O2说法正确的是________。
| A.只有离子键 | B.可在常温下由Na与O2反应制得 |
| C.Na2O2与H2O发生化合反应 | D.Na2O2与CO2反应有O2生成 |
您最近一年使用:0次
7 . Ⅰ.
(1) 的水溶液呈
的水溶液呈_____ (填“酸”、“中”、“碱”)性,常温时的
_____ 7(填“>”“=”、“<”),实验室在配制 的溶液时,常将
的溶液时,常将 固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以
固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以_____ (填“促进”、“抑制”)其水解。
Ⅱ.常温下有浓度均为 的四种溶液:①
的四种溶液:① 、②
、② 、③HCl、④
、③HCl、④ 。
。
(2)有人称溶液①是油污的“清道夫”,原因是_____ (用离子方程式解释)。
(3)溶液②中,
_____  。
。
(4)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的
_____ 。
(5)取④的溶液 ,向其中加入含
,向其中加入含 的溶液后呈中性,则
的溶液后呈中性,则 电离平衡常数
电离平衡常数
_____ 。
(1)
 的水溶液呈
的水溶液呈
 的溶液时,常将
的溶液时,常将 固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以
固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以Ⅱ.常温下有浓度均为
 的四种溶液:①
的四种溶液:① 、②
、② 、③HCl、④
、③HCl、④ 。
。(2)有人称溶液①是油污的“清道夫”,原因是
(3)溶液②中,

 。
。(4)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的

(5)取④的溶液
 ,向其中加入含
,向其中加入含 的溶液后呈中性,则
的溶液后呈中性,则 电离平衡常数
电离平衡常数
您最近一年使用:0次
8 . 水溶液广泛存在于生命体及其赖以生存的环境中,许多化学反应都是在水溶液中进行的,溶液中的电离平衡、水解平衡和溶解平衡,与生命活动、日常生活、工农业生产和环境保护等息息相关。
Ⅰ.醋酸属于有机酸,是食醋的成分之一。纯净的无水乙酸因凝固点较低,常温下为无色晶体,称为冰醋酸。
(1)向1mol/LCH3COOH溶液中加水稀释,则稀释过程中,
________ (填“增大”“不变”或“减小”)。
Ⅱ.在一定温度下,冰醋酸加水过程中溶液的导电能力变化如图,请回答问题:
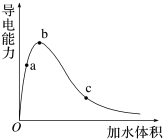
(2)a、b、c三点对应的溶液中,c(CH3COO-)由大到小的顺序是______________ 。
(3)a点到b点的过程中,溶液的pH_______ (填“增大”“不变”或“减小”)。
(4)浓度均为1mol/L且等体积的醋酸溶液和盐酸,恰好完全中和NaOH的物质的量_______ 。
A.醋酸溶液中和NaOH的物质的量多
B.盐酸中和NaOH的物质的量多
C.两者一样多
(5)醋酸溶液和氢氧化钠溶液恰好完全中和所得溶液呈_______ 性(填“酸”“碱”或“中”),原因是____________ (用离子方程式表示)。
Ⅲ.已知:25℃时Ksp(AgCl)=1.8×10-10,Ag2CrO4为砖红色沉淀。
(6)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl- 时,采用K2CrO4为指示剂,当溶液中的Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中的c(Ag+)=_______ mol/L,滴定终点现象为______________ 。
Ⅰ.醋酸属于有机酸,是食醋的成分之一。纯净的无水乙酸因凝固点较低,常温下为无色晶体,称为冰醋酸。
(1)向1mol/LCH3COOH溶液中加水稀释,则稀释过程中,

Ⅱ.在一定温度下,冰醋酸加水过程中溶液的导电能力变化如图,请回答问题:

(2)a、b、c三点对应的溶液中,c(CH3COO-)由大到小的顺序是
(3)a点到b点的过程中,溶液的pH
(4)浓度均为1mol/L且等体积的醋酸溶液和盐酸,恰好完全中和NaOH的物质的量
A.醋酸溶液中和NaOH的物质的量多
B.盐酸中和NaOH的物质的量多
C.两者一样多
(5)醋酸溶液和氢氧化钠溶液恰好完全中和所得溶液呈
Ⅲ.已知:25℃时Ksp(AgCl)=1.8×10-10,Ag2CrO4为砖红色沉淀。
(6)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl- 时,采用K2CrO4为指示剂,当溶液中的Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中的c(Ag+)=
您最近一年使用:0次
9 . 回答下列问题
(1)用离子方程式解释NH4Cl呈酸性的原因:_______
(2)25℃时,pH均为2的三种酸的电离平衡常数如下表:
试回答下列问题:
①下列四种离子结合质子能力最强的是___________ (填序号)。
a. b.ClO- c.CH3COO- d.
b.ClO- c.CH3COO- d.
②常温下将CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是___________ 。
A. B.
B. C.
C.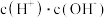 D .
D . E.
E.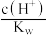
③体积均为10 mL,pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
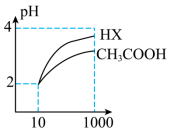
稀释后,HX溶液中水电离出来的c(H+)___________ (填“>”、“<”或“=”)醋酸溶液中水电离出来的c(H+);CH3COOH的电离平衡常数___________ (填“>”、“<”或“=”)HX的电离平衡常数,理由是___________ 。
(1)用离子方程式解释NH4Cl呈酸性的原因:
(2)25℃时,pH均为2的三种酸的电离平衡常数如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 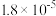 |  、 、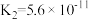 |  |
①下列四种离子结合质子能力最强的是
a.
 b.ClO- c.CH3COO- d.
b.ClO- c.CH3COO- d.
②常温下将CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是
A.
 B.
B. C.
C.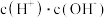 D .
D . E.
E.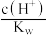
③体积均为10 mL,pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

稀释后,HX溶液中水电离出来的c(H+)
您最近一年使用:0次
10 . 25℃时,三种酸的电离平衡常数如表:
试回答下列问题:
(1)一般情况下,当温度升高时,
_____ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是_____ (填序号)。
a. b.
b. c.
c. d.
d.
(3)下列反应不能发生的是_____(填序号,双选)。
(4)体积均为 、pH均为2的醋酸溶液与HX溶液分别加水稀释至
、pH均为2的醋酸溶液与HX溶液分别加水稀释至 ,稀释过程中pH变化如图所示。
,稀释过程中pH变化如图所示。

则HX的电离平衡常数_____ (填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的
_____ 醋酸溶液中水电离出来的 。
。
| 化学式 |  |  |  |
| 电离平衡常数 |  |  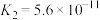 |  |
(1)一般情况下,当温度升高时,

(2)下列四种离子结合质子能力由大到小的顺序是
a.
 b.
b. c.
c. d.
d.
(3)下列反应不能发生的是_____(填序号,双选)。
A. |
B. |
C. |
D. |
(4)体积均为
 、pH均为2的醋酸溶液与HX溶液分别加水稀释至
、pH均为2的醋酸溶液与HX溶液分别加水稀释至 ,稀释过程中pH变化如图所示。
,稀释过程中pH变化如图所示。
则HX的电离平衡常数

 。
。
您最近一年使用:0次
2024-03-20更新
|
94次组卷
|
2卷引用:湖南省长长沙市德成学校2023-2024学年高二上学期11月期中考试化学试题



