解题方法
1 . 如表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
结合表中给出的电离常数回答下列问题:
(1)上述四种酸中,酸性最弱的是___________。
(2)将pH和体积均相同的 溶液和
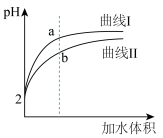
溶液和 溶液分别稀释,其pH随加水体积的变化如图所示,曲线Ⅰ是
溶液分别稀释,其pH随加水体积的变化如图所示,曲线Ⅰ是___________ 的pH变化情况,
(3)下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是___________ (填序号)。
A.升高温度 B.加水稀释 C.加少量的 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体
(4)依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________ 。
(5)室温下,测得10mL 醋酸(
醋酸( )溶液的电离度约为1%。完成下列填空:
)溶液的电离度约为1%。完成下列填空:
①上述醋酸溶液的pH=___________ 。
②加水稀释上述醋酸溶液,相对于原溶液,此时
___________ 。
A.不断减小 B.不断增大 C.无明显变化
(6)已知醋酸的酸性强于碳酸,请问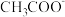 、
、 、
、 结合
结合 的能力由大到小的顺序是
的能力由大到小的顺序是___________ 。
(7)某些共价化合物(如 、
、 、
、 等)在液态时会发生微弱的电离,如:
等)在液态时会发生微弱的电离,如: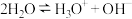 ,则液态
,则液态 的电离方程式为
的电离方程式为___________ 。
(8)现有浓度均为 的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的
的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是___________ (用序号表示)。
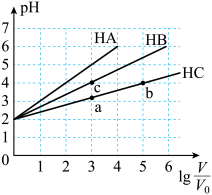
(9)常温下,pH均为2、体积均为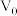 的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随
的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随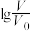 的变化关系如图所示,下列叙述错误的是___________。
的变化关系如图所示,下列叙述错误的是___________。
| 酸 |  |  | HCN | HClO |
| 电离平衡常数 |  |  | 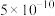 |  |
(1)上述四种酸中,酸性最弱的是___________。
A. | B. | C.HCN | D.HClO |
(2)将pH和体积均相同的
 溶液和
溶液和 溶液分别稀释,其pH随加水体积的变化如图所示,曲线Ⅰ是
溶液分别稀释,其pH随加水体积的变化如图所示,曲线Ⅰ是
(3)下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是A.升高温度 B.加水稀释 C.加少量的
 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体(4)依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(5)室温下,测得10mL
 醋酸(
醋酸( )溶液的电离度约为1%。完成下列填空:
)溶液的电离度约为1%。完成下列填空:①上述醋酸溶液的pH=
②加水稀释上述醋酸溶液,相对于原溶液,此时

A.不断减小 B.不断增大 C.无明显变化
(6)已知醋酸的酸性强于碳酸,请问
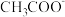 、
、 、
、 结合
结合 的能力由大到小的顺序是
的能力由大到小的顺序是(7)某些共价化合物(如
 、
、 、
、 等)在液态时会发生微弱的电离,如:
等)在液态时会发生微弱的电离,如: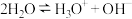 ,则液态
,则液态 的电离方程式为
的电离方程式为(8)现有浓度均为
 的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的
的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是(9)常温下,pH均为2、体积均为
 的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随
的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随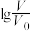 的变化关系如图所示,下列叙述错误的是___________。
的变化关系如图所示,下列叙述错误的是___________。
A.常温下: |
| B.HC的电离程度,a点<b点 |
C.当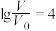 时,三种溶液同时升高温度, 时,三种溶液同时升高温度,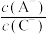 减小 减小 |
| D.a点酸的总浓度小于b点酸的总浓度 |
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.甲酸(HCOOH)是一种弱酸,在水溶液中电离成氢离子和甲酸根离子( )。
)。
(1)请写出甲酸的电离方程式_______ 。
(2)某甲酸溶液中,HCOOH的初始浓度是 ,当其电离达到平衡时,溶液中的
,当其电离达到平衡时,溶液中的 浓度c的取值范围是_______。
浓度c的取值范围是_______。
Ⅱ.完成下列问题
(3)某种酱油的pH为5,则该酱油中的c(H+)=_______ 。
(4)在常温下,柠檬水的pH为3,其中的c(OH-)为_______ (填字母)。
a.0.1 mol∙L−1 b.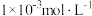 c.
c.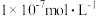 d.
d.
Ⅲ.在25℃时对氨水进行如下操作。请填写下列空白。
(5)若向氨水中加入少量硫酸铵固体,则溶液中 将
将_______ (填“增大”“减小”或“不变”)。
(6)若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:_______ ;所得溶液的pH_______ 7(填“>”“<”或“=”),用离子方程式表示其原因:_______ 。
(7)若向氨水中加入稀硫酸至溶液的pH=7,此时溶液中 ,则
,则
_______ 。
(8)用硫酸标准溶液滴定氨水,达滴定终点的标志是_______ 。
 )。
)。(1)请写出甲酸的电离方程式
(2)某甲酸溶液中,HCOOH的初始浓度是
 ,当其电离达到平衡时,溶液中的
,当其电离达到平衡时,溶液中的 浓度c的取值范围是_______。
浓度c的取值范围是_______。A. | B. |
C.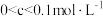 | D. 0 0 |
Ⅱ.完成下列问题
(3)某种酱油的pH为5,则该酱油中的c(H+)=
(4)在常温下,柠檬水的pH为3,其中的c(OH-)为
a.0.1 mol∙L−1 b.
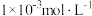 c.
c.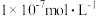 d.
d.
Ⅲ.在25℃时对氨水进行如下操作。请填写下列空白。
(5)若向氨水中加入少量硫酸铵固体,则溶液中
 将
将(6)若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:
(7)若向氨水中加入稀硫酸至溶液的pH=7,此时溶液中
 ,则
,则
(8)用硫酸标准溶液滴定氨水,达滴定终点的标志是
您最近一年使用:0次
3 . 类别万千的酸碱溶液共同构筑了化学世界的丰富多彩。
(1)现有常温下pH=2的盐酸(甲)、pH=2的醋酸溶液(乙)和0.1mol/LNH3∙H2O(丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值一定变小的是_____ (填字母)。
A. B.
B. C.
C.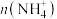 D.
D.
②常温下,取甲、乙各1mL分别稀释至100mL,稀释后,水的电离程度:乙_____ 甲(填“>”“<”或“=”)。
(2)①某温度时,测得0.01mol/LNaOH溶液pH为11,则该温度_____ 25℃。(填“>”“<”或“=”)
②相同条件下,取等体积、等pH的Ba(OH)2、NaOH和NH3∙H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为_____ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
①将SO2通入氨水中,当c(OH-)降至1.0×10-7mol∙L-1时,溶液中的 =
=_____ 。
②下列微粒在溶液中不能大量共存的是_____ 。
A. 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
(1)现有常温下pH=2的盐酸(甲)、pH=2的醋酸溶液(乙)和0.1mol/LNH3∙H2O(丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值一定变小的是
A.
 B.
B. C.
C.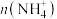 D.
D.
②常温下,取甲、乙各1mL分别稀释至100mL,稀释后,水的电离程度:乙
(2)①某温度时,测得0.01mol/LNaOH溶液pH为11,则该温度
②相同条件下,取等体积、等pH的Ba(OH)2、NaOH和NH3∙H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为
 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
| 弱电解质 | H2SO3 | H2CO3 | HClO | NH3∙H2O |
| 电离平衡常数 | 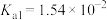  |   | 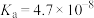 |  |
 =
=②下列微粒在溶液中不能大量共存的是
A.
 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
您最近一年使用:0次
4 . 水的电离平衡曲线如图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态为B点。
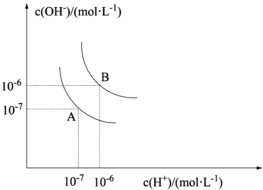
(1)在100℃时,Kw的表达式为_____ ,在此温度下,Kw的值为_____ mol2/L2.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为_____ ,物质的量浓度比为_____
(3)室温时将pH为3的硫酸溶液稀释5百万倍,稀释后溶液中,c( )和c(H+)之比约为
)和c(H+)之比约为_____ 。
Ⅱ.现有溶质为①CH3COOH,②HCl、③H2SO4的三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式:_____ 。
(5)当它们pH相同时,其物质的量浓度最大的是_____ (填序号)。
(6)当它们的物质的量浓度相同时,其pH最小的是_____ (填序号)。
(7)在室温下,将c(H+)均为0.1mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为_____ (填序号)。
(8)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为_____ 。
(9)三种酸溶液的pH相同时,若消耗等量的Zn,则需三种酸溶液的体积大小关系为_____ (填序号)。

(1)在100℃时,Kw的表达式为
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为
(3)室温时将pH为3的硫酸溶液稀释5百万倍,稀释后溶液中,c(
 )和c(H+)之比约为
)和c(H+)之比约为Ⅱ.现有溶质为①CH3COOH,②HCl、③H2SO4的三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式:
(5)当它们pH相同时,其物质的量浓度最大的是
(6)当它们的物质的量浓度相同时,其pH最小的是
(7)在室温下,将c(H+)均为0.1mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为
(8)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为
(9)三种酸溶液的pH相同时,若消耗等量的Zn,则需三种酸溶液的体积大小关系为
您最近一年使用:0次
解题方法
5 . “弱”,释义为力气小,势力小,效果(由某种动因或原因所产生的结果;后果(效果)程度越浅)与“强”相对。弱电解质、盐类的水解都与“弱”相关。根据你所学过的知识,回答下列问题:
(1)在常温下, 一元酸
一元酸 溶液的
溶液的 ,回答下列问题:
,回答下列问题:
① 在水溶液中的电离平衡常数
在水溶液中的电离平衡常数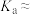
___________ 。
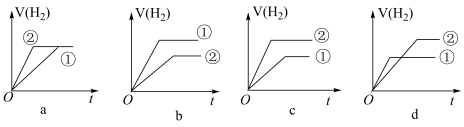
②常温下,有 相同、体积相同的盐酸和上述酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的盐酸和上述酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是___________ (填字母)。(①表示盐酸,②表示HB)。
(2) 时,向氨水中加入少量硫酸铵固体,则溶液中
时,向氨水中加入少量硫酸铵固体,则溶液中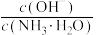 将
将___________ (填“增大”“减小”或“不变”);向氨水中加入稀硫酸至溶液的 ,此时溶液中
,此时溶液中 ,则
,则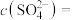
___________
(3) 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 。(
。( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等)。
等)。
①为配制 溶液,取
溶液,取 固体少许溶于
固体少许溶于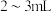 水中,有白色沉淀产生,此溶液的
水中,有白色沉淀产生,此溶液的
___________ 7(填“小于”“大于”或“等于”),配制 溶液的正确方法是
溶液的正确方法是_____
②为了得到较多的 ,操作时要将
,操作时要将 缓慢加入大量水中,反应后期还要加入少量氨水。试利用平衡移动原理说明这两项操作的作用:
缓慢加入大量水中,反应后期还要加入少量氨水。试利用平衡移动原理说明这两项操作的作用:___________ 。
(1)在常温下,
 一元酸
一元酸 溶液的
溶液的 ,回答下列问题:
,回答下列问题:①
 在水溶液中的电离平衡常数
在水溶液中的电离平衡常数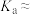
②常温下,有
 相同、体积相同的盐酸和上述酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的盐酸和上述酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
(2)
 时,向氨水中加入少量硫酸铵固体,则溶液中
时,向氨水中加入少量硫酸铵固体,则溶液中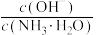 将
将 ,此时溶液中
,此时溶液中 ,则
,则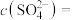
(3)
 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 。(
。( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等)。
等)。①为配制
 溶液,取
溶液,取 固体少许溶于
固体少许溶于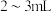 水中,有白色沉淀产生,此溶液的
水中,有白色沉淀产生,此溶液的
 溶液的正确方法是
溶液的正确方法是②为了得到较多的
 ,操作时要将
,操作时要将 缓慢加入大量水中,反应后期还要加入少量氨水。试利用平衡移动原理说明这两项操作的作用:
缓慢加入大量水中,反应后期还要加入少量氨水。试利用平衡移动原理说明这两项操作的作用:
您最近一年使用:0次
名校
解题方法
6 . I.根据表中数据(常温下),完成下列填空。
(1)常温下,NaCN溶液呈___________ (填“酸”、“碱”或“中”)性,其原因是___________ (用离子方程式表示)。
(2)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为___________ 。
(3)常温下,Na2SO3溶液中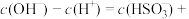
___________ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。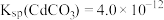 ,
,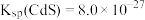 ;回答下列问题:
;回答下列问题:
(4)向某含镉废水中加入Na2S,当 浓度达到
浓度达到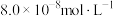 时,废水中Cd2+的浓度为
时,废水中Cd2+的浓度为___________  ,此时是否符合生活饮用水卫生标准?
,此时是否符合生活饮用水卫生标准?____________ (填“是”或“否”)
(5)室温下,反应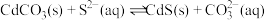 达到平衡,该反应的平衡常数K=
达到平衡,该反应的平衡常数K=___________ (结果保留两位有效数字)
| 物质 | CH3COOH | NH3•H2O | HCN | HClO | H2CO3 | H2SO3 |
| 电离常数(Ka) |  |  |  |  | 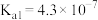 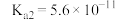 | 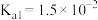  |
(2)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为
(3)常温下,Na2SO3溶液中
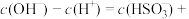
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005
 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。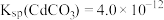 ,
,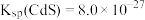 ;回答下列问题:
;回答下列问题:(4)向某含镉废水中加入Na2S,当
 浓度达到
浓度达到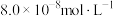 时,废水中Cd2+的浓度为
时,废水中Cd2+的浓度为 ,此时是否符合生活饮用水卫生标准?
,此时是否符合生活饮用水卫生标准?(5)室温下,反应
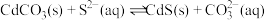 达到平衡,该反应的平衡常数K=
达到平衡,该反应的平衡常数K=
您最近一年使用:0次
7 . 按要求填空:
(1)某元素的最外层电子排布式是4s24p5,则其元素符号为___________ 。
(2)写出以惰性电极为材料电解饱和MgCl2溶液的离子方程式___________ 。
(3)H3BO3具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出H3BO3在水中的电离方程式:___________ 。
(4)50mL0.50mol/LHCl溶液与50mL0.55mol/LNaOH溶液充分反应,测得此过程放出akJ的热量,写出该过程表示中和热(数值要求化简)的热化学方程式:___________ 。
(5)将AlCl3溶液蒸干并灼烧得不到无水AlCl3,但将SOCl2(亚硫酰氯)与AlCl3·6H2O混合并加热,可获得无水AlCl3,试写出此混合加热过程的化学方程式___________ 。
(1)某元素的最外层电子排布式是4s24p5,则其元素符号为
(2)写出以惰性电极为材料电解饱和MgCl2溶液的离子方程式
(3)H3BO3具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出H3BO3在水中的电离方程式:
(4)50mL0.50mol/LHCl溶液与50mL0.55mol/LNaOH溶液充分反应,测得此过程放出akJ的热量,写出该过程表示中和热(数值要求化简)的热化学方程式:
(5)将AlCl3溶液蒸干并灼烧得不到无水AlCl3,但将SOCl2(亚硫酰氯)与AlCl3·6H2O混合并加热,可获得无水AlCl3,试写出此混合加热过程的化学方程式
您最近一年使用:0次
8 . 完成下列问题。
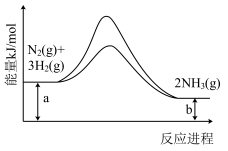
(1)合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式
(2)已知
 与
与 、
、 的反应在溶液中存在以下平衡:
的反应在溶液中存在以下平衡: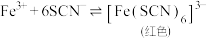 K1
K1
 K2
K2
向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为
(3)
 的除去
的除去方法1(双碱法):用NaOH吸收 ,并用CaO使NaOH再生:NaOH溶液
,并用CaO使NaOH再生:NaOH溶液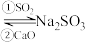 溶液。
溶液。
写出过程①的离子方程式:
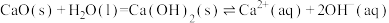 ,从平衡移动的角度,简述过程②NaOH再生的原理
,从平衡移动的角度,简述过程②NaOH再生的原理方法2:用氨水除去
已知25℃, 的
的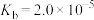 ,
, 的
的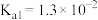 ,
,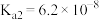 。若氨水的浓度为0.2
。若氨水的浓度为0.2 ,溶液中的
,溶液中的
 。将
。将 通入该氨水中,当
通入该氨水中,当 降至
降至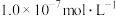 时,溶液中的
时,溶液中的
您最近一年使用:0次
9 . 下表是几种弱酸常温下的电离平衡常数:
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为___________ ;
(2)同浓度的CH3COO-、HCO 、
、 、S2-结合H+的能力由强到弱的顺序为
、S2-结合H+的能力由强到弱的顺序为___________ ;
(3)写出下列反应的离子方程式:向Na2S溶液中通入少量的CO2气体___________ 。
| CH3COOH | H2CO3 | H2S | H3PO4 |
 | 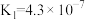 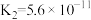 | 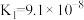  | 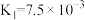 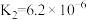 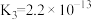 |
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为
(2)同浓度的CH3COO-、HCO
 、
、 、S2-结合H+的能力由强到弱的顺序为
、S2-结合H+的能力由强到弱的顺序为(3)写出下列反应的离子方程式:向Na2S溶液中通入少量的CO2气体
您最近一年使用:0次
解题方法
10 . 已知25℃时,电离常数:
回答下列问题:
(1)下列四种离子结合H+能力最强的是___________(填字母,下同)。
(2)下列反应不能发生的是___________。
(3)用蒸馏水稀释0.10mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________。
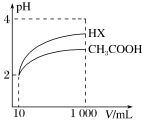
(4)体积为10mL、pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则醋酸的电离常数___________ (填“大于”“小于”或“等于”,下同)HX的电离常数,稀释后,HX溶液中由水电离出来的c(H+)___________ 醋酸溶液中由水电离出来的c(H+)。
(5)在25℃时,对于0.10mol·L-1的氨水,若向氨水中加入等体积pH=1的硫酸,此时溶液的pH___________ 7(填“>”“<”或“=”);此时溶液中各离子浓度由大到小的顺序为___________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.8×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)下列四种离子结合H+能力最强的是___________(填字母,下同)。
A.CO | B.ClO- | C.CH3COO- | D.HCO |
A.CO +2CH3COOH=2CH3COO-+CO2↑+H2O +2CH3COOH=2CH3COO-+CO2↑+H2O |
| B.ClO-+CH3COOH=CH3COO-+HClO |
C.CO +2HClO=CO2↑+H2O+2ClO- +2HClO=CO2↑+H2O+2ClO- |
| D.ClO-+CO2+H2O=HCO3-+HClO |
A. | B. | C. | D. |

(5)在25℃时,对于0.10mol·L-1的氨水,若向氨水中加入等体积pH=1的硫酸,此时溶液的pH
您最近一年使用:0次



