1 . 已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,pH相同的三种溶液①NaF溶液;②NaClO溶液;③Na2CO3溶液,其物质的量浓度由大到小的顺序是_______ 。(填序号)
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_______ 。
(3)室温下,经测定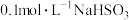 溶液
溶液 ,则
,则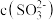
_______  (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。
(4) 时,将
时,将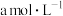 的氨水与
的氨水与 的盐酸等体积混合所得溶液中
的盐酸等体积混合所得溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离平衡常数
的电离平衡常数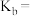
_______ 。
(5)将含 的烟气通入该氨水中,当溶液显中性时,溶液中
的烟气通入该氨水中,当溶液显中性时,溶液中
_______ 。
| 化学式 |  |  |  |  |  |
| 电离常数 |  |  |  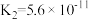 | 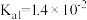 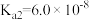 | 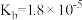 |
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式
(3)室温下,经测定
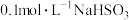 溶液
溶液 ,则
,则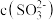
 (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。(4)
 时,将
时,将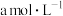 的氨水与
的氨水与 的盐酸等体积混合所得溶液中
的盐酸等体积混合所得溶液中 ,则溶液显
,则溶液显 的电离平衡常数
的电离平衡常数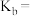
(5)将含
 的烟气通入该氨水中,当溶液显中性时,溶液中
的烟气通入该氨水中,当溶液显中性时,溶液中
您最近一年使用:0次
名校
2 . 已知在25℃时, 的电离平衡常数
的电离平衡常数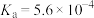 。将浓度相等的
。将浓度相等的 与
与 溶液等体积混合,溶液呈酸性。通过计算,解释溶液呈酸性的原因
溶液等体积混合,溶液呈酸性。通过计算,解释溶液呈酸性的原因___________ 。
 的电离平衡常数
的电离平衡常数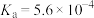 。将浓度相等的
。将浓度相等的 与
与 溶液等体积混合,溶液呈酸性。通过计算,解释溶液呈酸性的原因
溶液等体积混合,溶液呈酸性。通过计算,解释溶液呈酸性的原因
您最近一年使用:0次
名校
3 . 常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
(1)酸性由强到弱的顺序为___________ 。
(2)将少量的 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:___________ 。
| 化学式 |  |  |  |  |
| 电离平衡常数 | 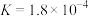 | 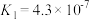 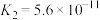 | 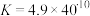 | 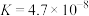 |
(1)酸性由强到弱的顺序为
(2)将少量的
 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:
您最近一年使用:0次
解题方法
4 . 电解质的水溶液中存在电离平衡。
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为_______ 。
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)________ 。
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。_______ 。
②滴定醋酸的曲线是_______ (填“I”或“Ⅱ”),则V1______ V2(填“>”、 “<”“或“=”)。
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为_____ mL。 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①该滴定过程应选择______ (填“甲基橙”或“酚酞”)为指示剂,根据上述数据,可计算出该醋酸的浓度约为_____  。
。
②在上述实验中,下列操作会造成测定结果偏大的有______ 。(填字母序号)。
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为
 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。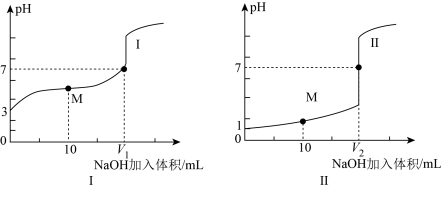
②滴定醋酸的曲线是
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为

 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测醋酸的体积(mL) |
| 1 | 0.1000 | 22.48 | 20.00 |
| 2 | 0.1000 | 25.72 | 20.00 |
| 3 | 0.1000 | 22.52 | 20.00 |
 。
。②在上述实验中,下列操作会造成测定结果偏大的有
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
名校
5 . 碳族元素的物质是化学世界中最庞大的家族,“天问一号”轨道飞行器近距离拍摄了火星北极,看到大量白色冰冻区域, 主要是二氧化碳低温凝结形成的干冰,虽然看起来和地球两极很像,但实际温度却比地球两极冷多了!
(1)已知 25℃时,H2CO3的Ka1=4.2×10-7、Ka2=4.8×10- 11,HCN的Ka=4.0×10-10,若向NaCN 溶液中通入少量 CO2,发生反应的离子方程式为___________ 。
(2)下列关于二氧化碳的说法正确的是___________。
(3)干冰和冰的晶体模型如下图存在差别的本质原因___________ 。___________ 。
(5)金刚石晶体中,每个C被___________ 个六元环共用。
(6)晶体硅和碳化硅熔点较高的是___________ (填化学式)。
(7)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________ 。
(1)已知 25℃时,H2CO3的Ka1=4.2×10-7、Ka2=4.8×10- 11,HCN的Ka=4.0×10-10,若向NaCN 溶液中通入少量 CO2,发生反应的离子方程式为
(2)下列关于二氧化碳的说法正确的是___________。
A.电子式为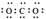 | B.空间填充模型为  |
| C.CO2 是极性分子, 能溶于水 | D.CO2 的水溶液能够导电,但 CO2是非电解质 |
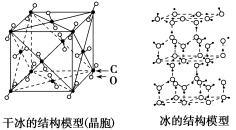
(5)金刚石晶体中,每个C被
(6)晶体硅和碳化硅熔点较高的是
(7)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
您最近一年使用:0次
6 . 完成下列问题。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
①亚硫酸发生电离的方程式为______ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:______ 。
③在相同条件下,试比较H2CO3、 和
和 的酸性强弱:
的酸性强弱:____ >____ >____ 。
(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:____ 。
②a、b、c三点溶液的pH由大到小的顺序为____ ,电离程度最大的是____ 。
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择____ (填字母)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较H2CO3、
 和
和 的酸性强弱:
的酸性强弱:(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:
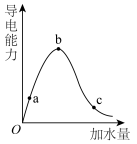
②a、b、c三点溶液的pH由大到小的顺序为
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
A.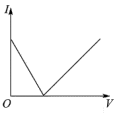 | B.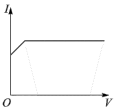 | C.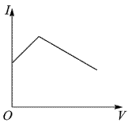 | D.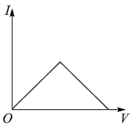 |
您最近一年使用:0次
7 . 回答下列问题。
(1)溶液酸化时,K2MnO4转变为MnO2固体和KMnO4的离子方程式是___________ 。
(2)常温下,某种饮品pH=4,其中c(OH-)=___________ 。
(3)将0.025 mol·L-1的H2SO4溶液和0.075 mol·L-1的H2SO4溶液等体积混合,混合溶液的pH=___________ 。
(4)常温下,pH=13的氢氧化钡溶液,c[Ba(OH)2]=___________ 。
(5)当H2S浓度较低时常用纯碱溶液进行吸收。表为H2S、H2CO3 的电离平衡常数。
纯碱溶液吸收少量H2S的离子方程式为___________ 。
(1)溶液酸化时,K2MnO4转变为MnO2固体和KMnO4的离子方程式是
(2)常温下,某种饮品pH=4,其中c(OH-)=
(3)将0.025 mol·L-1的H2SO4溶液和0.075 mol·L-1的H2SO4溶液等体积混合,混合溶液的pH=
(4)常温下,pH=13的氢氧化钡溶液,c[Ba(OH)2]=
(5)当H2S浓度较低时常用纯碱溶液进行吸收。表为H2S、H2CO3 的电离平衡常数。
| 电离平衡常数 | Kal | Ka2 |
| H2S | 9.1×10-8 | 1.1×10-12 |
| H2CO3 | 4.3×10-7 | 5.61×10-11 |
您最近一年使用:0次
解题方法
8 . 现有常温下甲、乙、丙、丁、戊五种溶液,其中,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的H2SO4溶液,丙为0.1mol·L-1的CH3COOH溶液,丁NH4Cl溶液,戊NaF溶液,试回答下列问题:
(1)甲溶液的pH=_______ 。
(2)丙溶液中存在的电离平衡为_______ 、_______ (用电离方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是____ (填序号)。①n(H+) ②c(OH-) ③ ④c(H+)·c(OH-)
④c(H+)·c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的由大到小的顺序为_______ 。
(5)丁溶液显酸性原因(用离子方程式表示)_______ 。
(6)戊溶液显碱性的原因(用离子方程式表示)_______ 。
(1)甲溶液的pH=
(2)丙溶液中存在的电离平衡为
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是
 ④c(H+)·c(OH-)
④c(H+)·c(OH-)(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的由大到小的顺序为
(5)丁溶液显酸性原因(用离子方程式表示)
(6)戊溶液显碱性的原因(用离子方程式表示)
您最近一年使用:0次
9 . I.现有下列物质:
①NaCl晶体 ②液态SO2 ③冰醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液 ⑨氯水 ⑩纯盐酸,请用以上物质回答下列问题。
(1)属于强电解质且在上述状态下能导电的是___________ ;属于弱电解质的是___________ ;属于非电解质,但溶于水后的水溶液能导电的是___________ 。
II.密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g) 2NH3 (g)
2NH3 (g)  H <0。
H <0。
(2)①达到平衡时, 充入N2并保持体积不变,平衡将___________ 移动(填“正向”、“逆向”或“不”)。
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将___________ 移动(同上)。
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将___________ 移动(同上)。
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡___________ 移动(同上)。
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量___________ ,密度___________ (变大、变小或不变)。
⑥当反应达到平衡时,N2和H2的浓度比是___________ ;N2和H2的转化率比是___________ 。
①NaCl晶体 ②液态SO2 ③冰醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液 ⑨氯水 ⑩纯盐酸,请用以上物质回答下列问题。
(1)属于强电解质且在上述状态下能导电的是
II.密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g)
 2NH3 (g)
2NH3 (g)  H <0。
H <0。(2)①达到平衡时, 充入N2并保持体积不变,平衡将
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量
⑥当反应达到平衡时,N2和H2的浓度比是
您最近一年使用:0次
名校
10 . 柠檬酸是一种重要的工业原料,化学式可表示为 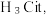 属于三元弱酸。 25℃时,柠檬酸的电离常数分别为:
属于三元弱酸。 25℃时,柠檬酸的电离常数分别为: 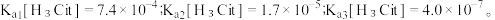
(1)25℃时, 不同pH范围内,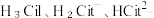 和
和 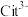 所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表
所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表  的曲线是
的曲线是_______ 。
(3)已知25℃时,碳酸的电离常数为: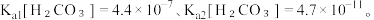 向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式_______ 。
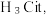 属于三元弱酸。 25℃时,柠檬酸的电离常数分别为:
属于三元弱酸。 25℃时,柠檬酸的电离常数分别为: 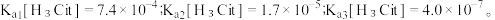
(1)25℃时, 不同pH范围内,
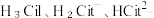 和
和 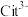 所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表
所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表  的曲线是
的曲线是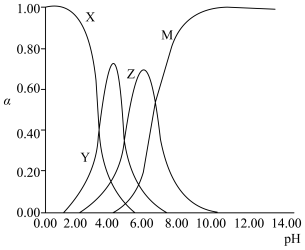
A.Na3Cit溶液中, |
B.Na3Cit溶液中,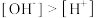 |
C.NaH2Cit溶液中, |
D.Na2HCit溶液中,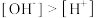 |
(3)已知25℃时,碳酸的电离常数为:
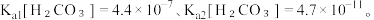 向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
您最近一年使用:0次



