1 . 盐湖卤水(主要含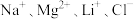 、
、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如下:
的工艺流程如下: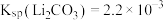 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。
(1)含硼固体中的 在水中存在平衡:
在水中存在平衡: (常温下,
(常温下,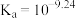 );
); 与
与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中, 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为_____ ,该溶液
_____ 。
(2)滤渣Ⅰ的主要成分是_____ (填化学式);精制Ⅰ后溶液中 的浓度为
的浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在_____  以下。若脱硼后直接进行精制Ⅰ,除无法回收
以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加
外,还将增加_____ 的用量(填化学式)。
(3)精制Ⅱ的目的是_____ ;进行操作 时应选择的试剂是
时应选择的试剂是_____ ,若不进行该操作而直接浓缩,将导致_____ 。
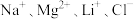 、
、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如下:
的工艺流程如下: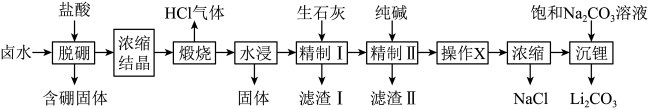
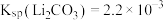 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。
(1)含硼固体中的
 在水中存在平衡:
在水中存在平衡: (常温下,
(常温下,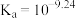 );
); 与
与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中, 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为
(2)滤渣Ⅰ的主要成分是
 的浓度为
的浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收
以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加
外,还将增加(3)精制Ⅱ的目的是
 时应选择的试剂是
时应选择的试剂是
您最近一年使用:0次
2023-06-19更新
|
8737次组卷
|
11卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)福建省泉州市培元中学2023-2024学年高三上学期12月月考化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建(已下线)FHgkyldyjhx04
真题
解题方法
2 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第_______ 周期,第_______ 族。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是_______ 。
(4)已知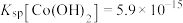 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为_______  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为_______ 。
(5)导致 比
比 易水解的因素有
易水解的因素有_______ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: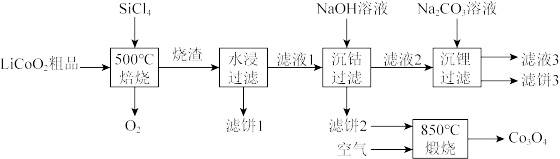
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
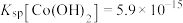 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
2023-06-14更新
|
10601次组卷
|
13卷引用:2023年高考湖北卷化学真题
2023年高考湖北卷化学真题(已下线)专题18 工艺流程题(已下线)T16-工业流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第32讲难溶电解质的溶解平衡(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建
3 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
2023-06-10更新
|
18339次组卷
|
18卷引用:2023年高考新课标理综化学真题
2023年高考新课标理综化学真题(已下线)T26-工业流程题(已下线)2023年高考化学真题完全解读(新课标卷:适用安徽、云南、山西、吉林、黑龙江五省)(PPT+Word)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省滨州市2023-2024学年高三上学期11月期中考试化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建
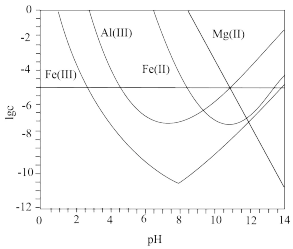
4 . 锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 和
和 杂质离子,可在0~14范围内调节
杂质离子,可在0~14范围内调节 对其净化(即相关离子浓度
对其净化(即相关离子浓度 )。
)。 时,
时, 与
与 关系见下图(碱性过强时
关系见下图(碱性过强时 和
和 会部分溶解)。下列说法正确的是
会部分溶解)。下列说法正确的是
 和
和 杂质离子,可在0~14范围内调节
杂质离子,可在0~14范围内调节 对其净化(即相关离子浓度
对其净化(即相关离子浓度 )。
)。 时,
时, 与
与 关系见下图(碱性过强时
关系见下图(碱性过强时 和
和 会部分溶解)。下列说法正确的是
会部分溶解)。下列说法正确的是
A. 可被净化的 可被净化的 区间最大 区间最大 |
B.加入适量 ,可进一步提升净化程度 ,可进一步提升净化程度 |
C.净化的先后顺序: |
D.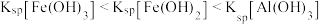 |
您最近一年使用:0次
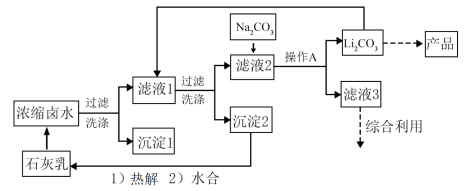
5 . 全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有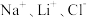 和少量
和少量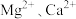 ),并设计了以下流程通过制备碳酸锂来提取锂。
),并设计了以下流程通过制备碳酸锂来提取锂。
 时相关物质的参数如下:
时相关物质的参数如下:
 的溶解度:
的溶解度: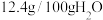
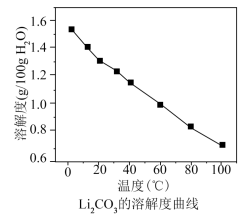
回答下列问题:
(1)“沉淀1”为___________ 。
(2)向“滤液1”中加入适量固体 的目的是
的目的是___________ 。
(3)为提高 的析出量和纯度,“操作A”依次为
的析出量和纯度,“操作A”依次为___________ 、___________ 、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备 。查阅资料后,发现文献对常温下的
。查阅资料后,发现文献对常温下的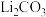 有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究
有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究 的性质,将饱和
的性质,将饱和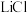 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
___________ (填“稳定”或“不稳定”),有关反应的离子方程式为___________ 。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入 改为通入
改为通入 。这一改动能否达到相同的效果,作出你的判断并给出理由
。这一改动能否达到相同的效果,作出你的判断并给出理由___________ 。
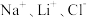 和少量
和少量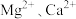 ),并设计了以下流程通过制备碳酸锂来提取锂。
),并设计了以下流程通过制备碳酸锂来提取锂。
 时相关物质的参数如下:
时相关物质的参数如下: 的溶解度:
的溶解度: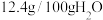
| 化合物 | 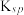 |
 |  |
 | 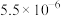 |
 | 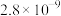 |
 | 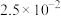 |

回答下列问题:
(1)“沉淀1”为
(2)向“滤液1”中加入适量固体
 的目的是
的目的是(3)为提高
 的析出量和纯度,“操作A”依次为
的析出量和纯度,“操作A”依次为(4)有同学建议用“侯氏制碱法”的原理制备
 。查阅资料后,发现文献对常温下的
。查阅资料后,发现文献对常温下的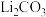 有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究
有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究 的性质,将饱和
的性质,将饱和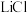 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入
 改为通入
改为通入 。这一改动能否达到相同的效果,作出你的判断并给出理由
。这一改动能否达到相同的效果,作出你的判断并给出理由
您最近一年使用:0次
2022-07-12更新
|
8772次组卷
|
14卷引用:2022年湖北省高考真题化学试题
2022年湖北省高考真题化学试题(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)2022年湖北省高考真题变式题16-19江苏省响水中学2022-2023学年高三上学期开学测试化学试题(已下线)专题17 化工流程综合题-备战2023年高考化学母题题源解密(广东卷)湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题四川省内江市第六中学2022- 2023学年高三上学期第二次月考化学试题(已下线)热点情景汇编-专题十 工艺流程中的新工艺(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
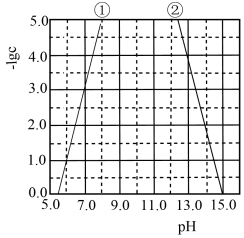
6 . 某元素M的氢氧化物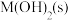 在水中的溶解反应为:
在水中的溶解反应为: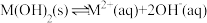 、
、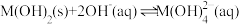 ,25℃,-lgc与pH的关系如图所示,c为
,25℃,-lgc与pH的关系如图所示,c为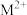 或
或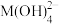 浓度的值。下列说法
浓度的值。下列说法错误 的是
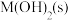 在水中的溶解反应为:
在水中的溶解反应为: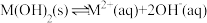 、
、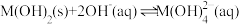 ,25℃,-lgc与pH的关系如图所示,c为
,25℃,-lgc与pH的关系如图所示,c为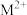 或
或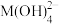 浓度的值。下列说法
浓度的值。下列说法
A.曲线①代表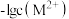 与pH的关系 与pH的关系 |
B.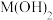 的 的 约为 约为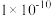 |
C.向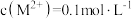 的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以 的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以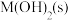 存在 存在 |
D.向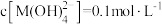 的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以 的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以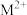 存在 存在 |
您最近一年使用:0次
2022-07-04更新
|
6813次组卷
|
14卷引用:2022年海南省高考真题化学试题
2022年海南省高考真题化学试题(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)第15练 以Ksp的计算突破溶解平衡-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)2022年海南省高考真题变式题1-14(已下线)第26讲 难溶电解质的溶解平衡(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)安徽省六安第一中学2022-2023学年高二上学期期末考试化学试题(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用(已下线)第6讲 沉淀溶解平衡图像分析
真题
解题方法
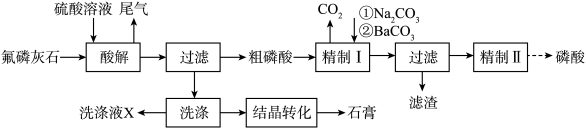
7 . 工业上以氟磷灰石[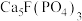 ,含
,含 等杂质]为原料生产磷酸和石膏,工艺流程如下:
等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)酸解时有 产生。氢氟酸与
产生。氢氟酸与 反应生成二元强酸
反应生成二元强酸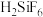 ,离子方程式为
,离子方程式为_______ 。
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,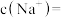
_______  ;再分批加入一定量的
;再分批加入一定量的 ,首先转化为沉淀的离子是
,首先转化为沉淀的离子是_______ 。
(3) 浓度(以
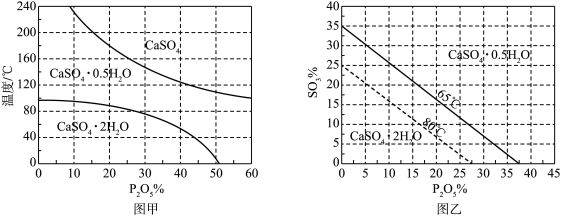
浓度(以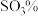 计)在一定范围时,石膏存在形式与温度、
计)在一定范围时,石膏存在形式与温度、 浓度(以
浓度(以 计)的关系如图甲所示。酸解后,在所得
计)的关系如图甲所示。酸解后,在所得 、
、 为45的混合体系中,石膏存在形式为
为45的混合体系中,石膏存在形式为_______ (填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是_______ ,回收利用洗涤液X的操作单元是_______ ;一定温度下,石膏存在形式与溶液中 和
和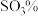 的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是_______ (填标号)。
A. 、
、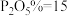 、
、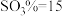 B.
B. 、
、 、
、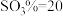
C. 、
、 、
、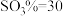 D.
D. 、
、 、
、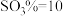
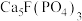 ,含
,含 等杂质]为原料生产磷酸和石膏,工艺流程如下:
等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)酸解时有
 产生。氢氟酸与
产生。氢氟酸与 反应生成二元强酸
反应生成二元强酸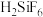 ,离子方程式为
,离子方程式为(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比
 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,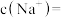
 ;再分批加入一定量的
;再分批加入一定量的 ,首先转化为沉淀的离子是
,首先转化为沉淀的离子是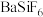 | 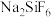 |  |  | |
 |  |  |  | 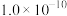 |
 浓度(以
浓度(以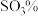 计)在一定范围时,石膏存在形式与温度、
计)在一定范围时,石膏存在形式与温度、 浓度(以
浓度(以 计)的关系如图甲所示。酸解后,在所得
计)的关系如图甲所示。酸解后,在所得 、
、 为45的混合体系中,石膏存在形式为
为45的混合体系中,石膏存在形式为 和
和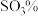 的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
A.
 、
、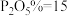 、
、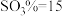 B.
B. 、
、 、
、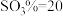
C.
 、
、 、
、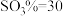 D.
D. 、
、 、
、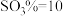
您最近一年使用:0次
2022-06-23更新
|
11825次组卷
|
9卷引用:2022年新高考山东化学高考真题
2022年新高考山东化学高考真题(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)2022年山东省高考真题变式题(非选择题)(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题河北省部分学校2022-2023学年高三上学期10月期中考试化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
8 . 碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25℃, 时:
时:
① 葡萄糖
葡萄糖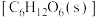 完全燃烧生成
完全燃烧生成 和
和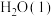 ,放出
,放出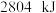 热量。
热量。
②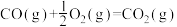
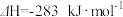 。
。
回答问题:
(1)25℃时, 与
与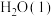 经光合作用生成葡萄糖
经光合作用生成葡萄糖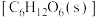 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2)25℃, 时,气态分子断开
时,气态分子断开 化学键的焓变称为键焓。已知
化学键的焓变称为键焓。已知 、
、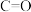 键的键焓分别为
键的键焓分别为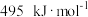 、
、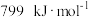 ,
,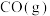 分子中碳氧键的键焓为
分子中碳氧键的键焓为___________  。
。
(3)溶于水的 只有部分转化为
只有部分转化为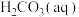 ,大部分以水合
,大部分以水合 的形式存在,水合
的形式存在,水合 可用
可用 表示。已知25℃时,
表示。已知25℃时,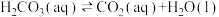 的平衡常数
的平衡常数 ,正反应的速率可表示为
,正反应的速率可表示为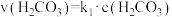 ,逆反应的速率可表示为
,逆反应的速率可表示为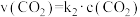 ,则
,则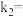
___________ (用含 的代数式表示)。
的代数式表示)。
(4)25℃时,潮湿的石膏雕像表面会发生反应: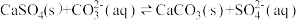 ,其平衡常数
,其平衡常数
___________ 。[已知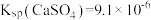 ,
, ]
]
(5)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因___________ 。
 时:
时:①
 葡萄糖
葡萄糖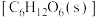 完全燃烧生成
完全燃烧生成 和
和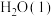 ,放出
,放出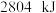 热量。
热量。②
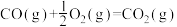
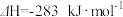 。
。回答问题:
(1)25℃时,
 与
与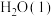 经光合作用生成葡萄糖
经光合作用生成葡萄糖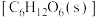 和
和 的热化学方程式为
的热化学方程式为(2)25℃,
 时,气态分子断开
时,气态分子断开 化学键的焓变称为键焓。已知
化学键的焓变称为键焓。已知 、
、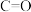 键的键焓分别为
键的键焓分别为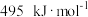 、
、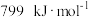 ,
,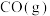 分子中碳氧键的键焓为
分子中碳氧键的键焓为 。
。(3)溶于水的
 只有部分转化为
只有部分转化为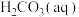 ,大部分以水合
,大部分以水合 的形式存在,水合
的形式存在,水合 可用
可用 表示。已知25℃时,
表示。已知25℃时,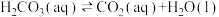 的平衡常数
的平衡常数 ,正反应的速率可表示为
,正反应的速率可表示为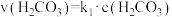 ,逆反应的速率可表示为
,逆反应的速率可表示为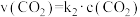 ,则
,则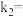
 的代数式表示)。
的代数式表示)。(4)25℃时,潮湿的石膏雕像表面会发生反应:
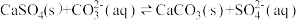 ,其平衡常数
,其平衡常数
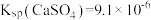 ,
, ]
](5)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因
您最近一年使用:0次
2021-10-23更新
|
6416次组卷
|
4卷引用:2021年新高考海南化学高考真题
9 . 从钒铬锰矿渣(主要成分为 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:
(1)Cr元素位于元素周期表第_______ 周期_______ 族。
(2)用 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数[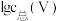 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中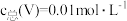 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
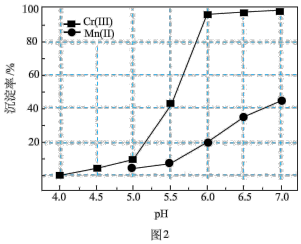
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。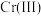 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为_______ ;在该条件下滤液B中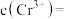
_______  【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: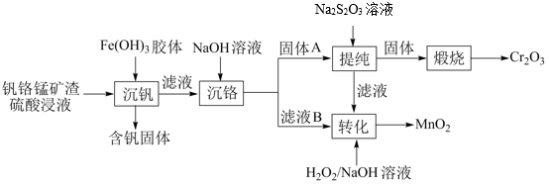
 ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:(1)Cr元素位于元素周期表第
(2)用
 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数[
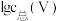 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中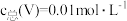 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为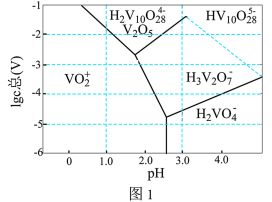
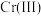 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为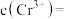
 【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。
 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为
您最近一年使用:0次
2021-09-13更新
|
10773次组卷
|
15卷引用:2021年新高考辽宁化学高考真题
2021年新高考辽宁化学高考真题辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题2021年辽宁高考化学试题变式题11-19(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)05 无机化工流程题(5) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
10 . 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼(
)、钼( )、镍(
)、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下:
)等元素的氧化物,一种回收利用工艺的部分流程如下: 的
的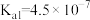 ,
, ;
;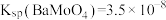 ;
;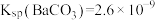 ;该工艺中,
;该工艺中,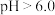 时,溶液中
时,溶液中 元素以
元素以 的形态存在。
的形态存在。
(1)“焙烧”中,有 生成,其中
生成,其中 元素的化合价为
元素的化合价为_______ 。
(2)“沉铝”中,生成的沉淀 为
为_______ 。
(3)“沉钼”中, 为7.0。
为7.0。
①生成 的离子方程式为
的离子方程式为_______ 。
②若条件控制不当, 也会沉淀。为避免
也会沉淀。为避免 中混入
中混入 沉淀,溶液中
沉淀,溶液中
_______ (列出算式)时,应停止加入 溶液。
溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有 和
和 ,
, 为
为_______ 。
②往滤液Ⅲ中添加适量 固体后,通入足量
固体后,通入足量_______ (填化学式)气体,再通入足量 ,可析出
,可析出 。
。
(5)高纯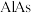 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止
(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层
刻蚀液与下层 (砷化镓)反应。
(砷化镓)反应。_______ 。
②已知: 和
和 同族,
同族, 和
和 同族。在
同族。在 与上层
与上层 的反应中,
的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为_______ 。
 )、钼(
)、钼( )、镍(
)、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下:
)等元素的氧化物,一种回收利用工艺的部分流程如下:
 的
的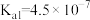 ,
, ;
;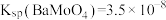 ;
;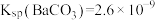 ;该工艺中,
;该工艺中,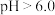 时,溶液中
时,溶液中 元素以
元素以 的形态存在。
的形态存在。(1)“焙烧”中,有
 生成,其中
生成,其中 元素的化合价为
元素的化合价为(2)“沉铝”中,生成的沉淀
 为
为(3)“沉钼”中,
 为7.0。
为7.0。①生成
 的离子方程式为
的离子方程式为②若条件控制不当,
 也会沉淀。为避免
也会沉淀。为避免 中混入
中混入 沉淀,溶液中
沉淀,溶液中
 溶液。
溶液。(4)①滤液Ⅲ中,主要存在的钠盐有
 和
和 ,
, 为
为②往滤液Ⅲ中添加适量
 固体后,通入足量
固体后,通入足量 ,可析出
,可析出 。
。(5)高纯
 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止
(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层
刻蚀液与下层 (砷化镓)反应。
(砷化镓)反应。
②已知:
 和
和 同族,
同族, 和
和 同族。在
同族。在 与上层
与上层 的反应中,
的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为
您最近一年使用:0次
2021-06-11更新
|
14115次组卷
|
27卷引用:2021年新高考广东化学高考真题
2021年新高考广东化学高考真题(已下线)微专题31 化学工艺流程题——原料的预处理-备战2022年高考化学考点微专题(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题重庆市缙云教育联盟2021-2022学年高三9月月度质量检测化学试题2021年广东省高考化学试卷变式题11-21(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题16 热点金属及其化合物制备流程(Li、Sr、Pb、Zn、Ti、Mo)-备战2023年高考化学一轮复习考点微专题(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题内蒙古呼伦贝尔市海拉尔第二中学2022届高三第四次模拟考试理科综合化学试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)易错点08 金属材料-备战2023年高考化学考试易错题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)微专题 无机化工流程题的解题策略2024届黑龙江省齐齐哈尔市高三下学期联合考试模拟预测化学试题



