名校
1 . 燃煤排放大量CO2、SO2、NOx以及固体颗粒物,对环境污染严重。回答下列问题:
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g) =CO2(g) ΔH1 < 0 ①
途径Ⅱ:C(s)+H2O(g) =CO(g)+H2(g) ΔH2 > 0 ②
2CO(g)+O2(g) =2CO2(g) ΔH3 < 0 ③
2H2(g)+O2(g) =2H2O(g) ΔH4 < 0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是________ 。
(2)升高温度时,反应②中H2的产率_____ (填“增大”、“减小”或“不变”)。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式________ 。
(4)可用K2CO3溶液吸收燃煤反应生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为______________ ,0.1 mol/L KHCO3溶液的pH>8,则溶液中c(H2CO3)________ (填“>”“=”或“<”)c(CO )。
)。
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g) =CO2(g) ΔH1 < 0 ①
途径Ⅱ:C(s)+H2O(g) =CO(g)+H2(g) ΔH2 > 0 ②
2CO(g)+O2(g) =2CO2(g) ΔH3 < 0 ③
2H2(g)+O2(g) =2H2O(g) ΔH4 < 0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是
(2)升高温度时,反应②中H2的产率
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式
(4)可用K2CO3溶液吸收燃煤反应生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为
 )。
)。
您最近一年使用:0次
解题方法
2 . T℃下的某溶液中,c(H+)=10-xmol/L,c(OH-)=10-ymol/L,x与y的关系如图所示。请回答下列问题:
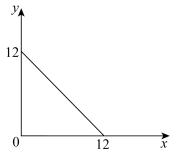
(1)此温度下,水的离子积Kw=________ ,则T________ 25(填“ ”“
”“ ”或
”或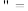 )。
)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
假设溶液混合前后的体积变化忽略不计,则a=________ ,实验②中由水电离产生的c(OH-)=________ mol/L。
(3)在此温度下,将0.1mol/L的NaHSO4溶液与0.1mol/L的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显________ 性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:________ 。
③按甲方式混合后,所得溶液的pH为________ 。
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a________ (填“ ”“
”“ ”或“
”或“ ”)0.01。
”)0.01。

(1)此温度下,水的离子积Kw=
 ”“
”“ ”或
”或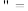 )。
)。(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=
(3)在此温度下,将0.1mol/L的NaHSO4溶液与0.1mol/L的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol/L的Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol/L NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的离子方程式:
③按甲方式混合后,所得溶液的pH为
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a
 ”“
”“ ”或“
”或“ ”)0.01。
”)0.01。
您最近一年使用:0次
2020-09-14更新
|
393次组卷
|
2卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第1节 水与水溶液 课时2 溶液的酸碱性与pH
名校
解题方法
3 . 开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g)+ H2O(g) CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+2H2O(g) CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是__________________ 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g) CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是
CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是_________________ 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25°C时,在20mL0.lmol/L 氢氟酸中加入VmL0.lmol/LNaOH 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________ 。
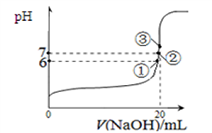
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9. 9×10-7mol/L
C.②点时,溶液中的c(F- )=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0. lmol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,该反应的化学方程式为___________________ 。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g)+ H2O(g)
 CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1CH4(g)+2H2O(g)
 CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
CO2(g)+4H2(g) △H=+165.0 kJ·mol-1上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)
 CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是
CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25°C时,在20mL0.lmol/L 氢氟酸中加入VmL0.lmol/LNaOH 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9. 9×10-7mol/L
C.②点时,溶液中的c(F- )=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0. lmol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,该反应的化学方程式为
您最近一年使用:0次
4 . 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡。经检验该过程产生两种气体,其中一种气体有刺激性气味。
(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是_____________________
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:__________________
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:_________________
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
①上述探究实验1-2选用的盐酸为_____________ (填字母)。
A、1 mol·L-1 B、pH=1.0 C、0.2 mol·L-1 D、pH=5.90
②通过实验对比,说明NH4Cl 水解产生的H+ 对反应影响_____ NH4+ 对反应影响(填“小于”、“大于”或“等于”)。
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素。
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂。
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是___________________
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式_______________ 。

(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
序号 | 实验试剂 | 实验现象 | |
实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
①上述探究实验1-2选用的盐酸为
A、1 mol·L-1 B、pH=1.0 C、0.2 mol·L-1 D、pH=5.90
②通过实验对比,说明NH4Cl 水解产生的H+ 对反应影响
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素。
实验序号 | 实验试剂 | |
实验2-1 | 0.20g镁粉 | |
实验2-2 | 0.20g镁粉 | |
实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂。
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式
您最近一年使用:0次
2017-03-17更新
|
537次组卷
|
2卷引用:2017届辽宁省沈阳市东北育才学校高三第五次模拟考试理综化学试卷
2014高三·全国·专题练习
解题方法
5 . 下表是不同温度下水的离子积常数:
试回答以下问题:
(1)若25℃<T1<T2,则a__________ 1×10-14(填“>”、“<”或“=”),做此判断的理由是______________________________________ 。
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________ 。
(3)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________ 。此溶液中各种离子的浓度由大到小的顺序是____________________________ 。
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是________________ 。
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25℃<T1<T2,则a
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=
(3)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是
您最近一年使用:0次
11-12高二上·江西九江·阶段练习
解题方法
6 . A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是_______ 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式_______ 。
(3)将BA4,D2分别通入插在酸溶液中的两个电极形成燃料电池,则通BA4的一极的电极反应式为_______ 。
(4)化学反应3A2(g)+C2(g)⇌2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),如图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是_______ 。温度为T℃时,将4amolA2和2a molC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为_______ ,平衡时压强为起始压强的_______ 倍。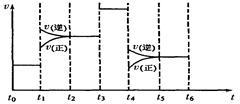
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
(3)将BA4,D2分别通入插在酸溶液中的两个电极形成燃料电池,则通BA4的一极的电极反应式为
(4)化学反应3A2(g)+C2(g)⇌2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),如图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是

您最近一年使用:0次
10-11高一·江苏泰州·期中
7 . (1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数_____ ; ②第3周期元素的最高化合价____ ;
③F-、 Na+ 、Mg2+、Al3+的离子半径___ ;

(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是________________________ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为_________ ,B的化学式是_______ 。
③Z与Y形成的稳定化合物的电子式为__________ 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式:________________________________ ;该反应中转移的电子数目为______ 。
①ⅡA族元素的最外层电子数
③F-、 Na+ 、Mg2+、Al3+的离子半径

(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为
③Z与Y形成的稳定化合物的电子式为
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式:
您最近一年使用:0次



