解题方法
1 . 弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),请回答下面问题:
(1)CH3COONH4的水溶液呈___ (选填“酸性”、“中性”或“碱性”)。理由是___ 。溶液中各离子浓度大小关系是___ 。
温度t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,请回答下列问题:
(2)该温度下水的离子积常数Kw=___ 。
(3)该NaOH溶液中由水电离出的c(OH-)是___ mol/L。
(4)给该NaOH溶液加热(水不挥发),pH=____ 。(填变大、变小或不变)
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
(1)CH3COONH4的水溶液呈
温度t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,请回答下列问题:
(2)该温度下水的离子积常数Kw=
(3)该NaOH溶液中由水电离出的c(OH-)是
(4)给该NaOH溶液加热(水不挥发),pH=
您最近半年使用:0次
2 . 已知水在25 ℃和100 ℃时,电离平衡曲线如图所示:

(1)25 ℃时水的电离平衡曲线应为________ (填“A”或“B”),请说明理由____________ 。
(2)下列措施能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的是_____ (填序号)。
A 向纯水中投入少量Na2O2固体 B 将水加热至煮沸
C 向水中通入CO2 D 向水中加入NaCl

(1)25 ℃时水的电离平衡曲线应为
(2)下列措施能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的是
A 向纯水中投入少量Na2O2固体 B 将水加热至煮沸
C 向水中通入CO2 D 向水中加入NaCl
您最近半年使用:0次
名校
解题方法
3 . 按要求作答。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量。写出CH4燃烧的热化学方程式__________________ 。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:①P4(白磷,s)+5O2(g)=P4O10(s)ΔH1=-2983.2kJ·mol-1
②P(红磷,s)+ O2(g)=1/4P4O10(s)ΔH2=-738.5kJ·mol-1
O2(g)=1/4P4O10(s)ΔH2=-738.5kJ·mol-1
相同状况下,能量较低的是________ ;白磷的稳定性比红磷________ (填“大”或“小”)。
(3)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
Na2CO3俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式:
第一步水解的离子方程式:__________________________________________ 。
(4)在某温度下, 的离子积常数为
的离子积常数为 ,则该温度下:
,则该温度下:
 溶液的
溶液的
________ 。
(5)已知一溶液有4种离子:X+、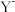 、
、 、
、 ,下列分析结果肯定错误的是
,下列分析结果肯定错误的是________ (填序号)。
A. B.
B.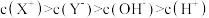
C.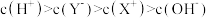 D.
D.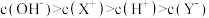
(6)在25℃下,将 的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中
的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中 ,则溶液显
,则溶液显________ (填“酸”“碱”或“中”)性。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量。写出CH4燃烧的热化学方程式
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:①P4(白磷,s)+5O2(g)=P4O10(s)ΔH1=-2983.2kJ·mol-1
②P(红磷,s)+
 O2(g)=1/4P4O10(s)ΔH2=-738.5kJ·mol-1
O2(g)=1/4P4O10(s)ΔH2=-738.5kJ·mol-1相同状况下,能量较低的是
(3)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
Na2CO3俗称纯碱,因
 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式:
第一步水解的离子方程式:(4)在某温度下,
 的离子积常数为
的离子积常数为 ,则该温度下:
,则该温度下: 溶液的
溶液的
(5)已知一溶液有4种离子:X+、
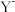 、
、 、
、 ,下列分析结果肯定错误的是
,下列分析结果肯定错误的是A.
 B.
B.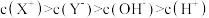
C.
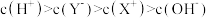 D.
D.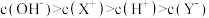
(6)在25℃下,将
 的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中
的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中 ,则溶液显
,则溶液显
您最近半年使用:0次
名校
4 . 升高温度,下列数据不一定增大的是
| A.化学平衡常数 K | B.水的离子积 Kw |
| C.化学反应速率 | D.醋酸的电离平衡常数 Ka |
您最近半年使用:0次
2020-11-04更新
|
290次组卷
|
6卷引用:吉林省梅河口市朝鲜族中学2019-2020学年高二上学期期末考试化学试题
吉林省梅河口市朝鲜族中学2019-2020学年高二上学期期末考试化学试题吉林省抚松县第一中学2021-2022学年高二上学期第二次月考(平行班)化学试题重庆市合川实验中学2020-2021学年高二上学期期中考试化学试题河北省石家庄第四十一中学2020-2021学年高二上学期期中考试化学试题(已下线)专题3.2.1 水的电离和溶液的酸碱性(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)黑龙江省牡丹江市第三高级中学2023-2024学年高二上学期期中考试化学试题
名校
5 . 25 ℃的下列溶液中,碱性最强的是
| A.pH=11的溶液 | B.c(OH-)=0.12 mol·L-1的溶液 |
| C.含有4 g NaOH的1 L溶液 | D.c(H+)=1×10-10 mol·L-1的溶液 |
您最近半年使用:0次
2020-11-03更新
|
691次组卷
|
25卷引用:2015-2016学年吉林省长春外国语学校高二上学期期末化学试卷
2015-2016学年吉林省长春外国语学校高二上学期期末化学试卷吉林省白山市抚松县第五中学2020-2021学年高二上学期期中考试化学试题吉林省汪清县第六中学2021-2022学年高二上学期期中考试化学试题吉林省长春市第二实验中学2021-2022学年高二上学期10月月考化学试题吉林省白城市第十四中学2021-2022学年高二上学期期中考试化学试卷题2015-2016学年河南省三门峡市陕州中学高二上学期期中测试化学试卷高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时(溶液的酸碱性与pH)黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题高二人教版选修4 第三章 第二节 水的电离和溶液的酸碱性黑龙江省鸡西市鸡东县第二中学2019-2020学年高二上学期期中考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第1节 水与水溶液广东省东莞市第四高级中学2020-2021学年高二上学期期中考试化学试题湖北省巴东县第二高级中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】【2021.4.27】【温州】【高二上】【高中化学】【00197】云南省玉溪市峨山一中2021—2022学年高二下学期3月月考化学试题黑龙江省饶河县高级中学2022-2023学年高二上学期期中考试化学试题(已下线)3.2.2 pH计算和酸碱中和滴定-同步学习必备知识黑龙江省饶河县高级中学2021-2022学年高二上学期期中考试化学试题辽宁省大连庄河市高级中学2022-2023学年高二上学期12月月考化学(B卷)试题3.2.1溶液的酸碱性 课前黑龙江省齐齐哈尔市第八中学校2023-2024学年高二上学期期中考试化学试题陕西省西安中学2023-2024学年高二上学期第二次月考化学试题陕西省汉中市城固县城固县第二中学2023-2024学年高二上学期11月期中考试化学试题山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题
名校
解题方法
6 . 95℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是
| A.此时水的离子积Kw=1×10﹣12 | B.水电离出的c(H+)=1×10﹣12mol/L |
| C.水的电离程度随温度升高而增大 | D.c(Na+)=c( ) ) |
您最近半年使用:0次
2020-11-02更新
|
208次组卷
|
7卷引用:吉林省梅河口市第五中学2021-2022学年高二上学期第一次月考化学试题
吉林省梅河口市第五中学2021-2022学年高二上学期第一次月考化学试题(已下线)2013-2014学年黑龙江省哈师大附中高二上学期期中化学试卷(已下线)2014届陕西省西安市西安中学高三第四次质量检测化学试卷(已下线)2014陕西省西安中学高三上学期第四次质量检测化学试卷黑龙江省孙吴县第一中学2017-2018学年高二上学期期中考试化学试题黑龙江省大庆中学2019-2020学年高二上学期期中考试化学试题湖南省嘉禾县第五中学2019—2020学年高二下期期中考试化学试题(选考)
名校
7 . 一定温度下,用水稀释0.1mol/L的一元弱酸HA,随着稀释的进行,下列数值一定增大的是(KW表示水的离子积)( )
| A.KW | B.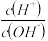 | C. | D.c(OH-) |
您最近半年使用:0次
2020-09-14更新
|
633次组卷
|
14卷引用:吉林省长春北师大附属学校2021-2022学年高二上学期第一次月考化学试题
吉林省长春北师大附属学校2021-2022学年高二上学期第一次月考化学试题吉林省吉林市第五十五中学2021-2022学年高二上学期期中考试化学试题(已下线)福建省泉州市2010年高中毕业班五月质量检测理综化学部分四川省成都市实验中学2017-2018学年高二上学期期中考试化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第二次月考化学试题内蒙古呼和浩特市土默特左旗第一中学2019-2020学年高二上学期第二次月考化学试题山西省实验中学2020届高三化学复习针对性试题集(三)鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第1节 水与水溶液 课时2 溶液的酸碱性与pH高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 课时1 水的电离 溶液的酸碱性与pH(已下线)练习6 电离平衡与溶液的PH-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)黑龙江省大庆市大庆铁人中学2021-2022学年高二上学期第一次月考化学试题新疆和田地区皮山县高级中学2021-2022学年高二上学期期末考试化学试题天津市第二十一中学2022-2023学年高二上学期期中调研化学试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
名校
解题方法
8 . (1)常温下,0.05mol/L硫酸溶液中,c(H+)=_______ mol/L,pH值为_____ ,水电离的c(H+)=_______ mol/L
(2)某温度下,纯水中c(H+)=2×10-7mol/L,滴入盐酸使c(H+) =5×10-6mol/L,则c(OH-) =_________ mol/L
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示:
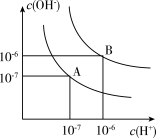
①95℃时,若10体积pH1=a的盐酸与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前a、b之间应满足的关系是______________ 。
②25℃时,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,则NaOH溶液与H2SO4溶液的体积比为__________________ 。
③曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:________________________ 。
(2)某温度下,纯水中c(H+)=2×10-7mol/L,滴入盐酸使c(H+) =5×10-6mol/L,则c(OH-) =
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示:

①95℃时,若10体积pH1=a的盐酸与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前a、b之间应满足的关系是
②25℃时,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,则NaOH溶液与H2SO4溶液的体积比为
③曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:
您最近半年使用:0次
2020-08-06更新
|
210次组卷
|
4卷引用:吉林省乾安县第七中学2021-2022学年高二上学期第三次质量检测化学试题
名校
解题方法
9 . 常温下,下列各组离子一定能在指定溶液中大量共存的是
A.投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、 |
B.0.1 mol/L FeCl3溶液中:Na+、Ba2+、 、SCN- 、SCN- |
C.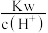 =1×10-13 mol/L的溶液中: =1×10-13 mol/L的溶液中: 、Ca2+、Cl-、 、Ca2+、Cl-、 |
D.水电离的c(OH-)=1×10-13 mol/L的溶液中:K+、Na+、 、 、 |
您最近半年使用:0次
名校
解题方法
10 . 在温度不变的条件下,将氨水加水稀释,随着水的加入,下列关系式的数值变小的是( )
| A.n(OH-) | B. |
C. | D. |
您最近半年使用:0次
2020-08-04更新
|
112次组卷
|
6卷引用:吉林省长春市一五O中2018-2019学年高二上学期期中考试化学试题



