解题方法
1 . 常温下:
(1)在0.001 mol/L HCl溶液中,c(H+)=___________ ,c(OH-)=___________ 。
(2)在0.001 mol/L NaOH溶液中,c(H+)=___________ ,由水电离出的c(H+)=___________ 。
(3)在pH=3的NH4Cl溶液中,水电离出的c(H+)=___________ 。
(1)在0.001 mol/L HCl溶液中,c(H+)=
(2)在0.001 mol/L NaOH溶液中,c(H+)=
(3)在pH=3的NH4Cl溶液中,水电离出的c(H+)=
您最近一年使用:0次
2 . 完成下列问题。
(1)4g硫粉在 中完全燃烧生成
中完全燃烧生成 气体,放出37kJ的热量,写出S燃烧的热化学方程式
气体,放出37kJ的热量,写出S燃烧的热化学方程式____ 。
(2)某反应的反应物A浓度在5min内由6mol·L-1变成了2mol·L-1,则v(A)=_______ 。
(3)反应A(g)+B(s)⇌C(g) ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“增大”、“不变”、“减小”):
①升温_______ ;
②增大压强_______ ;
③加正催化剂_______ 。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)。
Si3N4(s)+6CO(g)。
①该反应的平衡常数表达式为K=_______ ;
②若知上述反应为吸热反应,升高温度,其平衡常数值_______ (填“增大”、“减小”或“不变”)。
(5)在密闭容器中的可逆反应CO(g)+NO2(g)⇌CO2(g)+NO(g) ΔH<0。达到平衡后:
①扩大容器体积,平衡_______ 移动(填“正向”、“逆向”、“不”),c(NO2)将_______ (填“增大”、“减小”、“不变”),反应混合物的颜色将变_______ (填“深”、“浅”、“不变”)。
②升高温度平衡_______ 移动(填“正向”、“逆向”、“不”),
(6)①水的离子积常数Kw表达式:_______ 常温下,水的离子积常数Kw=_______ mol2·L-2。
②影响因素:i.水的离子积常数只受_______ 的影响,ii.升高温度,Kw_______ 。
(7)常温下,溶液的酸碱性与pH的关系是:pH=7,溶液呈_______ ,pH越小,溶液的酸性越_______ ,溶液的碱性越_______ ,pH的适用范围是_______ 。
(8) 水解的离子方程式为
水解的离子方程式为_______ 。
(1)4g硫粉在
 中完全燃烧生成
中完全燃烧生成 气体,放出37kJ的热量,写出S燃烧的热化学方程式
气体,放出37kJ的热量,写出S燃烧的热化学方程式(2)某反应的反应物A浓度在5min内由6mol·L-1变成了2mol·L-1,则v(A)=
(3)反应A(g)+B(s)⇌C(g) ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“增大”、“不变”、“减小”):
①升温
②增大压强
③加正催化剂
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g)。
Si3N4(s)+6CO(g)。①该反应的平衡常数表达式为K=
②若知上述反应为吸热反应,升高温度,其平衡常数值
(5)在密闭容器中的可逆反应CO(g)+NO2(g)⇌CO2(g)+NO(g) ΔH<0。达到平衡后:
①扩大容器体积,平衡
②升高温度平衡
(6)①水的离子积常数Kw表达式:
②影响因素:i.水的离子积常数只受
(7)常温下,溶液的酸碱性与pH的关系是:pH=7,溶液呈
(8)
 水解的离子方程式为
水解的离子方程式为
您最近一年使用:0次
解题方法
3 . 常温下,下列说法正确的是
A.将 的HCl溶液稀释1000倍后pH变为8 的HCl溶液稀释1000倍后pH变为8 |
B.将 的NaOH溶液稀释1000倍后pH变为6 的NaOH溶液稀释1000倍后pH变为6 |
C.将 的HCl溶液加热蒸发,体积变为原来的 的HCl溶液加热蒸发,体积变为原来的 ,pH变为3 ,pH变为3 |
D.将 的醋酸溶液稀释100倍后, 的醋酸溶液稀释100倍后,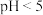 |
您最近一年使用:0次
4 . 平衡常数
盐是一类常见的电解质,实验表明盐溶液不一定呈中性,也可能呈酸性和碱性。
(1) 、
、 、
、 的水溶液分别呈
的水溶液分别呈___________ 性、___________ 性、___________ 性。水的电离平衡常数K电离=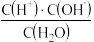 ,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。
,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。
(2)25℃时,c(H+)=c(OH-)=___________ mol/L;KW=c(H+)·c(OH-)=___________
(3)Kw的影响因素,水的离子积Kw,只受___________ 的影响,___________ ,Kw增大。
(4)25℃时,H2SO3 HSO
HSO +H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh=
+H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh=___________ mol/L。
盐是一类常见的电解质,实验表明盐溶液不一定呈中性,也可能呈酸性和碱性。
(1)
 、
、 、
、 的水溶液分别呈
的水溶液分别呈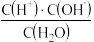 ,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。
,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。(2)25℃时,c(H+)=c(OH-)=
(3)Kw的影响因素,水的离子积Kw,只受
(4)25℃时,H2SO3
 HSO
HSO +H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh=
+H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh=
您最近一年使用:0次
名校
解题方法
5 .  时,水的电离达到平衡:
时,水的电离达到平衡: ,下列叙述正确的是
,下列叙述正确的是
 时,水的电离达到平衡:
时,水的电离达到平衡: ,下列叙述正确的是
,下列叙述正确的是A.向水中加入稀氨水,平衡逆向移动, 降低 降低 |
B.向水中加入少量固体硫酸氢钠, 增大, 增大, 不变 不变 |
C.向水中加入少量固体氯化铵,平衡逆向移动, 增大 增大 |
D.将水加热, 增大, 增大, 不变 不变 |
您最近一年使用:0次
名校
6 . 下列叙述正确的是
| A.将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 |
| B.常温下将pH=11的氨水稀释后,溶液中所有离子浓度均降低 |
| C.25℃时将100mLpH=a的稀硫酸与10mLpH=b的NaOH溶液混合后呈中性,则a+b=15 |
| D.向水中加入少量硫酸氢钠溶液,c(H+)增大,Kw增大 |
您最近一年使用:0次
2024-02-13更新
|
161次组卷
|
2卷引用:新疆乌鲁木齐市第101中学2023-2024学年高二上学期1月期末化学试题
7 . 请回答下列问题:
(1)如图所示的铜-锌原电池中:

铜片为___________ 极,发生___________ 反应;锌片为___________ 极,发生___________ 反应。
(2)某种酱油的pH=5,则该酱油中的c(H+)=___________ 。
(3)在常温下,柠檬水的pH=3,其中的c(OH-)为___________ (填字母)。
a.0.1mol/L b.1×10-3mol/L c.1×10-7mol/L d.1×10-11mol/L
(4)按照电解池的原理,电解熔融CaCl2:阳极反应为___________ ;阴极反应为___________ ;总反应为___________ 。
(1)如图所示的铜-锌原电池中:

铜片为
(2)某种酱油的pH=5,则该酱油中的c(H+)=
(3)在常温下,柠檬水的pH=3,其中的c(OH-)为
a.0.1mol/L b.1×10-3mol/L c.1×10-7mol/L d.1×10-11mol/L
(4)按照电解池的原理,电解熔融CaCl2:阳极反应为
您最近一年使用:0次
名校
解题方法
8 . NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1 mol•L-1NH4Al(SO4)2溶液的pH=3。
①溶液的Kw=___________ (填数值),由水电离的c(H+)=___________ mol•L-1。
②溶液中c( )+c(NH3•H2O)
)+c(NH3•H2O)___________ c(Al3+)+c(Al(OH)3)(填“>”、“=”、“<”);2c( )-c(
)-c( )-3c(Al3+)=
)-3c(Al3+)=___________ mol/L。
(2)常温时,向100 mL0.1 mol•L-1NH4HSO4溶液中滴加0.1 mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。

①向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为___________ 。
②图中a、b、c、d四个点中水的电离程度最小的是___________ ,
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是___________ 。
(1)常温时,0.1 mol•L-1NH4Al(SO4)2溶液的pH=3。
①溶液的Kw=
②溶液中c(
 )+c(NH3•H2O)
)+c(NH3•H2O) )-c(
)-c( )-3c(Al3+)=
)-3c(Al3+)=(2)常温时,向100 mL0.1 mol•L-1NH4HSO4溶液中滴加0.1 mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。

①向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
②图中a、b、c、d四个点中水的电离程度最小的是
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
9 . 计算题。
(1)常温下,某溶液中由水电离出的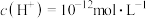 ,则该溶液的
,则该溶液的 为
为________ 。
(2)某温度下,纯水中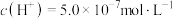 ,则该温度下的
,则该温度下的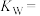
________ ,若温度不变,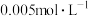 的
的 溶液中,
溶液中,
________ ,由水电离出的
________ 。
(3)将 的盐酸稀释1000倍后,
的盐酸稀释1000倍后, 为
为________ 。
(4)25℃时,将 溶液与
溶液与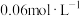 的
的 溶液等体积混合,(忽略混合后体积的变化),求所得溶液的
溶液等体积混合,(忽略混合后体积的变化),求所得溶液的 为
为________ 。
(1)常温下,某溶液中由水电离出的
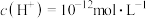 ,则该溶液的
,则该溶液的 为
为(2)某温度下,纯水中
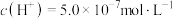 ,则该温度下的
,则该温度下的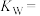
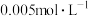 的
的 溶液中,
溶液中,

(3)将
 的盐酸稀释1000倍后,
的盐酸稀释1000倍后, 为
为(4)25℃时,将
 溶液与
溶液与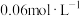 的
的 溶液等体积混合,(忽略混合后体积的变化),求所得溶液的
溶液等体积混合,(忽略混合后体积的变化),求所得溶液的 为
为
您最近一年使用:0次
名校
解题方法
10 . 2023年8月23日,日本政府无视全世界人们的反对,公然向海洋中排放核污染水,核污染水中包括氚(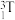 )在内的64种核放射性物质。温度为:
)在内的64种核放射性物质。温度为: ℃时,氚水(
℃时,氚水(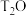 )的
)的 。若
。若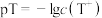 ,温度为:
,温度为: ℃时,下列说法正确的是
℃时,下列说法正确的是
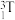 )在内的64种核放射性物质。温度为:
)在内的64种核放射性物质。温度为: ℃时,氚水(
℃时,氚水(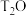 )的
)的 。若
。若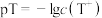 ,温度为:
,温度为: ℃时,下列说法正确的是
℃时,下列说法正确的是| A.氚水无放射性,对环境没有危害 |
| B.纯净的氚水显中性,其pT=7 |
C.pT=13的NaOT的氚水溶液中,由氚水电离出的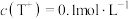 |
| D.1.0L含0.385gTCl的氚水溶液的pT=2 |
您最近一年使用:0次
2024-01-07更新
|
68次组卷
|
3卷引用:新疆维吾尔自治区乌鲁木齐八一中学2023-2024学年高二上学期1月期末化学试题



