名校
解题方法
1 . 常温条件下,向V1mL浓度均为c mol·L-1的弱酸HA和HCl混合溶液中逐滴加入0.1mol·L-1弱碱BOH,溶液的导电能力随BOH溶液加入量的变化如图所示(忽略溶液混合时的体积变化)。下列说法错误的是


| A.c = 0.1 mol·L-1 |
| B.b点溶液中c(B+) +c( BOH) =c(A-) +c( HA) |
| C.若c点溶液中c(BOH) >2c(HA),则BA溶液显碱性 |
| D.滴加BOH溶液过程中,水的电离程度先增大后减小 |
您最近一年使用:0次
2022-06-03更新
|
496次组卷
|
9卷引用:河南省部分名校2021-2022学年高三上学期模拟调研(三)理科综合化学试题
河南省部分名校2021-2022学年高三上学期模拟调研(三)理科综合化学试题(已下线)三轮冲刺卷03-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)宁夏回族自治区银川一中2022届高三第四次模拟理综化学试题(已下线)卷04 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)湖南省长沙市长郡中学2022-2023学年高二上学期期末考试化学试题湖南省邵东市第一中学2022-2023学年高二下学期3月月考化学试题湖南省衡阳市八中2023-2024学年高二上学期第三次月考化学试题广东省汕头市金山中学2023-2024学年高二上学期期末考试 化学试题江西省宜春市宜丰中学2023-2024学年高一上学期1月期末化学试题
名校
2 . 室温下,向10mL浓度均为0.1mol/L的CuCl2、FeC12和ZnCl2溶液中分别滴加等浓度的Na2S溶液,滴加过程中pc[pc=-1gc(M2+),M2+为Cu2+或Fe2+或Zn2+]与Na2S溶液体积的关系如图所示。已知:Ksp(CuS)<Ksp(ZnS),Ksp(FeS)=6.25×10-18,lg25=1.4。下列说法错误的是


| A.m=8.6 |
| B.a点的CuCl2溶液中:c(H+)=c(OH-)+2c[Cu(OH)2] |
| C.a→d→g的过程中,水的电离程度经历由大到小后又增大的过程 |
| D.将足量ZnCl2晶体加入0.1mol/L的Na2S溶液中,c(Zn2+)最大可达到10-24.4mol·L-1 |
您最近一年使用:0次
2022-06-02更新
|
537次组卷
|
3卷引用:山东师范大学附属中学2022届高三考前预测化学试题
山东师范大学附属中学2022届高三考前预测化学试题河南省顶级名校2022-2023学年高三上学期第一次月考化学试题(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
名校
解题方法
3 . 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。用0.100 mol∙L−1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100 mol∙L−1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是


| A.A点溶液中:c(CH3COO-)+c(OH-) −c(H+)=0.1 mol∙L−1 |
| B.B点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.相同温度下,C点水的电离程度大于A点 |
| D.由PA段电导率变化趋势可知,K+的导电能力强于H+ |
您最近一年使用:0次
2022-05-31更新
|
333次组卷
|
3卷引用:上海市南洋模范中学2022届高三等级考模拟训练七化学试题
名校
解题方法
4 . 甘油硼酸是一种一元有机弱酸,可简写为HM。常温下,向20 mL 0.2 mol·L-1HM溶液中逐滴加入浓度为0.2 mol·L-1的NaOH溶液,溶液中 、pH、中和率(中和率=
、pH、中和率(中和率= )的变化如图所示。
)的变化如图所示。

下列说法正确的是
 、pH、中和率(中和率=
、pH、中和率(中和率= )的变化如图所示。
)的变化如图所示。
下列说法正确的是
| A.HM的电离常数数量级为10-5 |
| B.a点时,c(HM)+c(M- )= 2c(Na+ ) |
| C.b点时,c(M- )>c(Na +)>c(H+ )>c(OH- ) |
| D.溶液中水的电离程度: c点<b点 |
您最近一年使用:0次
2022-05-26更新
|
371次组卷
|
2卷引用:辽宁省鞍山市第一中学2022届高三下学期六模化学试题
名校
5 . 某化学兴趣小组在学习完温度对盐类水解的影响后,测定了0.1mol·L-1Na2CO3溶液的pH随温度的变化,结果如下图所示。下列分析正确的是

A.升温前溶液呈碱性的原因是:CO +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
B.常温下,0.1 mol·L-1Na2CO3溶液中:c(Na+)>2c(CO )+c(HCO )+c(HCO ) ) |
| C.温度升高,Na2CO3水解程度增大,溶液pH增大,故图1实验数据一定错误 |
| D.降低温度,Na2CO3水解平衡移动和水的电离平衡移动对溶液pH的影响一致 |
您最近一年使用:0次
2022-05-22更新
|
440次组卷
|
5卷引用:河南省郑州市2022届高三第三次质量预测理综化学试题
河南省郑州市2022届高三第三次质量预测理综化学试题河南省驻马店市2021-2022学年高二下学期期末考试化学试题(已下线)专题13 水溶液中的离子平衡-备战2023年高考化学母题题源解密(全国通用)河南省洛阳市第一高级中学2023届高三上学期8月调研考试化学试题河南省封丘县2022-2023学年高三上学期9月第一次月考化学试题
名校
6 . 常温下,某实验人员在两个相同的容器中分别加入20 mL 0.2 mol/LNa2A溶液和40 mL 0.1 mol/L NaHA溶液,再分别用0.2mol/L盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(H2A溶液达到某浓度后,会放出一定量气体)下列说法正确的是(溶液体积变化可忽略)
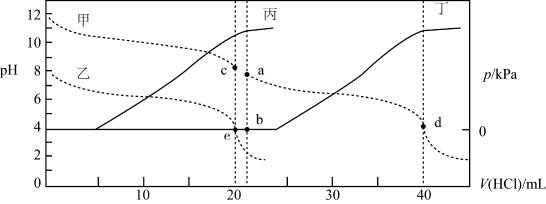

| A.图中曲线乙和丁代表向NaHA溶液中滴加盐酸 |
| B.由图可知,Ka1×Ka2>Kw |
| C.c点pH约为8,且此时溶液中满足:c(Na+)+c(H+)<2c(A2-)+2c(H2A)+c(HA-) |
| D.水的电离程度:b点>d点 |
您最近一年使用:0次
名校
7 . 常温下,向饱和氯水中以恒定速率滴加NaOH稀溶液,溶液pH随时间的变化如下图所示。若溶液中氯元素仅考虑以HClO、Cl2、Cl-、ClO-形式存在,且HClO不分解,下列说法错误的是


A.M点: |
| B.水的电离程度:M点<N点 |
C.反应过程中存在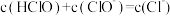 |
D.从M点到P点,溶液中的 值减小 值减小 |
您最近一年使用:0次
2022-05-09更新
|
200次组卷
|
3卷引用:湖南省湘潭市第一中学2022届高三下学期第三次模拟考试化学试题
名校
8 . 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。常温下,利用盐酸滴定某溶液中亚磷酸钠 的含量,其电位滴定曲线与
的含量,其电位滴定曲线与 曲线如图所示。下列说法正确的是
曲线如图所示。下列说法正确的是

已知:亚磷酸 是二元弱酸,电离常数
是二元弱酸,电离常数 ,
,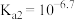 。
。
 的含量,其电位滴定曲线与
的含量,其电位滴定曲线与 曲线如图所示。下列说法正确的是
曲线如图所示。下列说法正确的是
已知:亚磷酸
 是二元弱酸,电离常数
是二元弱酸,电离常数 ,
,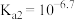 。
。| A.a点对应的溶液呈弱碱性 |
| B.水的电离程度:a点小于b点 |
C.a点对应的溶液中存在: |
D.b点对应的溶液中存在: |
您最近一年使用:0次
2022-05-09更新
|
430次组卷
|
3卷引用:福建省莆田市2022届高三下学期第三次质量检测化学试题
名校
9 . 常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNaOH溶液,溶液中各微粒的物质的量分数随pH的变化如图所示,以下说法不正确的是


| A.由图可推测,H2X为弱酸 |
| B.滴加过程中发生的反应有:H2X+OH-=HX-+H2O,HX-+OH-=X2-+H2O |
| C.水的电离程度:a点与b点大致相等 |
| D.若常温下Ka(HY)=1.1×10-2,HY与少量Na2X发生的反应是:2HY+X2-=H2X+2Y- |
您最近一年使用:0次
2022-05-06更新
|
824次组卷
|
11卷引用:北京市昌平区2022届高三二模化学试题
北京市昌平区2022届高三二模化学试题北京市育才学校2022届高三下学期三模化学试题(已下线)专题13 水溶液中的离子平衡-备战2023年高考化学母题题源解密(全国通用)湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题黑龙江省哈尔滨市实验中学2022-2023学年高三上学期期中考试化学试题山东省青岛市莱西市2022-2023学年高二上学期12月期末考试化学试题黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期期末考试化学试卷天津市重点校2023-2024学年高二上学期期末考试化学试题湖北省沙市中学2023-2024学年高二上学期1月期末化学试题黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学验收考试化学黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学化学试题
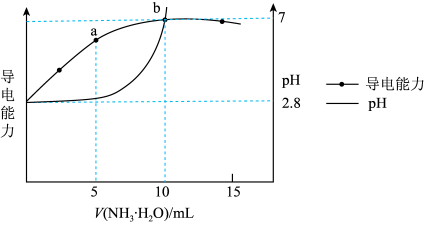
名校
10 . 常温时,向 溶液中逐滴加入
溶液中逐滴加入 的氨水,导电能力、pH与
的氨水,导电能力、pH与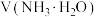 的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是
的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是
 溶液中逐滴加入
溶液中逐滴加入 的氨水,导电能力、pH与
的氨水,导电能力、pH与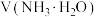 的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是
的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是
A.水的电离程度: |
B.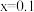 ,该温度下的 ,该温度下的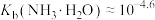 |
C.该温度下反应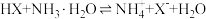 的平衡常数的数量级为 的平衡常数的数量级为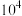 |
D.a点对应的溶液中存在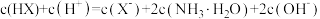 |
您最近一年使用:0次
2022-04-22更新
|
2079次组卷
|
9卷引用:云南省2022届高三第二次高中毕业生复习统一检测理科综合能力测试化学试题
云南省2022届高三第二次高中毕业生复习统一检测理科综合能力测试化学试题福建省厦门双十中学2022届高三热身考化学试题福建省永春第一中学2023届高三下学期适应性考试(五)化学试题(已下线)专题10水溶液中的离子平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题10水溶液中的离子平衡-2022年高考真题+模拟题汇编(全国卷)(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国乙卷高考变式题(选择题)湖南省株洲市天元区名校2022-2023学年高二上学期12月月考化学试题(已下线)学科特色3 电解质溶液图像



