10-11高二上·江西上饶·期中
名校
1 . 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的________ (填“甲”或“乙”)滴定管中。
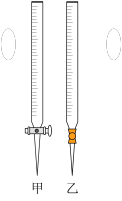
(2)本实验滴定达到终点的标志是___________________ 。
(3)通过上述数据,求得x=________ 。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________ (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________ 。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的

(2)本实验滴定达到终点的标志是
(3)通过上述数据,求得x=
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会
您最近一年使用:0次
2019-11-19更新
|
764次组卷
|
30卷引用:广西桂林市第十八中学2016-2017学年高二下学期期中考试化学试题
广西桂林市第十八中学2016-2017学年高二下学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题(已下线)2010年江西省德兴市四校联考高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市曲阜一中高二上学期期末模拟化学试卷(已下线)2011-2012学年福建省罗源一中高二上学期期末考试化学试卷2014-2015浙江省杭州市西湖中学高二12月月考化学试卷2014-2015学年浙江省江山实验中学高二4月教学质量检测化学试卷2015-2016学年山西省太原五中高二上12月月考化学试卷12015-2016学年山西省太原五中高二上12月月考化学试卷22015-2016学年福建省长泰县第一中学高二上学期期末化学试卷2015-2016学年河南省南阳一中高二下期末模拟化学试卷湖北省荆门市2016-2017学年高二下学期期末质量检测化学试题河南省豫北重点中学2017-2018学年高二12月联考化学试题【全国百强校】贵州省思南中学2018-2019学年高二上学期第二次月考化学试题(已下线)2019年1月2日 《每日一题》人教选修4-酸碱中和滴定陕西省黄陵中学2018-2019学年高二(普通班)上学期期末考试化学试题步步为赢 高二化学暑假作业:作业十 水溶液中的离子平衡浙江省宁波市北仑中学2019-2020学年高二上学期期中考试化学(2-10班)试题(已下线)2019年12月27日 《每日一题》人教版(选修4)——酸碱中和滴定江苏省宿豫中学2019-2020学年度高二下学期调研测试(奥赛班)化学试题四川省成都市第七中学2019-2020学年高二下学期零诊模拟考试化学人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 易错疑难集训(二)辽宁省沈阳市第八十三中学2021-2022学年高二上学期期初考试化学试题(已下线)高中化学《新教材变化解读与考法剖析》第三章 水溶液中的离子反应与平衡(人教版2019选择性必修1)江西省抚州市南城县第二中学2021-2022年高二上学期第二次月考化学试题云南省玉溪市通海县第一中学2021-2022学年高二上学期期末考试化学试题河北省保定市博野中学2021-2022学年高二上学期期中考试化学试题河南省温县第一高级中学2022-2023学年高二上学期第二次月考化学试题河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学(宏奥班)试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题
2014高三·全国·专题练习
名校
解题方法
2 . 化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中碳酸钠的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为____________ 。
(2)实验中,需加热至恒重的目的是_____________ 。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量氢氧化钡溶液,过滤、洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-=BaCO3↓+H2O)。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为__________ 。
(2)实验中判断沉淀是否完全的方法是__________ 。
[方案三]按如下图所示装置进行实验:

(1)D装置的作用是________ ,分液漏斗中_____ (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中碳酸钠的质量分数为________ 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是_________ 。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为
(2)实验中,需加热至恒重的目的是
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量氢氧化钡溶液,过滤、洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-=BaCO3↓+H2O)。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)实验中判断沉淀是否完全的方法是
[方案三]按如下图所示装置进行实验:

(1)D装置的作用是
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中碳酸钠的质量分数为
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是
您最近一年使用:0次
2019-06-20更新
|
184次组卷
|
7卷引用:广西河池市都安县第二高级中学2019-2020学年高一上学期期末考试化学试题
名校
3 . 25℃时,体积均为20 mL、浓度均为0.1mol/L的两种酸HX、HY分别与0.1mol/L的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )


| A.加入10 mL NaOH溶液时,a点c(X−)<b点c(Y−) |
| B.HY中加NaOH溶液至pH=7时,所得溶液中c(Y−)=c(Na+)=c(OH−)=c(H+) |
| C.b点溶液中,c(Y−)+2c(OH−)=c(HY)+2c(H+) |
| D.25℃时,HX为强酸,HY为弱酸且Ka=10−8 |
您最近一年使用:0次
2019-06-12更新
|
420次组卷
|
4卷引用:广西南宁市第三中学、柳州市高级中学2018-2019学年高二下学期联考(第三次月考)化学试题
广西南宁市第三中学、柳州市高级中学2018-2019学年高二下学期联考(第三次月考)化学试题济宁市高三第二次模拟考试理科综合(化学)部分试题(已下线)《考前20天终极攻略》6月4日 专项四 化学坐标曲线图分析江西省山江湖协作体2021-2022学年高二上学期联考(统招班)化学试题
4 . 立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________ (填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
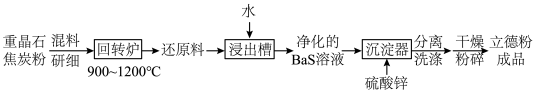
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________ 。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________ 。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________ (填化学式)。
③沉淀器中反应的离子方程式为______________________ 。
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________ ,样品中S2−的含量为______________ (写出表达式)。
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的
③沉淀器中反应的离子方程式为
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2
 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
您最近一年使用:0次
2019-06-09更新
|
16247次组卷
|
25卷引用:广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题
广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题2019年全国统一考试化学试题(新课标Ⅱ)2020届人教版高三化学二轮复习非选择题专攻练——工艺流程专题3.1 金属及其化合物(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题讲座(八) 无机化工流程题的解题策略(精讲)——2021年高考化学一轮复习讲练测河南省南阳市2021届高三期中质量评估化学试题专题4 第二单元 综合拔高练-高中化学苏教2019版必修第一册(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练河南省南阳市2021届高三上期期中考试化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)湖北省安陆市第一高级中学2021-2022学年高一下学期开学考试化学试题福建省龙岩第一中学2021-2022学年高二上学期第二次月考化学试题(实验班)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题18 工艺流程题(已下线)T26-工业流程题
5 . 亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂,某化学兴趣小组利用氮氧化物与过氧化钠反应制备亚硝酸钠并进行一系列实验探究。
查阅资料:
①SO2+Na2O2=Na2SO4,NO2和NO能与Na2O2发生类似反应。
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且有无色气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
I.制备亚硝酸钠
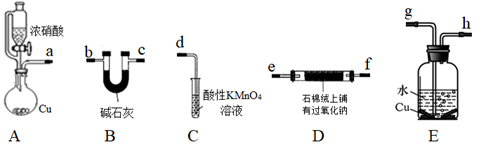
(1)装置A用恒压滴液漏斗,相比普通分液漏斗,显著的优点是______________________ 。
(2)上述装置按气流方向连接的顺序为:A→___________ →___________ →___________ →C(填仪器编号,且都是左进右出)。
(3)如果没有B装置,D中发生反应的化学方程式为_________________________________ 。(有几个就写几个,填化学方程式)。
(4)C装置的作用是_________________________________ (用离子方程式表示)。
Ⅱ.测定产品纯度,实验步骤:
①准确称量5.000g产品配成250mL溶液。
②从步骤①配制的溶液中移取25.00mL注入锥形瓶中。
③用0.1000mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为20.00mL
(5)达到滴定终点的现象是____________________________________________ 。产品中NaNO2的纯度为___________ %。
(6)设计实验证明HNO2的酸性比碳酸强_________________________________ 。
查阅资料:
①SO2+Na2O2=Na2SO4,NO2和NO能与Na2O2发生类似反应。
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且有无色气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
I.制备亚硝酸钠

(1)装置A用恒压滴液漏斗,相比普通分液漏斗,显著的优点是
(2)上述装置按气流方向连接的顺序为:A→
(3)如果没有B装置,D中发生反应的化学方程式为
(4)C装置的作用是
Ⅱ.测定产品纯度,实验步骤:
①准确称量5.000g产品配成250mL溶液。
②从步骤①配制的溶液中移取25.00mL注入锥形瓶中。
③用0.1000mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为20.00mL
(5)达到滴定终点的现象是
(6)设计实验证明HNO2的酸性比碳酸强
您最近一年使用:0次
2014·江西景德镇·二模
解题方法
6 . 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为______ 。
(2)B中所装试剂是_____ ,E中冷水的作用是_____ F中碱石灰的作用是______ 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用______ 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后。通过______ (填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为______ 。

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为
(2)B中所装试剂是
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后。通过
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为
您最近一年使用:0次
2019-01-30更新
|
405次组卷
|
7卷引用:2015届广西玉林市博白县高三下学期返校调研考试化学试卷
2015届广西玉林市博白县高三下学期返校调研考试化学试卷(已下线)2014届江西省景德镇市高三第二次质检理综化学试卷(已下线)2014届江西省上饶市高三第二次模拟考试理综化学试卷2015届山东省济宁市汶上县五中高三第二次模拟化学试卷2014-2015学年浙江省杭州市五校联盟高二统测模拟考化学试卷2014-2015学年浙江省杭州五校联盟高二下第一次统测模拟化学试卷安徽省合肥庐江五中2022-2023学年高一上学期12月份月考化学试题
名校
7 . 某探究小组用碘量法来测定样品中N2H4·H2O的含量。取样品5.000 g,加水配成250 mL无色溶液,已知溶液呈碱性,取25.00 mL溶液,用滴定管盛装0.2000 mol/L的I2标准液进行滴定。滴定反应中氧化产物和还原产物分别为N2和I-。
(1)用_____________ 填“酸式”或“碱式”)滴定管盛装I2标准液,在取液、盛装、滴定过程中还需要的玻璃仪器有_____________________________________ 。
(2)滴定过程中,需要加入_____ 作为指示剂,滴定终点的判断方法___________ 。
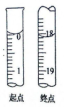
(3)滴定前后液面如图所示,所用I2标准液的体积为________________ mL。
(4)样品中水合肼(N2H4·H2O)的质量分数为_____________________ ,若滴定过程中,盛放I2标准液的滴定管刚开始有气泡,滴定后无气泡,则测得样品中水合肼(N2H4·H2O)的质量分数____________ 填“偏大”、“偏小”或“无影响”)。
(1)用
(2)滴定过程中,需要加入
(3)滴定前后液面如图所示,所用I2标准液的体积为

(4)样品中水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次
2018-12-13更新
|
204次组卷
|
2卷引用:广西玉林高级中学南校区2021-2022学年高二上学期期中考试理综化学试题
解题方法
8 . 现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=_______ ;
(2)丙溶液中存在的电离平衡为________________ (用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的由小到大顺序为________ ;

(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是________ (填“图1”或“图2”);
②a=_________ mL
③pH试纸测定溶液pH的操作方法为_______________________________ 。
(1)甲溶液的pH=
(2)丙溶液中存在的电离平衡为
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的由小到大顺序为

(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是
②a=
③pH试纸测定溶液pH的操作方法为
您最近一年使用:0次
名校
9 . 醋酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:2Cr3++Zn+4CH3COO﹣+2H2O═[Cr(CH3COO)2]2•2H2O+Zn2+。请回答下列问题:

(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是_______________________ .
(2)实验开始前,必需进行的实验操作是________ ;实验开始时,打开恒压滴液漏斗的旋塞,让盐酸滴入装置2中,打开A,关闭B,目的是___________________________ ,反应一段时间后,保持盐酸持续滴下,关闭A,打开B,目的是__________________________________ .
(3)已知其它反应物足量,实验时取用的是含溶质3.17g CrCl3溶液和1L 0.1mol•L﹣1的醋酸钠溶液;实验后得干燥纯净的醋酸亚铬晶体2.82g,则该实验所得产品的产率为_____ %(不考虑醋酸亚铬晶体的溶解损失).
(4)为标定实验所用的CrCl3溶液,进行了如下操作:
取25.00mLCrCl3溶液于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入适量Na2O2,充分加热煮沸,稀释,加入过量的稀H2SO4至溶液呈强酸性,此时铬以Cr2O72﹣存在;再加入足量KI,密塞,摇匀,于暗处静置5分钟后,用0.25mol•L﹣1硫代硫酸钠溶液滴定至溶液呈淡黄色,加入l mL指示剂,滴定至终点.平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.
已知:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O,2S2O32﹣+I2═S4O62﹣十2I﹣.
①实验所用的CrCl3溶液的物质的量浓度为_______ .
②滴定过程中所用的指示剂是________ .
③下列操作导致实验结果偏低的是___________ .
a.移取CrCl3溶液的滴定管,水洗后未用CrCl3溶液润洗
b.盛硫代硫酸钠溶液的滴定管滴定前有气泡,滴定后无气泡
c.量取CrCl3溶液时先俯视后仰视
d.滴定终点时,盛硫代硫酸钠溶液的滴定管尖嘴外挂有一滴液珠未滴落.

(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是
(2)实验开始前,必需进行的实验操作是
(3)已知其它反应物足量,实验时取用的是含溶质3.17g CrCl3溶液和1L 0.1mol•L﹣1的醋酸钠溶液;实验后得干燥纯净的醋酸亚铬晶体2.82g,则该实验所得产品的产率为
(4)为标定实验所用的CrCl3溶液,进行了如下操作:
取25.00mLCrCl3溶液于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入适量Na2O2,充分加热煮沸,稀释,加入过量的稀H2SO4至溶液呈强酸性,此时铬以Cr2O72﹣存在;再加入足量KI,密塞,摇匀,于暗处静置5分钟后,用0.25mol•L﹣1硫代硫酸钠溶液滴定至溶液呈淡黄色,加入l mL指示剂,滴定至终点.平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.
已知:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O,2S2O32﹣+I2═S4O62﹣十2I﹣.
①实验所用的CrCl3溶液的物质的量浓度为
②滴定过程中所用的指示剂是
③下列操作导致实验结果偏低的是
a.移取CrCl3溶液的滴定管,水洗后未用CrCl3溶液润洗
b.盛硫代硫酸钠溶液的滴定管滴定前有气泡,滴定后无气泡
c.量取CrCl3溶液时先俯视后仰视
d.滴定终点时,盛硫代硫酸钠溶液的滴定管尖嘴外挂有一滴液珠未滴落.
您最近一年使用:0次
2018-09-26更新
|
190次组卷
|
2卷引用:广西桂林市第十八中学2020-2021学年高二下学期期中考试化学试题
名校
10 . 25℃时,用0.10mol/L的盐酸分别滴定体积相同且浓度均为0.10mol/L的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。

下列说法正确的是

下列说法正确的是
| A.滴定XOH时可用酚酞作指示剂 |
| B.YOH是强碱 |
C.X++H2O XOH+ H+的平衡常数K=10-4 XOH+ H+的平衡常数K=10-4 |
| D.[V(盐酸)/V(碱)]=0.5时,c(Z+)>c(Y+)>c(X+) |
您最近一年使用:0次
2018-04-24更新
|
319次组卷
|
2卷引用:【全国省级联考】广西2018届高三4月考前模拟联合理综化学试题



