名校
1 . 下列关于酸碱中和滴定的叙述中,正确的是
| A.进行酸碱中和滴定实验时,盛装待测液的锥形瓶使用前应先用待测液润洗 |
| B.滴定前应排除尖嘴部分的气泡 |
| C.滴定结束时仰视标准液读数会使测定结果偏小 |
| D.锥形瓶内溶液颜色突变说明到达滴定终点 |
您最近一年使用:0次
2022-09-13更新
|
411次组卷
|
3卷引用:广西壮族自治区梧州市苍梧中学2022-2023学年高二上学期11月月考化学试题
解题方法
2 . 一种以废玻璃粉末(含CeO2、SiO2、Fe2O3等)为原料制备CeCl3的工艺流程如图所示:
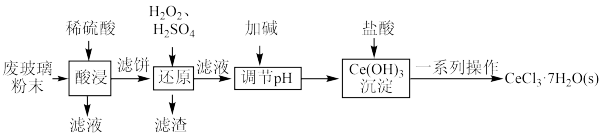
已知:CeO2具有强氧化性;25℃时,Ce(OH)3的Ksp=8. 0×10-21。
回答下列问题:
(1)“酸浸”步骤中发生反应的离子方程式为_______ ,“酸浸”时需要不断搅拌的目的是_______ 。
(2)在“还原”步骤中发生反应的化学方程式为_______ 。“滤渣”的主要成分是_______ ,指出“滤渣”一种主要用途_______ 。
(3)25℃时,“调节pH”为9,此时c(Ce3+)=_______ mol/L。
(4)“一系列操作”是蒸发浓缩、_______ 、过滤、洗涤。工业上用真空的热脱水法制备无水CeCl3时常会生成副产物氯氧化铈(CeOCl,不溶于水),故热脱水过程中,加入NH4Cl氯化CeOCl,同时生成一种可用于联合制碱的气体,有效抑制副反应的发生,则该反应的化学方程式为_______ 。
(5)对CeCl3·7H2O(Mr =372.5 g·mol-1 )样品纯度进行测定的方法:准确称量样品12.5 g,配成200 mL溶液,取50.00 mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵[(NH4)2S2O8]溶液使Ce3+被氧化为Ce4+,然后用萃取剂萃取Ce4+ ,再用1 mol/L FeSO4标准溶液滴定至终点,重复2~3次,平均消耗7.50 mL标准液。CeCl3· 7H2O样品的纯度为_______ 。

已知:CeO2具有强氧化性;25℃时,Ce(OH)3的Ksp=8. 0×10-21。
回答下列问题:
(1)“酸浸”步骤中发生反应的离子方程式为
(2)在“还原”步骤中发生反应的化学方程式为
(3)25℃时,“调节pH”为9,此时c(Ce3+)=
(4)“一系列操作”是蒸发浓缩、
(5)对CeCl3·7H2O(Mr =372.5 g·mol-1 )样品纯度进行测定的方法:准确称量样品12.5 g,配成200 mL溶液,取50.00 mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵[(NH4)2S2O8]溶液使Ce3+被氧化为Ce4+,然后用萃取剂萃取Ce4+ ,再用1 mol/L FeSO4标准溶液滴定至终点,重复2~3次,平均消耗7.50 mL标准液。CeCl3· 7H2O样品的纯度为
您最近一年使用:0次
3 . 亚硝酰硫酸(NOSO4H)在重氮化反应中可以代替亚硝酸钠。实验室用如图装置(夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
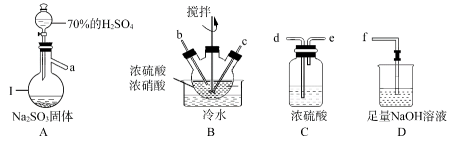
已知:①亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解。
②实验室制备亚硝酰硫酸的原理为SO2+HNO3=SO3+HNO2,SO3+HNO2=NOSO4H。
回答下列问题:
(1)仪器I的名称为_______ ,写出A中反应的化学方程式_______ 。
(2)按照气流从左到右的顺序,上述仪器的连接顺序为_______ (填仪器接口的字母,部分仪器可以重复使用)。
(3)装置B中的“冷水”控制在20℃左右,温度不宜过高或过低的原因是_______ 。
(4)在上述反应条件下,开始时反应缓慢,但某时刻反应速率明显加快,其原因是_______ 。
(5)如果不使用装置C,造成的影响是_______ 。
(6)测定亚硝酰硫酸的纯度
已知:2KMnO4 + 5NOSO4H +2H2O =K2SO4 + 2MnSO4 + 5HNO3 +2H2SO4;2 + 5
+ 5 +16H+ =2Mn2++10CO2↑+8H2O。
+16H+ =2Mn2++10CO2↑+8H2O。
步骤如下:
步骤1:准确称取14. 00g产品,在特定条件下配制成250 mL溶液。
步骤2:取25. 00 mL产品于250 mL容量瓶中,加入60. 00 mL未知浓度KMnO4溶液(过量)和10. 00 mL 25%H2SO4溶液,然后摇匀。
步骤3:用0. 2500 mol· L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液20. 00 mL。
把亚硝酰硫酸溶液换为蒸馏水(空白实验) ,复上述步骤,消耗Na2C2O4溶液的体积为60. 00 mL。
①达到滴定终点时的现象为_______ 。
②亚硝酰硫酸的纯度为_______ (精确到0.1%)。

已知:①亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解。
②实验室制备亚硝酰硫酸的原理为SO2+HNO3=SO3+HNO2,SO3+HNO2=NOSO4H。
回答下列问题:
(1)仪器I的名称为
(2)按照气流从左到右的顺序,上述仪器的连接顺序为
(3)装置B中的“冷水”控制在20℃左右,温度不宜过高或过低的原因是
(4)在上述反应条件下,开始时反应缓慢,但某时刻反应速率明显加快,其原因是
(5)如果不使用装置C,造成的影响是
(6)测定亚硝酰硫酸的纯度
已知:2KMnO4 + 5NOSO4H +2H2O =K2SO4 + 2MnSO4 + 5HNO3 +2H2SO4;2
 + 5
+ 5 +16H+ =2Mn2++10CO2↑+8H2O。
+16H+ =2Mn2++10CO2↑+8H2O。步骤如下:
步骤1:准确称取14. 00g产品,在特定条件下配制成250 mL溶液。
步骤2:取25. 00 mL产品于250 mL容量瓶中,加入60. 00 mL未知浓度KMnO4溶液(过量)和10. 00 mL 25%H2SO4溶液,然后摇匀。
步骤3:用0. 2500 mol· L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液20. 00 mL。
把亚硝酰硫酸溶液换为蒸馏水(空白实验) ,复上述步骤,消耗Na2C2O4溶液的体积为60. 00 mL。
①达到滴定终点时的现象为
②亚硝酰硫酸的纯度为
您最近一年使用:0次
解题方法
4 . I.化学实验是中学化学学习中必不可少的一环。根据要求,回答下列问题:
(1)在测定中和反应的反应热时,如图所示:

①仪器a的名称为_______ 。
②某同学每次分别取0.50mol·L-150mLNaOH溶液和0.50mol·L-130mL硫酸进行实验,通过多次实验测定中和热的测量值为53.5kJ·mol-1,与57.3kJ·mol-1有偏差,产生偏差的原因不可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
(2)在进行酸碱中和滴定实验时:
①滴定管的使用。在使用滴定管前,要_______ 。
②用0.1000mol·L-1HCl溶液滴定未知浓度的NaOH溶液,用酚酞溶液作指示剂,达到滴定终点时的现象是_______ 。
II.常温下,有关4种溶液的信息如下:
已知:NH3·H2O与CH3COOH的电离常数都约为1. 8×10-5。
请回答下列问题:
(3)取等体积的溶液①与④混合后,所得溶液呈_______ 性(填“酸”“中”或“碱”)。
(4)将aL溶液②与bL溶液④混合后,若所得溶液的pH=4(忽略溶液混合的体积变化),则a:b=_______ 。
(5)将等体积的pH=3的溶液③与④加水分别稀释1 000倍后,所得溶液的pH____ 大(填序号)。
(6)将溶液②与溶液③等体积混合后,所得溶液中离子及浓度如图所示:

图中X表示_______ 。
(1)在测定中和反应的反应热时,如图所示:

①仪器a的名称为
②某同学每次分别取0.50mol·L-150mLNaOH溶液和0.50mol·L-130mL硫酸进行实验,通过多次实验测定中和热的测量值为53.5kJ·mol-1,与57.3kJ·mol-1有偏差,产生偏差的原因不可能是
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
(2)在进行酸碱中和滴定实验时:
①滴定管的使用。在使用滴定管前,要
②用0.1000mol·L-1HCl溶液滴定未知浓度的NaOH溶液,用酚酞溶液作指示剂,达到滴定终点时的现象是
II.常温下,有关4种溶液的信息如下:
| 编号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
已知:NH3·H2O与CH3COOH的电离常数都约为1. 8×10-5。
请回答下列问题:
(3)取等体积的溶液①与④混合后,所得溶液呈
(4)将aL溶液②与bL溶液④混合后,若所得溶液的pH=4(忽略溶液混合的体积变化),则a:b=
(5)将等体积的pH=3的溶液③与④加水分别稀释1 000倍后,所得溶液的pH
(6)将溶液②与溶液③等体积混合后,所得溶液中离子及浓度如图所示:

图中X表示
您最近一年使用:0次
名校
5 . 已知:P4(白磷)+NaOH→NaH2PO2+PH3↑。PH3有强还原性,是无色、有毒且能自燃的气体,有同学用如图所示装置制取少量NaH2PO2,相关操作步骤(不是正确顺序)为①打开K,先通入N2一段时间;②在三颈烧瓶中加入丁醇和白磷;③检查装置气密性;④打开K,再通入N2一段时间;⑤关闭K,打开磁力加热搅拌器加热至50°C~60°C,滴加溶液。
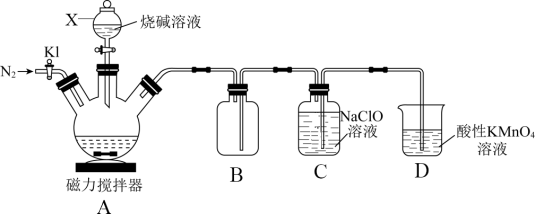
回答下列问题:
(1)仪器X的名称为_______ ;装置B的作用是_______ 。
(2)该装置中有一处明显错误是_______ 。
(3)实验操作步骤的正确顺序是_______ (填序号)。
(4)先通入N2一段时间的目的是_______ 。
(5)PH3在C、D中都被氧化成磷酸,C中反应的化学方程式为_______ 。
(6)取产品mg溶于稀硫酸配成250mL溶液,取25mL于锥形瓶中,然后用0.02mol/LKMnO4标准溶液滴定,滴定终点的现象是_______ ;达到滴定终点时消耗VmLKMnO4标准溶液(相关反应的比例关系为4KMnO4~5NaH2PO2),产品纯度为_______ %(用含m、V的代数式表示)。

回答下列问题:
(1)仪器X的名称为
(2)该装置中有一处明显错误是
(3)实验操作步骤的正确顺序是
(4)先通入N2一段时间的目的是
(5)PH3在C、D中都被氧化成磷酸,C中反应的化学方程式为
(6)取产品mg溶于稀硫酸配成250mL溶液,取25mL于锥形瓶中,然后用0.02mol/LKMnO4标准溶液滴定,滴定终点的现象是
您最近一年使用:0次
2022-07-26更新
|
101次组卷
|
2卷引用:广西玉林市博白县中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
6 . 已知常温下二元弱酸H2A溶液中,H2A、HA-、A2-的分布分数(δ)随pH变化如图所示[如A2-分布分数:δ(A2-)= ],下列说法错误的是
],下列说法错误的是
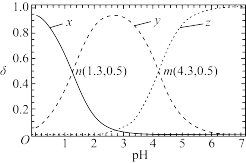
 ],下列说法错误的是
],下列说法错误的是
| A.曲线x代表H2A,曲线z代表A2- |
B.pH从3升高至4,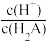 的值一直减小 的值一直减小 |
| C.n点对应的溶液中水电离出的c(H+)=10-12.7mol·L-1 |
| D.将浓度均为0.05mol·L-1的NaHA溶液与Na2A溶液等体积混合后,所得溶液pH>4.3 |
您最近一年使用:0次
2022-06-15更新
|
951次组卷
|
4卷引用:广西桂林市联盟校2022-2023学年高三上学期9月入学统一检测化学试题
广西桂林市联盟校2022-2023学年高三上学期9月入学统一检测化学试题江西省名校2022届高三下学期第三次模拟理科综合化学试题(已下线)易错点24 水的电离平衡-备战2023年高考化学考试易错题江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
7 . 新冠疫情期间使用了大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
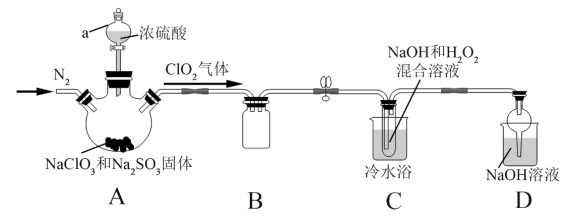
I.查阅资料;
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
II.制备与分离:
(1)实验加药品前应进行的实验操作是___________ 。
(2)盛放NaClO3和Na2SO3固体的仪器名称是___________ ,
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为___________ 。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃ 蒸发结晶;
②___________ ;
③用38℃~60℃热水洗涤;
④在38℃~60℃间进行干燥,得到成品。
(5)装置D是处理尾气,反应的化学方程式___________ 。
III.测量与计算:
(6)利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I‑不发生反应)的纯度,过程如下:取样品1.4450g 配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,(已知:ClO +4I-+4H+ =2H2O+ 2I2+Cl- ),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL (已知I2+2S2O
+4I-+4H+ =2H2O+ 2I2+Cl- ),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL (已知I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①滴定终点的现象是___________ 。
②下列滴定操作会导致测量结果偏低的是___________ (填字母)。
a锥形瓶洗涤后没有干燥
b滴定时锥形瓶中有液体溅出
c滴定终点时俯视读数
d滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为___________ % (用含c、v的代数式表示)。

I.查阅资料;
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
II.制备与分离:
(1)实验加药品前应进行的实验操作是
(2)盛放NaClO3和Na2SO3固体的仪器名称是
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃ 蒸发结晶;
②
③用38℃~60℃热水洗涤;
④在38℃~60℃间进行干燥,得到成品。
(5)装置D是处理尾气,反应的化学方程式
III.测量与计算:
(6)利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I‑不发生反应)的纯度,过程如下:取样品1.4450g 配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,(已知:ClO
 +4I-+4H+ =2H2O+ 2I2+Cl- ),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL (已知I2+2S2O
+4I-+4H+ =2H2O+ 2I2+Cl- ),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL (已知I2+2S2O =S4O
=S4O +2I-)。
+2I-)。①滴定终点的现象是
②下列滴定操作会导致测量结果偏低的是
a锥形瓶洗涤后没有干燥
b滴定时锥形瓶中有液体溅出
c滴定终点时俯视读数
d滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为
您最近一年使用:0次
2022-03-03更新
|
141次组卷
|
2卷引用:广西河池市高级中学2021-2022学年高三上学期第二次月考化学试题
名校
8 . 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为
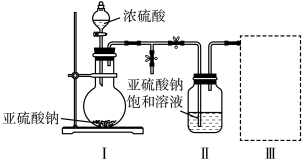
(1)装置Ⅰ中产生气体的化学方程式为___________ 。
(2)要从装置Ⅱ中获得已析出的晶体,采取的分离方法是___________ 分离时需用到的玻璃仪器有___________ 。
(3)装置Ⅲ中用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___________ (填编号)。
a. b.
b.  c.
c.  d.
d. 
实验二:焦亚硫酸钠的性质:Na2S2O5溶于水即生成
(4)证明 溶液中
溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填编号)。
a.测定溶液的pH b.加入 溶液 c.加入盐酸
溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是___________ 。
实验三:葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离的 计算)的方案如下:
计算)的方案如下:
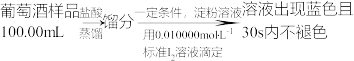
(已知滴定时反应的化学方程式为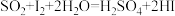 )
)
①按上述方案实验,消耗标准 溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离的
溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离的 计算)为
计算)为___________ g/L。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果___________ (填“偏高”“偏低”或“不变”)。
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为


(1)装置Ⅰ中产生气体的化学方程式为
(2)要从装置Ⅱ中获得已析出的晶体,采取的分离方法是
(3)装置Ⅲ中用于处理尾气,可选用的最合理装置(夹持仪器已略去)为
a.
 b.
b.  c.
c.  d.
d. 
实验二:焦亚硫酸钠的性质:Na2S2O5溶于水即生成
(4)证明
 溶液中
溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入
 溶液 c.加入盐酸
溶液 c.加入盐酸d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是
实验三:葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离的
 计算)的方案如下:
计算)的方案如下: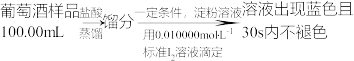
(已知滴定时反应的化学方程式为
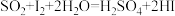 )
)①按上述方案实验,消耗标准
 溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离的
溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离的 计算)为
计算)为②在上述实验过程中,若有部分HI被空气氧化,则测得结果
您最近一年使用:0次
名校
9 . 用0.1mol/L NaOH溶液滴定10mL 0.1mol/L盐酸,利用电导率传感器可绘制滴定过程中的电导率曲线如下图所示。下列说法错误的是
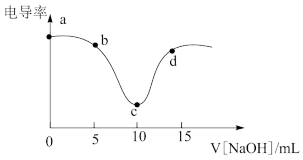

| A.电导率最低点c点就是酸碱中和滴定的终点 |
| B.由图所知,随着NaOH溶液增加,溶液pH先变小后变大 |
C.b、c、d点都存在: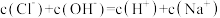 |
| D.a点电导率最大是因为此时溶液中导电微粒浓度最高 |
您最近一年使用:0次
2022-01-30更新
|
1043次组卷
|
5卷引用:广西柳州市2022届高三第二次模拟考试理科综合化学试题
广西柳州市2022届高三第二次模拟考试理科综合化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题湖南省郴州市第一中学2023届高三下学期第七次月考化学试题(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
10 . 常温时,用0.10mol/L NaOH溶液滴定25.00mL 0.10molL某一元酸HX的溶液,滴定过程中pH变化曲线如图所示,下列判断不正确的是
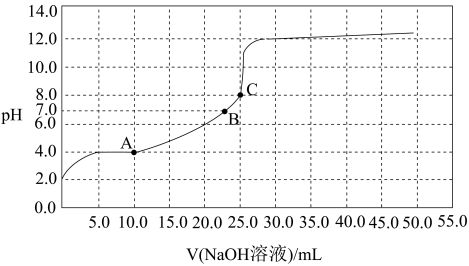
| A.HX为一元弱酸 |
| B.V(NaOH 溶液)=12.50mL时,c(X-)>c(Na+ )>c(H+)>c(OH-) |
| C.溶液pH=7时,HX和NaOH恰好完全反应 |
| D.V(NaOH溶液)=25.00mL时,c(Na+)= c(X-)+c(HX) |
您最近一年使用:0次
2022-01-18更新
|
77次组卷
|
2卷引用:广西百色市2021-2022学年高二上学期期末教学质量调研测试化学试题



