名校
1 . 已知:pK=-lgK,25℃时,二元酸H2A的pK1= 1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是


| A.a点所得溶液中:Vo=10mL |
| B.C点所得溶液中:c(A2- )=c(HA-) |
| C.b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-) |
| D.d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19 |
您最近一年使用:0次
2018-04-24更新
|
761次组卷
|
13卷引用:广西北海市2018届高三第一次模拟考试理综化学试题
广西北海市2018届高三第一次模拟考试理综化学试题山东省泰安市2017届高三第二轮复习质量检测(二模)理科综合化学试题宁夏六盘山高级中学2018届高三下学期第一次模拟考试化学试题【全国市级联考】山西省太原市2018届高三4月模拟(二)理综化学试题【全国百强校】河北省武邑中学2019届高三下学期第一次质检化学试题黑龙江省哈尔滨市尚志市尚志中学2019-2020学年高二上学期第三次月考化学试题2020届高三化学二轮冲刺新题专练——弱电解质的电离平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——弱电解质的电离及影响因素 (强化练习)河北省张家口市宣化区第一中学2020届高三下学期3月月考化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二下学期期中考试化学试题宁夏贺兰县景博中学2019-2020学年高二上学期第二次月考化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题河北正定中学2020-2021学年高三上学期第四次半月考化学试题
名校
2 . 水的电离平衡曲线如图所示:
(1)若A点、B点分别表示25℃和100℃时水的电离平衡时离子的浓度,则表示25℃的是______ (填“A”或“B”),100℃时水的离子积为__________ 。
(2)100℃,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与盐酸溶液的体积比为_____ 。
(3)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4-+ 5HSO3- + H+=2Mn2+ + 5SO42- + 3H2O 填空回答问题:

①滴定时,将酸性KMnO4标准液装在图中的___________ (填“甲”或“乙”) 滴定管中。
②本实验___________ (填“需要”或“不需要”)指示剂。
③下列操作会使测定结果偏高的是_____
A.锥形瓶洗净后还留有蒸馏水
B.部分KMnO4溶液滴到锥形瓶外
C.盛装KMnO4溶液的滴定管滴定前读数正确,滴定后仰视读数
(1)若A点、B点分别表示25℃和100℃时水的电离平衡时离子的浓度,则表示25℃的是
(2)100℃,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与盐酸溶液的体积比为

(3)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4-+ 5HSO3- + H+=2Mn2+ + 5SO42- + 3H2O 填空回答问题:

①滴定时,将酸性KMnO4标准液装在图中的
②本实验
③下列操作会使测定结果偏高的是
A.锥形瓶洗净后还留有蒸馏水
B.部分KMnO4溶液滴到锥形瓶外
C.盛装KMnO4溶液的滴定管滴定前读数正确,滴定后仰视读数
您最近一年使用:0次
2018-02-02更新
|
201次组卷
|
2卷引用:广西河池市高级中学2017-2018学年高二上学期期末考试化学试题
解题方法
3 . 碘化亚铜(CuI)是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。

(1)过程①得到的溶液呈蓝色,其原因是______ (用化学方程式表示),当温度高于40℃时,过程①反应速率减慢,原因是________________ 。
(2)过程②调节溶液pH适宜选用的试剂是_______ (填正确答案的字母编号);已知25℃时,Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=4×10-35,lg2=0.30,则过程②调节溶液PH时,溶液的PH不小于________ 。
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为________________ 。
(4)过程④用乙醇洗涤沉淀的目的为________________ 。
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为_______ (已知: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。

(1)过程①得到的溶液呈蓝色,其原因是
(2)过程②调节溶液pH适宜选用的试剂是
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为
(4)过程④用乙醇洗涤沉淀的目的为
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为
您最近一年使用:0次
4 . 在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式__________
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是___________ (选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是________________ ;滤渣的主要成分是________________ 。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是_________ 。
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果__ 。(选填“偏高”、“偏低”或“无影响”)
(1)写出上述制备小苏打的化学方程式
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
您最近一年使用:0次
名校
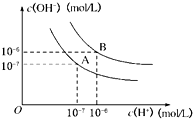
5 . 氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为_____________ 。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
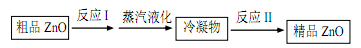
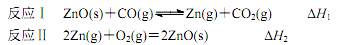
①上图中的“冷凝物”为________ (填化学式)。
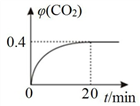
②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 mol•L1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=_____ 。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________ 。
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=_____________ 。
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 mol•L1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将___ (填“偏高”、“偏低”或“不变”)。
②样品纯度为:________________ (列出计算式即可)。
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤__________ mol•L1。(已知:Ksp(ZnS)=2.5×1023,忽略溶液体积的变化)
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:

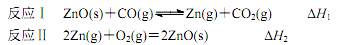
①上图中的“冷凝物”为

②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 mol•L1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 mol•L1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将
②样品纯度为:
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤
您最近一年使用:0次
2017-04-16更新
|
658次组卷
|
3卷引用:广西玉林市2018届高三高考模拟(四)化学试题
13-14高三上·江苏泰州·期末
名校
6 . 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
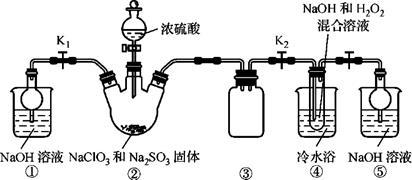
(1)装置③的作用是_________ 。
(2)装置②中产生ClO2的化学方程式为________________ ;装置④中制备NaClO2的化学方程式为_____________________ 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③___________ ;④低于60 ℃干燥,得到成品。
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为_____________ 。
(5)该样品中NaClO2的质量分数为_____ (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为__ 。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。

(1)装置③的作用是
(2)装置②中产生ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
您最近一年使用:0次
2016-12-09更新
|
148次组卷
|
7卷引用:2016届广西钦州港经济技术开发区中学高三上学期期中测试化学试卷
2016届广西钦州港经济技术开发区中学高三上学期期中测试化学试卷(已下线)2013届江苏省泰州市高三上学期期末考试化学试卷(已下线)2013届天津市河东区高三第二次模拟考试理综化学试卷2015届陕西省西安市长安一中高三上学期第三次月考化学试卷2016届安徽省安庆一中高三热身考试理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷西藏自治区拉萨中学2017届高三第八次月考理综化学试题
2014高三·全国·专题练习
7 . 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
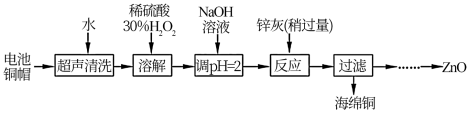
(1)①铜帽溶解时加入H 2 O 2 的目的是____________ (用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2 除去。除去H 2 O 2 的简便方法是___________ 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H 2 O 2 后溶液中Cu 2 + 的含量。
实验操作为:准确量取一定体积的含有Cu 2 + 的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3 标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O +I 2 =2I-+S4O
+I 2 =2I-+S4O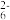
①滴定选用的指示剂为_____ ,滴定终点观察到的现象为 ___________ 。
②若滴定前溶液中的H 2 O 2 没有除尽,所测定的Cu 2 + 含量将会___________ (填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2- 。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 molL -1 计算)。
实验中可选用的试剂:30%H2O2 、1. 0 molL -1 HNO3 、1. 0 molL -1 NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①___________ ;② ___________ ;③过滤;④___________ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。

(1)①铜帽溶解时加入H 2 O 2 的目的是
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H 2 O 2 后溶液中Cu 2 + 的含量。
实验操作为:准确量取一定体积的含有Cu 2 + 的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3 标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O
 +I 2 =2I-+S4O
+I 2 =2I-+S4O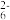
①滴定选用的指示剂为
②若滴定前溶液中的H 2 O 2 没有除尽,所测定的Cu 2 + 含量将会
(3)已知pH>11 时Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2- 。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 molL -1 计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
 | 1.1 | 3.2 |
 | 5.8 | 8.8 |
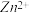 | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2 、1. 0 molL -1 HNO3 、1. 0 molL -1 NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①
您最近一年使用:0次
2016-12-09更新
|
773次组卷
|
5卷引用:广西钦州市钦州港经济技术开发区中学2017-2018学年高一上学期(12月)月考化学试题
11-12高三·浙江绍兴·阶段练习
名校
解题方法
8 . 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
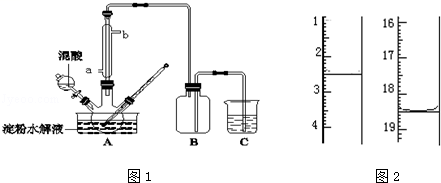
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________ ;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________ ;
(3)检验淀粉是否水解完全所用的试剂为_________ ;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________ ;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020mol•L﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________ ,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________ 。

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是
(3)检验淀粉是否水解完全所用的试剂为
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020mol•L﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为
您最近一年使用:0次
2016-12-09更新
|
1209次组卷
|
16卷引用:广西崇左市龙州县高级中学2019-2020学年高二上学期期末考试化学试题
广西崇左市龙州县高级中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区来宾市金秀县民族中学2019-2020学年高二上学期期末考试化学试题(已下线)2013届浙江省绍兴一中高三回头考试化学试卷云南省景东县民中2017-2018学年高二下学期6月份考试化学试题云南省文山马关实验高级中学2019-2020学年高二期末考试化学试题云南省金平县第一中学2019-2020学年高二上学期期末考试化学试题云南省巧家县第三中学2019-2020学年高二上学期期末考试化学试题云南省盐津县第三中学2019-2020学年高二上学期期末考试化学试题云南省丽江市玉龙县第一中学2019—2020学年高二上学期期末考试化学贵州省龙里中学2019-2020学年高二上学期期末考试化学试题贵州省黎平第二中学2019-2020学年高二上学期期末考试化学试题贵州省台江县第二中学2019-2020学年高二上学期期末考试化学试题贵州省黔西南布依族苗族自治州册亨县第三中学2019-2020学年高二上学期期末考试化学试题贵州省铜仁市沿河县第二高级中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市富源县第三中学2019-2020学年高二上学期期末考试化学试题四川省泸州市泸县第五中学2022-2023学年高二上学期12月月考试化学试题
11-12高二上·山西晋中·期中
名校
9 . 在100 mL某一元弱酸的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。
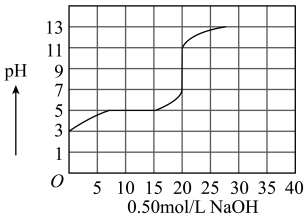
下列叙述正确的是( )

下列叙述正确的是( )
| A.该弱酸在滴定前的浓度是0.15 mol/L |
| B.该弱酸稀释10倍后pH为4 |
| C.滴定过程为求滴定终点,最合适的指示剂是酚酞 |
| D.滴定过程为求滴定终点,最合适的指示剂是甲基橙 |
您最近一年使用:0次
2016-12-09更新
|
580次组卷
|
8卷引用: 广西钦州市2022-2023学年高二上学期第2次教学质量监测化学试卷
11-12高二上·广西北海·期末
10 . 测定海水中溶解氧的步骤如下:
①水样的固定。取amL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡摇匀,使之充分反应。
②酸化。开塞后迅速加适量1:1的硫酸,再迅速塞好瓶塞。反复振荡至沉淀完全溶解。
③滴定。向溶液中加入1mL0.5%淀粉溶液,再用bmol/LNa2S2O3标准溶液滴定至溶液刚好褪色。
有关的离子反应如下:
2Mn2++O2+4OH- =2MnO(OH)2 (该反应极快)
MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O
I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果_______ (填“偏高”或“偏低”或“无影响”)原因是__________________ 。
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果________ (填“偏高”或“偏低”或“无影响”)原因是__________________ 。
(3)滴定前,未排除滴定管中的气泡。在滴定过程中气泡的排除,会使测定结果______ (填“偏高”或“偏低”或“无影响”)原因是_____________________ 。
①水样的固定。取amL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡摇匀,使之充分反应。
②酸化。开塞后迅速加适量1:1的硫酸,再迅速塞好瓶塞。反复振荡至沉淀完全溶解。
③滴定。向溶液中加入1mL0.5%淀粉溶液,再用bmol/LNa2S2O3标准溶液滴定至溶液刚好褪色。
有关的离子反应如下:
2Mn2++O2+4OH- =2MnO(OH)2 (该反应极快)
MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O
I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果
(3)滴定前,未排除滴定管中的气泡。在滴定过程中气泡的排除,会使测定结果
您最近一年使用:0次



