1 . 花椒油是从花椒籽中提取的一种香精油,具有挥发性,溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。
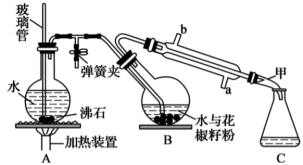
实验步骤:
i.在装置A中的圆底烧瓶中装入 容积的水,加2~3粒沸石。同时在装置B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加2~3粒沸石。同时在装置B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
ii.加热装置A中的圆底烧瓶,当有大量水蒸气产生时关闭弹簧夹,进行蒸馏。
iii.向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体注入蒸馏烧瓶,蒸馏得花椒油。
回答下列问题:
(1)装置A中玻璃管的作用是___ ;装置B中圆底烧瓶倾斜的目的是___ 。
(2)步骤ii中,当观察到_____________ 现象时,可停止蒸馏。蒸馏结束时,下列操作的顺序为___ (填标号)。
a.停止加热 b.打开弹簧夹 c.关闭冷凝水
(3)在馏出液中加入食盐的作用是___ ;加入无水Na2SO4的作用是___ 。
(4)实验结束后,用稀NaOH溶液清洗冷凝管(冷凝管中的残留物以 表示),反应的化学方程式为
表示),反应的化学方程式为___ 。
(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加入92.00mL0.5000mol•L-1NaOH的乙醇溶液,搅拌,充分反应;加水配成200.0mL溶液,从中取出25.00mL溶液于锥形瓶中,滴入几滴酚酞试液,用0.1000mol•L-1HCl溶液进行滴定,滴定终点消耗HCl溶液20.00mL。则该花椒油中含有油脂___ g•L-1(油脂用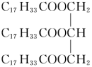 表示,它的相对分子质量为884)。
表示,它的相对分子质量为884)。

实验步骤:
i.在装置A中的圆底烧瓶中装入
 容积的水,加2~3粒沸石。同时在装置B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加2~3粒沸石。同时在装置B中的圆底烧瓶中加入20g花椒籽粉和50mL水。ii.加热装置A中的圆底烧瓶,当有大量水蒸气产生时关闭弹簧夹,进行蒸馏。
iii.向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体注入蒸馏烧瓶,蒸馏得花椒油。
回答下列问题:
(1)装置A中玻璃管的作用是
(2)步骤ii中,当观察到
a.停止加热 b.打开弹簧夹 c.关闭冷凝水
(3)在馏出液中加入食盐的作用是
(4)实验结束后,用稀NaOH溶液清洗冷凝管(冷凝管中的残留物以
 表示),反应的化学方程式为
表示),反应的化学方程式为(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加入92.00mL0.5000mol•L-1NaOH的乙醇溶液,搅拌,充分反应;加水配成200.0mL溶液,从中取出25.00mL溶液于锥形瓶中,滴入几滴酚酞试液,用0.1000mol•L-1HCl溶液进行滴定,滴定终点消耗HCl溶液20.00mL。则该花椒油中含有油脂
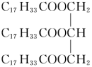 表示,它的相对分子质量为884)。
表示,它的相对分子质量为884)。
您最近一年使用:0次
2021-03-09更新
|
1005次组卷
|
6卷引用:广西南宁市2020-2021学年高二上学期期末考试化学试题
广西南宁市2020-2021学年高二上学期期末考试化学试题(已下线)专题七 羧酸 羧酸衍生物-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)3月刊 (同步课堂必刷题)(已下线)3.4 羧酸 羧酸衍生物(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)专题一 油脂-2020-2021学年高二《新题速递·化学》(人教版选修5)4月刊 (同步课堂必刷题)(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)专题6 生命活动的物质基础——糖类、油脂、蛋白质 本专题达标检测
名校
2 . 某兴趣小组同学向一定体积的Ba(OH)2溶液中逐滴滴加稀H2SO4,不断搅拌并测定溶液导电能力的变化(装置如下图所示)。
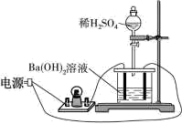
I.实验测得混合溶液的导电能力随时间变化的曲线如图所示。
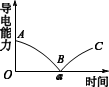
(1)写出Ba(OH)2溶液与稀H2SO4反应的离子方程式_________________ 。
(2)实验现象:烧杯中有白色沉淀产生,小灯泡__________________ 。
(3)下列说法正确的是__________________ (填“序号”)
a.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
b.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
c.a时刻Ba(OH)2溶液与稀H2SO4恰好中和
d.BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
II.配制250mL1.0mol/LH2SO4溶液。
(1)计算:需要18mol/LH2SO4溶液__________ mL(计算结果精确到小数点后一位)。
(2)配制过程中,不需要使用的仪器有_________________ (填“序号”)。
①量筒 ②托盘天平 ③烧瓶 ④250ml容量瓶 ⑤烧杯 ⑥玻璃棒 ⑦胶头滴管
(3)配制过程中的正确操作顺序是:b、d、____________ 、e(填“字母”)。
a.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b.用量筒量取所需体积的18mol/LH2SO4溶液注入盛有约50ml蒸馏水的烧杯。
c.用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d.用玻璃棒慢慢搅动,混合均匀。
e.盖好容量瓶瓶塞,反复上下颠倒,摇匀
f.将稀释后的H2SO4溶液沿玻璃棒注入250ml容量瓶。
g.往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(4)下列操作将导致所配制的H2SO4溶液浓度偏大的是________________ (填“字母”)。
a.移液过程有H2SO4溶液溅出瓶外 b.移液后未洗涤烧杯和玻璃棒
c.定容时俯视容量瓶刻度线 d.加水超过刻度线,用胶头滴管吸出多余液体

I.实验测得混合溶液的导电能力随时间变化的曲线如图所示。

(1)写出Ba(OH)2溶液与稀H2SO4反应的离子方程式
(2)实验现象:烧杯中有白色沉淀产生,小灯泡
(3)下列说法正确的是
a.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
b.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
c.a时刻Ba(OH)2溶液与稀H2SO4恰好中和
d.BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
II.配制250mL1.0mol/LH2SO4溶液。
(1)计算:需要18mol/LH2SO4溶液
(2)配制过程中,不需要使用的仪器有
①量筒 ②托盘天平 ③烧瓶 ④250ml容量瓶 ⑤烧杯 ⑥玻璃棒 ⑦胶头滴管
(3)配制过程中的正确操作顺序是:b、d、
a.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b.用量筒量取所需体积的18mol/LH2SO4溶液注入盛有约50ml蒸馏水的烧杯。
c.用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d.用玻璃棒慢慢搅动,混合均匀。
e.盖好容量瓶瓶塞,反复上下颠倒,摇匀
f.将稀释后的H2SO4溶液沿玻璃棒注入250ml容量瓶。
g.往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(4)下列操作将导致所配制的H2SO4溶液浓度偏大的是
a.移液过程有H2SO4溶液溅出瓶外 b.移液后未洗涤烧杯和玻璃棒
c.定容时俯视容量瓶刻度线 d.加水超过刻度线,用胶头滴管吸出多余液体
您最近一年使用:0次
2021-02-21更新
|
297次组卷
|
3卷引用:广西壮族自治区柳州市鹿寨县鹿寨中学2021-2022学年高一上学期12月月考化学试题
3 . 亚氯酸钠(NaClO2)是一种高效漂白剂,受热易分解,易溶于水。回答下列问题:
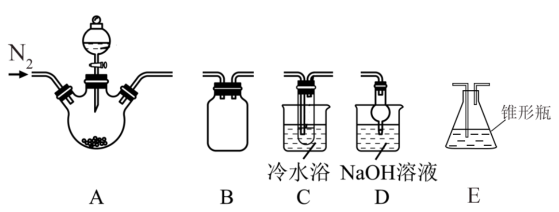
(1)甲同学欲选用上述装置制取亚氯酸钠,装置连接顺序为A→B→C→D,装置A的分液漏斗中盛放浓硫酸,三颈烧瓶中盛放NaClO3和Na2SO3固体,装置C的试管中盛放NaOH和H2O2的混合溶液。已知2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
①装置B、D的作用分别是___________ 、___________ 。
②装置C中发生反应的化学方程式为___________ 。
③取C中试管反应后的混合溶液,经减压蒸发、结晶、过滤、干燥等操作可获得NaClO2固体,采取“减压蒸发”而不用“常压蒸发”的原因是___________ 。
④已知亚氯酸钡易溶于水,请设计实验方案检验所得NaClO2晶体中是否含有杂质Na2SO4:___________ 。
(2)乙同学选用上述A、E装置测定亚氯酸钠样品的纯度,已知NaClO2遇酸生成NaCl,并释放出ClO2.装置A的分液漏斗中盛放稀硫酸,三颈烧瓶中盛放m g样品,E中盛放足量KI和H2SO4的混合溶液,连接好装置,后续步骤如下:
I.用分液漏斗缓慢滴加稀硫酸,充分反应。
II.用c mol·L-1的硫代硫酸钠(Na2S2O3)标准溶液滴定锥形瓶中的溶液(I2+2 =2I-+
=2I-+ ),选用淀粉溶液作指示剂,滴定终点时用去V mL Na2S2O3标准溶液。
),选用淀粉溶液作指示剂,滴定终点时用去V mL Na2S2O3标准溶液。
①装置A中反应结束后,往其中通入N2的作用是___________ 。三颈烧瓶中发生反应的离子方程式为___________ 。
②滴定到终点时的实验现象是___________ 。
③样品中NaClO2的质量分数为___________ (列出计算表达式)。

(1)甲同学欲选用上述装置制取亚氯酸钠,装置连接顺序为A→B→C→D,装置A的分液漏斗中盛放浓硫酸,三颈烧瓶中盛放NaClO3和Na2SO3固体,装置C的试管中盛放NaOH和H2O2的混合溶液。已知2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
①装置B、D的作用分别是
②装置C中发生反应的化学方程式为
③取C中试管反应后的混合溶液,经减压蒸发、结晶、过滤、干燥等操作可获得NaClO2固体,采取“减压蒸发”而不用“常压蒸发”的原因是
④已知亚氯酸钡易溶于水,请设计实验方案检验所得NaClO2晶体中是否含有杂质Na2SO4:
(2)乙同学选用上述A、E装置测定亚氯酸钠样品的纯度,已知NaClO2遇酸生成NaCl,并释放出ClO2.装置A的分液漏斗中盛放稀硫酸,三颈烧瓶中盛放m g样品,E中盛放足量KI和H2SO4的混合溶液,连接好装置,后续步骤如下:
I.用分液漏斗缓慢滴加稀硫酸,充分反应。
II.用c mol·L-1的硫代硫酸钠(Na2S2O3)标准溶液滴定锥形瓶中的溶液(I2+2
 =2I-+
=2I-+ ),选用淀粉溶液作指示剂,滴定终点时用去V mL Na2S2O3标准溶液。
),选用淀粉溶液作指示剂,滴定终点时用去V mL Na2S2O3标准溶液。①装置A中反应结束后,往其中通入N2的作用是
②滴定到终点时的实验现象是
③样品中NaClO2的质量分数为
您最近一年使用:0次
名校
4 . 乙二酸(HOOC—COOH)俗名草酸,M(H2C2O4)=90g/mol,是一种有还原性的有机弱酸,在化学上有广泛应用。
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,加入少量硫酸酸化,用0.1000mol·L-1 KMnO4溶液滴定至草酸恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL。
解答下列问题:
(1)KMnO4标准液装入________ (填“酸式”或“碱式”)滴定管。
(2)KMnO4溶液滴定草酸根过程中发生反应的离子方程式为______________________ ,滴定终点的现象为______________________________________________________ 。
(3)计算此样品的纯度为____________ (保留两位小数)。
(4)误差分析:下列操作会导致测定结果偏高的是______ (填字母)。
a.未用KMnO4标准溶液润洗滴定管
b.滴定前锥形瓶内有少量水
c.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
d.观察读数时,滴定前仰视,滴定后俯视
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,加入少量硫酸酸化,用0.1000mol·L-1 KMnO4溶液滴定至草酸恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL。
解答下列问题:
(1)KMnO4标准液装入
(2)KMnO4溶液滴定草酸根过程中发生反应的离子方程式为
(3)计算此样品的纯度为
(4)误差分析:下列操作会导致测定结果偏高的是
a.未用KMnO4标准溶液润洗滴定管
b.滴定前锥形瓶内有少量水
c.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
d.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
2020-09-28更新
|
165次组卷
|
2卷引用:广西钦州市第四中学2022-2023学年高二上学期11月考试化学试题
10-11高三上·江苏盐城·期中
名校
5 . 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:___________ 。
(2)操作③的目的是什么,用简要的文字说明:____________________________ 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_______ 。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:________________ ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)____________ 。
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
(2)操作③的目的是什么,用简要的文字说明:
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)
您最近一年使用:0次
名校
6 . 已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,ICl3的熔点为111℃,并且已知:ICl(l)+Cl2(g)=ICl3(s)。用下图(中夹持装置略去)的装置制取ICl。
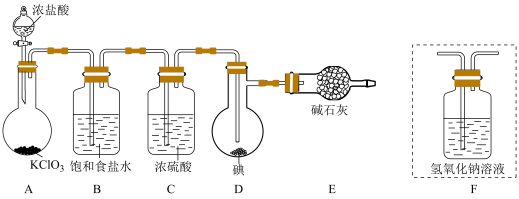
(1)装置A中发生反应的化学方程式是_____________________ 。
(2)装置B的作用是_________ ,不能用装置F代替装置E,理由____________ 。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是____________ (填标号)。
A.过滤 B.蒸发结晶 C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度。进行如下两个实验,实验过程中有关反应为:
①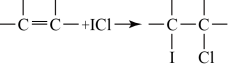
②ICl+KI=I2+KCl
③I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将5.00 g该油脂样品溶于四氯化碳后形成100 mL溶液,从中取出十分之一,加入20 mL某ICl的冰醋酸溶液(过量),充分反应后,加入足量KI溶液,生成的碘单质用a mol/L的Na2S2O3标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1 mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验I完全相同,测得消耗的Na2S2O3溶液的平均体积为V2 mL。
①滴定过程需要的指示剂是___________________ 。
②5.00 g该油脂样品所消耗的ICl的物质的量为________ mol。由此数据经换算即可求得该油脂的不饱和度。

(1)装置A中发生反应的化学方程式是
(2)装置B的作用是
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是
A.过滤 B.蒸发结晶 C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度。进行如下两个实验,实验过程中有关反应为:
①
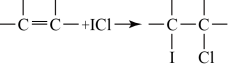
②ICl+KI=I2+KCl
③I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将5.00 g该油脂样品溶于四氯化碳后形成100 mL溶液,从中取出十分之一,加入20 mL某ICl的冰醋酸溶液(过量),充分反应后,加入足量KI溶液,生成的碘单质用a mol/L的Na2S2O3标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1 mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验I完全相同,测得消耗的Na2S2O3溶液的平均体积为V2 mL。
①滴定过程需要的指示剂是
②5.00 g该油脂样品所消耗的ICl的物质的量为
您最近一年使用:0次
2020-09-05更新
|
346次组卷
|
4卷引用:广西南宁市第二中学2022-2023学年高二上学期12月月考化学试卷
名校
解题方法
7 . 某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
下列说法正确的是
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 27.45 |
| 第二次 | 25.00 | 0.00 | 30.30 |
| 第三次 | 25.00 | 0.00 | 17.55 |
下列说法正确的是
| A.该氢氧化钠溶液中c(NaOH)=0.1155mol/L |
| B.当溶液从无色刚好变成红色时,则达到滴定终点 |
| C.达滴定终点时,滴定管尖嘴有悬液,则测定结果偏低 |
| D.实验中锥形瓶应用待测氢氧化钠溶液润洗 |
您最近一年使用:0次
2020-08-04更新
|
1535次组卷
|
6卷引用:广西钦州市2019-2020学年高二下学期期末教学质量监测化学试题
广西钦州市2019-2020学年高二下学期期末教学质量监测化学试题(已下线)第03章 水溶液中的离子平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题湖北省武汉市武钢三中2022-2023学年高二上学期第一次月考化学试题湖北省十堰市汉江中学2021-2022学年高二上学期期中考试化学试题湖北省武汉海淀外国语实验学校2022-2023学年高二上学期10月月考化学试题
8 . 84消毒液、酒精、过氧乙酸等消毒剂在抗击新型冠状病毒肺炎疫情中起到重要作用。回答下列问题:
Ⅰ.84消毒液是北京第一传染病医院(现北京地坛医院)于1984年研制的一种消毒液,主要成分为受热易分解的次氯酸钠(NaClO)。某实验小组用如图装置制备84消毒液。
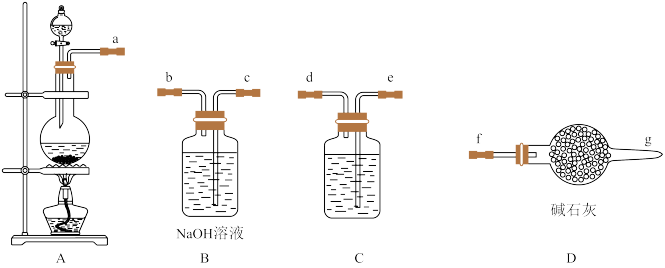
(1)A中发生反应的离子方程式为___ 。
(2)C中盛装试剂为__ ,仪器的连接顺序为a→__ 。
(3)制备84消毒液时,若Cl2与NaOH溶液反应温度过高,NaClO的产率将__ (填“增大”“减小”或“不变”)。
Ⅱ.过氧乙酸(CH3COOOH)是无色液体,易溶于水,有强烈刺激性气味,有腐蚀性,对人的眼睛、皮肤、黏膜、上呼吸道等有强烈刺激作用,易分解,易爆炸。
(4)贮存和运输CH3COOOH时要注意的事项是__ 。
(5)消毒过程中需将200mL20%的过氧乙酸(密度为1.02g·cm-3)稀释为0.5%的过氧乙酸,则需加入水的体积为__  。
。
(6)CH3COOOH可用H2O2和CH3COOH制备,其化学方程式为___ 。
(7)制备CH3COOOH过程中总会残留少量H2O2,因此CH3COOOH在使用过程中需要准确标定原液的浓度。取CH3COOOH样品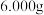 ,标定步骤如下:
,标定步骤如下:
a.用KMnO4标准溶液滴定H2O2;
b.当达到终点时加入足量KI溶液,发生反应:2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
c.用1.500mol·L-1Na2S2O3标准溶液滴定生成的I2,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液20.00mL。
测得样品中CH3COOOH的质量分数为___ 。
Ⅰ.84消毒液是北京第一传染病医院(现北京地坛医院)于1984年研制的一种消毒液,主要成分为受热易分解的次氯酸钠(NaClO)。某实验小组用如图装置制备84消毒液。

(1)A中发生反应的离子方程式为
(2)C中盛装试剂为
(3)制备84消毒液时,若Cl2与NaOH溶液反应温度过高,NaClO的产率将
Ⅱ.过氧乙酸(CH3COOOH)是无色液体,易溶于水,有强烈刺激性气味,有腐蚀性,对人的眼睛、皮肤、黏膜、上呼吸道等有强烈刺激作用,易分解,易爆炸。
(4)贮存和运输CH3COOOH时要注意的事项是
(5)消毒过程中需将200mL20%的过氧乙酸(密度为1.02g·cm-3)稀释为0.5%的过氧乙酸,则需加入水的体积为
 。
。(6)CH3COOOH可用H2O2和CH3COOH制备,其化学方程式为
(7)制备CH3COOOH过程中总会残留少量H2O2,因此CH3COOOH在使用过程中需要准确标定原液的浓度。取CH3COOOH样品
 ,标定步骤如下:
,标定步骤如下:a.用KMnO4标准溶液滴定H2O2;
b.当达到终点时加入足量KI溶液,发生反应:2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
c.用1.500mol·L-1Na2S2O3标准溶液滴定生成的I2,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液20.00mL。
测得样品中CH3COOOH的质量分数为
您最近一年使用:0次
2020-06-18更新
|
618次组卷
|
5卷引用:广西南宁市第十中学2020-2021学年高二上学期期中考试化学(理)试题
广西南宁市第十中学2020-2021学年高二上学期期中考试化学(理)试题云南省昆明市2020届高三“三诊一模”高考模拟考试(三模)理综化学试题(已下线)第一单元 物质的量测试题-2021年高考化学一轮复习名师精讲练福建省永安市第三中学2021届高三9月月考化学试题甘肃省天水市甘谷县第四中学2021届高三上学期第二次检测化学试题
名校
解题方法
9 . 某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用_______ 式滴定管,该滴定实验可使用的指示剂为_______ ,达到滴定终点的现象为____________________________
(2)样品中氨的质量分数表达式为__________________________
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为________ mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)。
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用
(2)样品中氨的质量分数表达式为
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为
您最近一年使用:0次
10 . I .甲、乙、丙3位同学,在已知盐酸是强酸的基础上,通过实验验证醋酸是弱酸,分别设计了如下实验方案:
甲:分别准确配制0.1 mol/L的盐酸和醋酸各250 mL,再用pH试纸分别测定两溶液的pH。
乙:分别准确配制0.1 mol/L的盐酸和醋酸各250 mL。各取出20 mL于锥形瓶中,逐滴加入0.1 mol/L标准NaOH溶液(不需配制),分别记录恰好中和时用去NaOH溶液的体积。
丙:分别准确配制pH=1的盐酸和醋酸各250 mL。各取出10 mL加水稀释到100 mL后比较稀释后溶液的pH。回答下列问题:
(1)甲同学的实验结果为盐酸和醋酸的pH分别为pH1和pH2,则pH1_____ pH2(填“>”“<”或“=”),所以此实验方案________ (填“可行”或“不可行”)。
(2)乙同学的实验结果为盐酸和醋酸分别用去NaOH溶液V1 mL和V2 mL,则V1____ V2(填“>”“<”或“=”),所以此实验方案______ (填“可行”或“不可行”)。
(3)丙同学的实验方案不可行的原因是____________________________________ 。
II. 测定Na2S2O3样品纯度。
取10.0 g Na2S2O3·5H2O样品,配成 250mL溶液,准确量取25.00 mL溶液,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。三次平行实验测得的数据如下:
已知:2Na2S2O3+I2=Na2S4O6+2NaI
①滴定终点的颜色为__________________ 。
②该Na2S2O3·5H2O样品的纯度为___ %(保留2位小数)(已知Na2S2O3·5H2O的M=248g mol·-1)。
③若样品中含Na2SO3(还原性:SO32->I-),则测得的结果_______ (填“偏高”“偏低”或“无影响”)
甲:分别准确配制0.1 mol/L的盐酸和醋酸各250 mL,再用pH试纸分别测定两溶液的pH。
乙:分别准确配制0.1 mol/L的盐酸和醋酸各250 mL。各取出20 mL于锥形瓶中,逐滴加入0.1 mol/L标准NaOH溶液(不需配制),分别记录恰好中和时用去NaOH溶液的体积。
丙:分别准确配制pH=1的盐酸和醋酸各250 mL。各取出10 mL加水稀释到100 mL后比较稀释后溶液的pH。回答下列问题:
(1)甲同学的实验结果为盐酸和醋酸的pH分别为pH1和pH2,则pH1
(2)乙同学的实验结果为盐酸和醋酸分别用去NaOH溶液V1 mL和V2 mL,则V1
(3)丙同学的实验方案不可行的原因是
II. 测定Na2S2O3样品纯度。
取10.0 g Na2S2O3·5H2O样品,配成 250mL溶液,准确量取25.00 mL溶液,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。三次平行实验测得的数据如下:
| 实验序号 | 消耗标准溶液体积/mL |
| 1 | 19.98 |
| 2 | 17.90 |
| 3 | 18.10 |
①滴定终点的颜色为
②该Na2S2O3·5H2O样品的纯度为
③若样品中含Na2SO3(还原性:SO32->I-),则测得的结果
您最近一年使用:0次



