名校
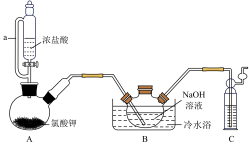
1 . 二氯异氰尿酸钠[(CNO)3Cl2Na]常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体,在10℃时反应制备二氯异氰尿酸钠,装置如图所示(部分夹持装置略)。
(1)C中所装试剂为___________ (填化学式)
(2)A中反应的化学方程式为___________ 。
(3)待装置B中出现___________ 现象时,可由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入Cl2的理由是___________ 。
(4)反应结束后,装置B中的浊液经过滤、___________ 、干燥得粗产品。上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是___________ 。
(5)通过下列实验,可以测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:[(CNO)3Cl2]-+ H++ 2H2O = (CNO)3H3+ 2HClO;HClO + 2I-+ H+= I2+ Cl-+ H2O;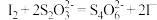 。
。
实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取12.50 mL上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应,用c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为V mL。
①滴定终点现象为___________ 。
②该样品的有效氯含量表达式为(化为最简式)___________ 。
(提示:该样品的有效氯=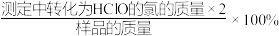 )
)
(1)C中所装试剂为
(2)A中反应的化学方程式为
(3)待装置B中出现
(4)反应结束后,装置B中的浊液经过滤、
(5)通过下列实验,可以测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:[(CNO)3Cl2]-+ H++ 2H2O = (CNO)3H3+ 2HClO;HClO + 2I-+ H+= I2+ Cl-+ H2O;
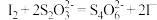 。
。实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取12.50 mL上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应,用c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为V mL。
①滴定终点现象为
②该样品的有效氯含量表达式为(化为最简式)
(提示:该样品的有效氯=
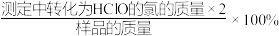 )
)
您最近一年使用:0次
2023-12-31更新
|
111次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
名校
2 . 稀土元素钪(Sc)广泛应用于航空航天、超导、激光、核能等领域,从钛白水解工业废酸(含 、
、 、
、 、
、 、
、 等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下: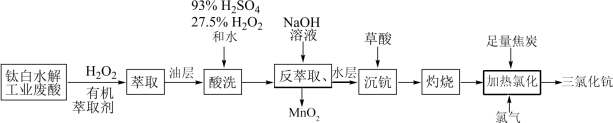
 为砖红色固体;
为砖红色固体; ,
,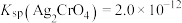 。
。请回答下列问题:
(1)萃取操作使用到的仪器如何检漏
(2)在钛白水解工业废酸中,加入
 是为了使
是为了使 转化为
转化为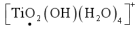 ,若该离子中Ti的化合价为+4价,则黑点标的氧元素价态为
,若该离子中Ti的化合价为+4价,则黑点标的氧元素价态为(3)若温度对钪、钛的萃取率影响情况见下表,一般合适的萃取温度为10~15℃,其理由是
| T/℃ | 5 | 10 | 15 | 25 | 30 |
| 钪的萃取率/% | 91.3 | 96 | 97.1 | 97.3 | 98.0 |
| 钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(4)反萃取步骤中,强碱性条件下双氧水可以氧化锰离子生成MnO2,则该反应的离子方程式为
(5)上述工艺流程在“灼烧”步骤中可得到Sc2O3,已知在后续的“加热氯化”步骤中可得到一种使热的氧化铜由黑变红的气体,请依题写出此时由Sc2O3制备ScCl3的化学方程式:
(6)现取制得的ScCl3粗产品(只含难溶Sc2O3杂质)溶于水,配成溶液,采用K2CrO4为指示剂,用AgNO3标准溶液滴定,当达到滴定终点,溶液中Cl-恰好沉淀完全[假设此时c(Cl-)为
 ]时,则此时溶液中c(
]时,则此时溶液中c( )的浓度为
)的浓度为
您最近一年使用:0次
2023-12-31更新
|
373次组卷
|
4卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
名校
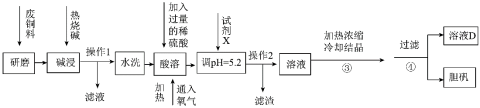
3 . 废旧金属的回收利用是重要研究课题。某小组在实验室中模拟利用含铜废料(主要成分为Cu和CuO,还有少量的Al、Fe及其氧化物)生产胆矾,其实验方案如下:
(1)上述流程中,将废铜料“研磨”的目的是___________ 。
(2)操作1所得的滤液的主要成分是___________ 。
(3)请写出“酸溶”过程中单质铜主要发生反应的化学方程式___________ ,可以用另一种试剂替代氧气,该试剂是___________ 。
(4)调pH =5.2的目的是___________ 。
(5)为测定胆矾的纯度,称量5g胆矾固体配置成250 mL溶液,移取25.00 mL溶液,加入H2SO4溶液酸化,再加过量的KI溶液,混匀并放置,用0.1000mol/L Na2S2O3溶液滴定,至棕色较浅时加入淀粉溶液,继续滴至蓝紫色恰好消失,消耗16.00 mL,测得胆矾的纯度为___________ (已知:2Cu2++ 4I− = 2CuI↓ + I2;I2 + 2 = 2I− +
= 2I− +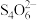 )。滴定过程中CuI表面会吸附I2,则该测定结果
)。滴定过程中CuI表面会吸附I2,则该测定结果___________ (填“偏大”、“偏小”或“无影响”)。
(1)上述流程中,将废铜料“研磨”的目的是
(2)操作1所得的滤液的主要成分是
(3)请写出“酸溶”过程中单质铜主要发生反应的化学方程式
(4)调pH =5.2的目的是
(5)为测定胆矾的纯度,称量5g胆矾固体配置成250 mL溶液,移取25.00 mL溶液,加入H2SO4溶液酸化,再加过量的KI溶液,混匀并放置,用0.1000mol/L Na2S2O3溶液滴定,至棕色较浅时加入淀粉溶液,继续滴至蓝紫色恰好消失,消耗16.00 mL,测得胆矾的纯度为
 = 2I− +
= 2I− +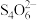 )。滴定过程中CuI表面会吸附I2,则该测定结果
)。滴定过程中CuI表面会吸附I2,则该测定结果
您最近一年使用:0次
2023-12-31更新
|
64次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
名校
解题方法
4 . 三氯化六氨合钴(Ⅲ)是科研和化工上一种常用的化学试剂,在工业上用途广泛。实验室制备三氯化六氨合钴(Ⅲ)配合物的反应方程式为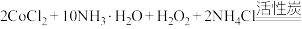
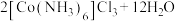 。制备的实验步骤如图所示:
。制备的实验步骤如图所示: 不易被氧化,
不易被氧化, 具有较强还原性,
具有较强还原性,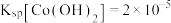 ;
;
② 在不同温度下水中的溶解度曲线如图所示;
在不同温度下水中的溶解度曲线如图所示; 在强碱热溶液中可以生成
在强碱热溶液中可以生成 。
。
回答下列问题:
(1)1mol 中含有的共价键数目为
中含有的共价键数目为_____  。该实验中用到的浓氨水也可用
。该实验中用到的浓氨水也可用 代替,实验室制备
代替,实验室制备 的化学方程式是
的化学方程式是_____ 。
(2)制备过程中 的作用:①作反应物;②防止生成
的作用:①作反应物;②防止生成_____ (填化学式)。
(3)步骤④中要冷却至10℃,再缓慢地边搅拌边加入 溶液,这样操作的目的是
溶液,这样操作的目的是_____ 。
(4)步骤⑦中操作A的名称为_____ 。
(5)步骤⑨晶体依次用稀盐酸、乙醇洗涤,用稀盐酸洗涤的原因是_____ 。
(6)测定产品中 的含量:
的含量:
①蒸氨:三颈烧瓶中依次加入xg样品和过量浓NaOH溶液,并加热,蒸出的 通入盛有
通入盛有 mL
mL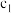 mol/L
mol/L 溶液的锥形瓶中。
溶液的锥形瓶中。
②滴定:滴定时选用甲基橙为指示剂,用 mol/LNaOH溶液滴定剩余的
mol/LNaOH溶液滴定剩余的 ,消耗
,消耗 mLNaOH溶液。
mLNaOH溶液。 的质量分数为
的质量分数为_____ 。若用NaOH溶液滴定结束时俯视读数,测得 的含量
的含量_____ (填“偏高”“偏低”或“无影响”)。
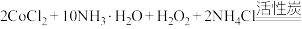
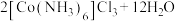 。制备的实验步骤如图所示:
。制备的实验步骤如图所示: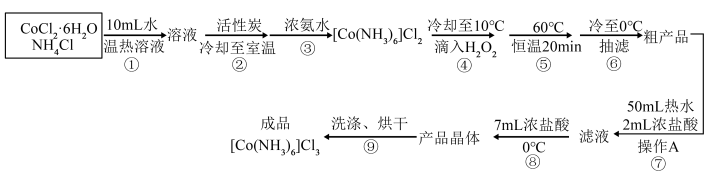
 不易被氧化,
不易被氧化, 具有较强还原性,
具有较强还原性,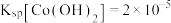 ;
;②
 在不同温度下水中的溶解度曲线如图所示;
在不同温度下水中的溶解度曲线如图所示;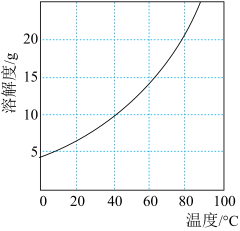
 在强碱热溶液中可以生成
在强碱热溶液中可以生成 。
。回答下列问题:
(1)1mol
 中含有的共价键数目为
中含有的共价键数目为 。该实验中用到的浓氨水也可用
。该实验中用到的浓氨水也可用 代替,实验室制备
代替,实验室制备 的化学方程式是
的化学方程式是(2)制备过程中
 的作用:①作反应物;②防止生成
的作用:①作反应物;②防止生成(3)步骤④中要冷却至10℃,再缓慢地边搅拌边加入
 溶液,这样操作的目的是
溶液,这样操作的目的是(4)步骤⑦中操作A的名称为
(5)步骤⑨晶体依次用稀盐酸、乙醇洗涤,用稀盐酸洗涤的原因是
(6)测定产品中
 的含量:
的含量:①蒸氨:三颈烧瓶中依次加入xg样品和过量浓NaOH溶液,并加热,蒸出的
 通入盛有
通入盛有 mL
mL mol/L
mol/L 溶液的锥形瓶中。
溶液的锥形瓶中。②滴定:滴定时选用甲基橙为指示剂,用
 mol/LNaOH溶液滴定剩余的
mol/LNaOH溶液滴定剩余的 ,消耗
,消耗 mLNaOH溶液。
mLNaOH溶液。 的质量分数为
的质量分数为 的含量
的含量
您最近一年使用:0次
2023-12-31更新
|
278次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
名校
解题方法
5 . 电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用xmol/L盐酸标准溶液测定ymL某Na2CO3样品溶液中NaHCO3的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法正确的是
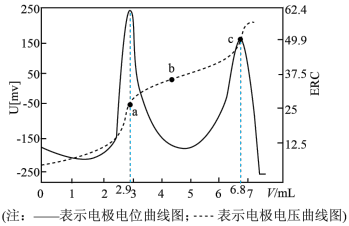
| A.该滴定过程需要加入酸碱指示剂 |
B.a点溶液中: |
C.b到c过程中存在 ,水的电离程度:b<c ,水的电离程度:b<c |
D.ymL该 样品溶液中含有 样品溶液中含有 的质量为0.084xg 的质量为0.084xg |
您最近一年使用:0次
2023-12-31更新
|
453次组卷
|
4卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷云南省昆明市云南师范大学附属中学2023-2024学年高三上学期适应性月考卷(五)理综化学试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)福建省厦门双十中学2024届高三模拟预测化学试题
6 . 碘酸钙[Ca(IO3)2]是一种既能补碘又能补钙的新型饲料添加剂。某实验小组设计了如下实验制备Ca(IO3)2并测定其含量。
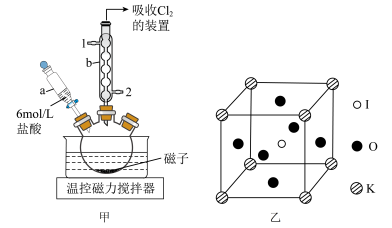
(一).Ca(IO3)2的制备。
步骤①:在图甲所示的装置中依次加入2.20gI2、2.00gKClO3和45mL水,搅拌,滴加约8滴6mol/L盐酸,
使pH=1,85°C左右水浴加热,直至反应完全。
步骤②:将反应后的液体转入烧杯中,滴加2mL30%KOH溶液,使pH=10。
步骤③:用滴管逐渐加入10mL1mol/LCaCl2溶液,并不断搅拌,有白色沉淀生成。
步骤④:在冰水中静置10分钟,抽滤,用少量冷水洗三次,再用少量无水乙醇洗一次,抽干后,将产品转移到滤纸上,晾干。
(1)仪器a的名称为_____ ,仪器b中冷凝水从_____ (填“1”或“2”)口进。
(2)“步骤①”中发生反应:2KClO3+I2+HCl=KIO3·HIO3+Cl2↑+KCl,其中I2和Cl2的熔点,较高的是_____ (填“Cl2”或“I2”)。
(3)“步骤②”中发生反应的化学方程式为_____ 。KIO3的立方晶胞如图乙所示,则KIO3晶体中与K紧邻的O个数为_____ 。
(4)“步骤④”中,在冰水中静置的目的是_____ ,便于过滤。
(二).产品中Ca(IO3)2的含量测定。
称取mg粗产品,配制成250mL溶液。每次移取50.00mL置于250mL碘量瓶中,高氯酸酸化后,加入过量KI,盖上瓶塞,在暗处放置3分钟,发生反应:IO +5I-+6H+=3I2+3H2O,加入淀粉溶液作为指示剂,然后用cmol/LNa2S2O3标准溶液滴定,发生反应:I2+2S2O
+5I-+6H+=3I2+3H2O,加入淀粉溶液作为指示剂,然后用cmol/LNa2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,三次滴定平均消耗VmLNa2S2O3标准溶液。
,三次滴定平均消耗VmLNa2S2O3标准溶液。
(5)滴定终点的现象为_____ 。
(6)设Ca(IO3)2的摩尔质量为Mg/mol,则Ca(IO3)2的纯度为_____ (用含c、m、M的式子表示)。

(一).Ca(IO3)2的制备。
步骤①:在图甲所示的装置中依次加入2.20gI2、2.00gKClO3和45mL水,搅拌,滴加约8滴6mol/L盐酸,
使pH=1,85°C左右水浴加热,直至反应完全。
步骤②:将反应后的液体转入烧杯中,滴加2mL30%KOH溶液,使pH=10。
步骤③:用滴管逐渐加入10mL1mol/LCaCl2溶液,并不断搅拌,有白色沉淀生成。
步骤④:在冰水中静置10分钟,抽滤,用少量冷水洗三次,再用少量无水乙醇洗一次,抽干后,将产品转移到滤纸上,晾干。
(1)仪器a的名称为
(2)“步骤①”中发生反应:2KClO3+I2+HCl=KIO3·HIO3+Cl2↑+KCl,其中I2和Cl2的熔点,较高的是
(3)“步骤②”中发生反应的化学方程式为
(4)“步骤④”中,在冰水中静置的目的是
(二).产品中Ca(IO3)2的含量测定。
称取mg粗产品,配制成250mL溶液。每次移取50.00mL置于250mL碘量瓶中,高氯酸酸化后,加入过量KI,盖上瓶塞,在暗处放置3分钟,发生反应:IO
 +5I-+6H+=3I2+3H2O,加入淀粉溶液作为指示剂,然后用cmol/LNa2S2O3标准溶液滴定,发生反应:I2+2S2O
+5I-+6H+=3I2+3H2O,加入淀粉溶液作为指示剂,然后用cmol/LNa2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,三次滴定平均消耗VmLNa2S2O3标准溶液。
,三次滴定平均消耗VmLNa2S2O3标准溶液。(5)滴定终点的现象为
(6)设Ca(IO3)2的摩尔质量为Mg/mol,则Ca(IO3)2的纯度为
您最近一年使用:0次
名校
解题方法
7 . І.甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90.77kJ/mol
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
(1)反应③的ΔH3=___________
(2)若反应①在恒容密闭容器中进行,能判断反应已达化学平衡状态的是___________(填字母)。
(3)在一定温度和催化剂存在下,向2L密闭容器中充入5molCO2和5molH2发生反应①5min时达到平衡,测得CO2还剩4mol。
①该时间内用氢气表示的反应速率v(H2)为___________ 。
②达平衡时反应①的平衡常数K为___________ (填计算结果)。
Ⅱ.用滴定法可以测定食醋中醋酸的含量,用酸式滴定管取10.00mL这种市售食醋,置于已知烧杯中称得其质量为12.50g,再稀释至100mL,滴定时每次取20.00mL于锥形瓶中,选用的标准溶液是0.1125mol/LNaOH溶液滴定至终点,平均每次消耗NaOH溶液20.00mL。
(4)该实验中的指示剂应选择___________ ,判断滴定终点的方法为___________ 。
(5)该食醋中CH3COOH的质量分数为___________ (结果保留三位有效数字)。
(6)滴定过程中下列操作会导致测定的CH3COOH的质量分数偏小的是(其它操作均正确)___________
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90.77kJ/mol
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
(1)反应③的ΔH3=
(2)若反应①在恒容密闭容器中进行,能判断反应已达化学平衡状态的是___________(填字母)。
| A.CO2百分含量保持不变 | B.容器中H2浓度与CO2浓度之比为3∶1 |
| C.容器中混合气体的密度保持不变 | D.CO2的生成速率与CH3OH的生成速率相等 |
(3)在一定温度和催化剂存在下,向2L密闭容器中充入5molCO2和5molH2发生反应①5min时达到平衡,测得CO2还剩4mol。
①该时间内用氢气表示的反应速率v(H2)为
②达平衡时反应①的平衡常数K为
Ⅱ.用滴定法可以测定食醋中醋酸的含量,用酸式滴定管取10.00mL这种市售食醋,置于已知烧杯中称得其质量为12.50g,再稀释至100mL,滴定时每次取20.00mL于锥形瓶中,选用的标准溶液是0.1125mol/LNaOH溶液滴定至终点,平均每次消耗NaOH溶液20.00mL。
(4)该实验中的指示剂应选择
(5)该食醋中CH3COOH的质量分数为
(6)滴定过程中下列操作会导致测定的CH3COOH的质量分数偏小的是(其它操作均正确)___________
| A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次 |
| B.滴定开始前碱式滴定管尖嘴部分无气泡,在滴定终点读数时发现气泡 |
| C.达到滴定终点时,俯视溶液凹液面最低点读数 |
| D.滴定过程中,部分NaOH溶液滴到锥形瓶外 |
您最近一年使用:0次
名校
8 . 常温下,某实验人员在两个相同的容器中分别加入20 mL 0.2 mol⋅L-1  溶液和40 mL 0.1 mol⋅L-1 NaHA溶液,再分别用0.2 mol⋅L-1盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(已知
溶液和40 mL 0.1 mol⋅L-1 NaHA溶液,再分别用0.2 mol⋅L-1盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(已知 溶液达到某浓度后,会放出一定量气体,溶液体积变化可忽略不计)
溶液达到某浓度后,会放出一定量气体,溶液体积变化可忽略不计)
 溶液和40 mL 0.1 mol⋅L-1 NaHA溶液,再分别用0.2 mol⋅L-1盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(已知
溶液和40 mL 0.1 mol⋅L-1 NaHA溶液,再分别用0.2 mol⋅L-1盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(已知 溶液达到某浓度后,会放出一定量气体,溶液体积变化可忽略不计)
溶液达到某浓度后,会放出一定量气体,溶液体积变化可忽略不计)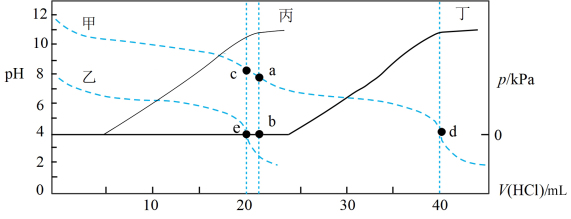
| A.图中曲线乙和丙代表向NaHA溶液中滴加盐酸 |
B.由图可知,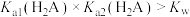 |
C.a点溶液中存在: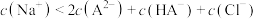 |
| D.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂 |
您最近一年使用:0次
2023-12-22更新
|
141次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
9 . 大苏打(Na2S2O3)是一种重要的化工产品,也是实验室常用试剂。某小组对大苏打展开如下探究。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:
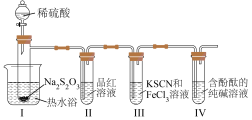
实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是_______ ,其他条件相同时,若拆去热水浴,试管Ⅱ中溶液褪色速率变_______ (填“快”或“慢”)。
(2)装置Ⅰ中的离子方程式为_______ 。
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为 的试剂是
的试剂是_______ 。由试管Ⅳ中现象可知,电离常数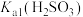
_______ (填“>”“<”或“=”) 。
。
实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
(4)
_______ 。
(5)实验记录: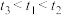 。由实验①②得出的结论是
。由实验①②得出的结论是_______ 。设计实验①③的目的是_______ 。
实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示: 。
。
(6)Na2S2O3∙xH2O中x为_______ 。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:

实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是
(2)装置Ⅰ中的离子方程式为
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为
 的试剂是
的试剂是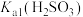
 。
。实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
| 编号 | 0.1mol∙L-1 Na2S2O3溶液的体积/mL | 0.1mol∙L-1 H2SO4溶液的体积/mL | 水的体积/mL | 水浴温度/℃ | 测定变浑浊时间/s |
| ① | 10.0 | 15.0 | 0 | 35 |  |
| ② | 10.0 | 10.0 |  | 35 |  |
| ③ |  | 15.0 | 0 | 45 |  |
(4)

(5)实验记录:
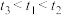 。由实验①②得出的结论是
。由实验①②得出的结论是实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示:
 。
。(6)Na2S2O3∙xH2O中x为
您最近一年使用:0次
2023-12-15更新
|
196次组卷
|
5卷引用:广西壮族自治区钦州市第四中学2023-2024学年高三上学期11月份考试化学试卷
解题方法
10 . 利用草酸( )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。
实验流程:取血样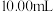 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙[
]溶液,析出草酸钙[ ]沉淀,将此沉淀洗涤后溶于强酸得草酸(
]沉淀,将此沉淀洗涤后溶于强酸得草酸( ),再用硫酸酸化的
),再用硫酸酸化的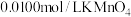 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液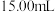 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。
(1) 标准溶液应用
标准溶液应用___________ (填“酸式”或“碱式”)滴定管盛装,注入 标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和
标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和___________ 。
(2)①滴定前,装有 标准液的滴定管排气泡时,应选择下图中的
标准液的滴定管排气泡时,应选择下图中的_______ (填标号,下同)。
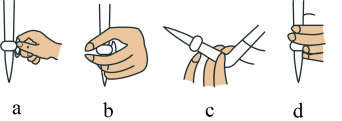
②若用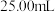 滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积
滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积_______ 。
A.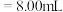 B.
B.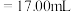 C.
C.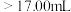 D.
D.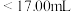
(3)请写出滴定过程中发生的离子反应方程式:___________ 。
(4)判断达到滴定终点的现象是___________ 。
(5)血液样品中 浓度为
浓度为___________  (保留2位有效数字)。
(保留2位有效数字)。
(6)判断下列操作对血液中钙离子的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①滴定前盛装酸性 标准溶液的滴定管未润洗,使测定结果
标准溶液的滴定管未润洗,使测定结果_______ 。
②滴定结束时俯视读数,使测定结果___________ 。
 )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。实验流程:取血样
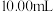 ,加适量的草酸铵[
,加适量的草酸铵[ ]溶液,析出草酸钙[
]溶液,析出草酸钙[ ]沉淀,将此沉淀洗涤后溶于强酸得草酸(
]沉淀,将此沉淀洗涤后溶于强酸得草酸( ),再用硫酸酸化的
),再用硫酸酸化的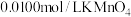 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液
溶液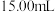 。即可计算出血液中钙离子的浓度。
。即可计算出血液中钙离子的浓度。(1)
 标准溶液应用
标准溶液应用 标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和
标准溶液之前,滴定管需要检查滴定管是否漏水、洗涤和(2)①滴定前,装有
 标准液的滴定管排气泡时,应选择下图中的
标准液的滴定管排气泡时,应选择下图中的
②若用
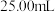 滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积
滴定管进行实验,当滴定管中的液面在刻度“8.00”处,则管内液体的体积A.
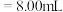 B.
B.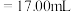 C.
C.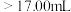 D.
D.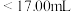
(3)请写出滴定过程中发生的离子反应方程式:
(4)判断达到滴定终点的现象是
(5)血液样品中
 浓度为
浓度为 (保留2位有效数字)。
(保留2位有效数字)。(6)判断下列操作对血液中钙离子的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①滴定前盛装酸性
 标准溶液的滴定管未润洗,使测定结果
标准溶液的滴定管未润洗,使测定结果②滴定结束时俯视读数,使测定结果
您最近一年使用:0次



