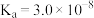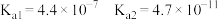名校
1 . 根据下列实验操作过程中颜色变化所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向含AgCl和AgBr的饱和溶液中加入足量浓AgNO3溶液,产生两种颜色沉淀,但以白色为主 | 溶液中 减小 减小 |
| B | 将石油分馏的产品石蜡加热,产生的气体通入酸性高锰酸钾溶液中,溶液紫红色逐渐褪去 | 石油中含有烯烃 |
| C | 向滴有酚酞的氨水中加入CH3COONH4固体,溶液的红色变浅 | CH3COONH4溶液呈酸性 |
| D | 将NaClO溶液滴入品红溶液中,品红溶液缓慢褪色;若同时加入食醋,红色很快褪去 | ClO-的氧化性随pH的减小而增强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 实验小组探究酸对Fe3++3SCN-⇌Fe(SCN)3平衡的影响。将0.005mol·L-1FeCl3溶液(接近无色)和0.01mol·L-1KSCN溶液等体积混合,得到红色溶液。
(1)FeCl3溶液呈酸性的原因是___ (用离子方程式表示)。
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中___ 增大,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
[查阅资料]
Fe3+和Cl-、SO 均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO
均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO ⇌[Fe(SO4)2]-(无色)。
⇌[Fe(SO4)2]-(无色)。
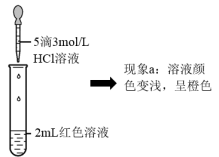
实验I.探究现象a中溶液颜色变化的原因
(3)实验①的目的是___ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:___ 。
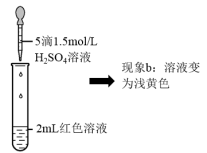
实验II.探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是___ 。
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:___ 、___ 。
(1)FeCl3溶液呈酸性的原因是
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
 |  |
Fe3+和Cl-、SO
 均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO
均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO ⇌[Fe(SO4)2]-(无色)。
⇌[Fe(SO4)2]-(无色)。实验I.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol·L-1KCl溶液 | 溶液颜色变浅,呈橙色 |
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验II.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL0.0025mol·L-1Fe2(SO4)3溶液(无色)。加入1mL0.01mol·L-1KSCN溶液,再加入5滴1.5mol·L-1H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol·L-1FeCl3溶液, |
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
2021-04-01更新
|
558次组卷
|
9卷引用:河北省石家庄市第二中学2021届高三3月学情考试化学试题
河北省石家庄市第二中学2021届高三3月学情考试化学试题北京市海淀区2021届高三上学期期末考试化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)江苏省宜兴市张渚高级中学2020-2021学年高二下学期期中考试化学试题(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)北京市第十五中学2021-2022学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题北京市清华大学附属中学2022-2023学年高三上学期12月统练六化学试题(已下线)北京市海淀区2022届高三一模(实验探究题)
3 . 磷能形成次磷酸(H3PO2)、亚磷酸(H3PO3)等多种含氧酸。
(1)次磷酸(H3PO2)属于元酸,是一种精细化工产品。设计一种实验方案,证明H3PO2是弱酸:____ 。(可选择的试剂为:0.1mol·L-1NaH2PO2溶液、0.1mol·L-1的H3PO2溶液、0.1ml·L-1的盐酸)
(2)亚磷酸(H3PO3)是二元弱酸,常温下向1L0.5mol·LH3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示:
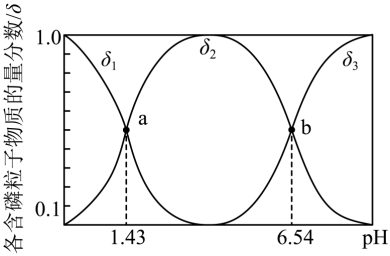
①当溶液pH从6.54变为7时发生反应的离子方程式为____ 。
②Na2HPO3溶液显碱性,原因是(用离子方程式表示)____ 。
③室温下,H3PO3的电离平衡常数为Ka1和Ka2,则pKa2=____ (pKa2=lgKa2)。
④0.1mol·L-1NaH2PO3溶液中各离子浓度由大到小顺序为____ 。
(1)次磷酸(H3PO2)属于元酸,是一种精细化工产品。设计一种实验方案,证明H3PO2是弱酸:
(2)亚磷酸(H3PO3)是二元弱酸,常温下向1L0.5mol·LH3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示:

①当溶液pH从6.54变为7时发生反应的离子方程式为
②Na2HPO3溶液显碱性,原因是(用离子方程式表示)
③室温下,H3PO3的电离平衡常数为Ka1和Ka2,则pKa2=
④0.1mol·L-1NaH2PO3溶液中各离子浓度由大到小顺序为
您最近一年使用:0次
解题方法
4 . 根据下列实验操作及现象,所得结论错误的是
选项 | 实验操作及现象 | 结论\ |
A. | 向溶有 的 的 溶液中滴加 溶液中滴加 溶液,产生白色沉淀 溶液,产生白色沉淀 |  具有强氧化性 具有强氧化性 |
B. |  ,用 ,用 计测得 计测得 某一元酸(HR)溶液的 某一元酸(HR)溶液的 | HR为弱电解质 |
C. | 向 溶液中加入乙醇,析出深蓝色晶体 溶液中加入乙醇,析出深蓝色晶体 |  在水-乙醇混合溶剂中的溶解度较小 在水-乙醇混合溶剂中的溶解度较小 |
D. | 将 与 与 用导线相连,插入稀硫酸酸化的 用导线相连,插入稀硫酸酸化的 溶液,一段时间后,从 溶液,一段时间后,从 电极区取出少量溶液,滴入2滴 电极区取出少量溶液,滴入2滴 溶液,无明显现象 溶液,无明显现象 | Zn可以保护 不被腐蚀 不被腐蚀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-21更新
|
533次组卷
|
3卷引用:河北省重点高中2023-2024学年高三下学期第三次模拟化学试题
名校
5 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 用pH计测定相同浓度的 溶液和NaClO溶液的pH,前者的pH小于后者的 溶液和NaClO溶液的pH,前者的pH小于后者的 | HClO的酸性弱于 |
| B | 向较浓的 溶液中滴入少量酸性 溶液中滴入少量酸性 溶液,观察 溶液,观察 溶液紫色是否褪去 溶液紫色是否褪去 | 证明 有还原性 有还原性 |
| C | 常温下测得0.1mol/L 溶液和0.1mol/L 溶液和0.1mol/L 溶液的pH分别为0.7和1.0 溶液的pH分别为0.7和1.0 | 硫元素的非金属性强于氮元素 |
| D | 向2mL1mol/LNaOH溶液中加1mL0.1mol/L 溶液,产生白色沉淀;再加入1mL0.1mol/L 溶液,产生白色沉淀;再加入1mL0.1mol/L 溶液,产生红褐色沉淀。 溶液,产生红褐色沉淀。 | 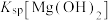 大于 大于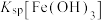 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-17更新
|
780次组卷
|
6卷引用:河北省邢台市第一中学2022-2023学年高二上学期期末考试化学试题
解题方法
6 . 下表是常温下几种物质的平衡常数,据此回答问题。
(1)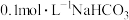 溶液的
溶液的
_______ (填“>”“<”或“=”)7,判断的理由为_______ 。
(2)常温下,用一定体积的 的盐酸和
的盐酸和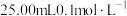 的氨水混合,充分反应后溶液中
的氨水混合,充分反应后溶液中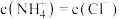 ,此时溶液为
,此时溶液为_______ (填“酸性”“碱性”或“中性”),所加盐酸的体积V_______ (填“>”“<”或“=”) 。
。
(3)常温下,用 溶液与同浓度的
溶液与同浓度的 溶液等体积混合,充分反应后溶液中的元素守恒(物料守恒)关系式为
溶液等体积混合,充分反应后溶液中的元素守恒(物料守恒)关系式为_______ 。
(4)以下反应的离子方程式书写正确的是_______ (填正确选项相应的字母)。
A. 次氯酸钠溶液吸收少量二氧化硫: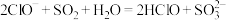
B. 醋酸除水垢: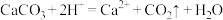
C. 溶液吸收少量
溶液吸收少量
(5)常温下将 通入氨水中,当溶液中的
通入氨水中,当溶液中的 时,溶液的
时,溶液的 为
为_______ 。
(6)调节 除去
除去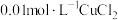 溶液中的少量
溶液中的少量 ,应该调节溶液的
,应该调节溶液的 范围是
范围是_______ (已知离子浓度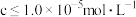 时,可认为已除尽)。
时,可认为已除尽)。
化学式 | 平衡常数 |
|
|
|
|
|
|
|
|
|
|
|
|
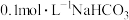 溶液的
溶液的
(2)常温下,用一定体积的
 的盐酸和
的盐酸和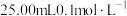 的氨水混合,充分反应后溶液中
的氨水混合,充分反应后溶液中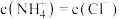 ,此时溶液为
,此时溶液为 。
。(3)常温下,用
 溶液与同浓度的
溶液与同浓度的 溶液等体积混合,充分反应后溶液中的元素守恒(物料守恒)关系式为
溶液等体积混合,充分反应后溶液中的元素守恒(物料守恒)关系式为(4)以下反应的离子方程式书写正确的是
A. 次氯酸钠溶液吸收少量二氧化硫:
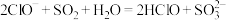
B. 醋酸除水垢:
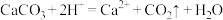
C.
 溶液吸收少量
溶液吸收少量
(5)常温下将
 通入氨水中,当溶液中的
通入氨水中,当溶液中的 时,溶液的
时,溶液的 为
为(6)调节
 除去
除去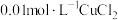 溶液中的少量
溶液中的少量 ,应该调节溶液的
,应该调节溶液的 范围是
范围是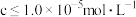 时,可认为已除尽)。
时,可认为已除尽)。
您最近一年使用:0次
7 . 过二硫酸钠(Na2S2O8)具有强氧化性,常用于处理水体中的有机污染物。
(1) 的结构如图1所示,用“□”标识出
的结构如图1所示,用“□”标识出 中体现强氧化性的基团:
中体现强氧化性的基团:___ 。

(2)Fe2+可活化 ,活化后产生
,活化后产生 。
。 氧化性更强,降解废水中有机污染物的能力更强。Fe2+活化
氧化性更强,降解废水中有机污染物的能力更强。Fe2+活化 过程中存在下列反应(k是衡量反应快慢的物理量,k越大,反应越快):
过程中存在下列反应(k是衡量反应快慢的物理量,k越大,反应越快):
Ⅰ: =2
=2 k=2.5×10-9
k=2.5×10-9
Ⅱ: +H2O=
+H2O=  +•OH-+H+ k=2×103
+•OH-+H+ k=2×103
Ⅲ: +Fe2+=Fe3++
+Fe2+=Fe3++ +
+ k=20
k=20
Ⅳ:Fe2++ =Fe3++
=Fe3++ k=4.6×109
k=4.6×109
向含有有机污染物的废水中投放一定量Na2S2O8,再分批加入一定量FeSO4。
①若将FeSO4一次性加入废水中,不利于有机污染物降解。原因是___ 。
②其他条件相同,溶液初始pH对有机物降解率的影响如图2所示。当pH>3时,有机物的降解率随初始pH升高而降低的可能原因是___ 。

(3)CuxFeyOz是一种复合催化剂,可催化活化过二硫酸盐( )产生
)产生 。
。
①该复合催化剂晶胞结构如图3所示(A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为___ 。

②该复合催化剂活化过二硫酸盐的过程如图4所示。请描述该催化剂参与反应并再生的过程:____ 。

(1)
 的结构如图1所示,用“□”标识出
的结构如图1所示,用“□”标识出 中体现强氧化性的基团:
中体现强氧化性的基团:
(2)Fe2+可活化
 ,活化后产生
,活化后产生 。
。 氧化性更强,降解废水中有机污染物的能力更强。Fe2+活化
氧化性更强,降解废水中有机污染物的能力更强。Fe2+活化 过程中存在下列反应(k是衡量反应快慢的物理量,k越大,反应越快):
过程中存在下列反应(k是衡量反应快慢的物理量,k越大,反应越快):Ⅰ:
 =2
=2 k=2.5×10-9
k=2.5×10-9Ⅱ:
 +H2O=
+H2O=  +•OH-+H+ k=2×103
+•OH-+H+ k=2×103Ⅲ:
 +Fe2+=Fe3++
+Fe2+=Fe3++ +
+ k=20
k=20Ⅳ:Fe2++
 =Fe3++
=Fe3++ k=4.6×109
k=4.6×109向含有有机污染物的废水中投放一定量Na2S2O8,再分批加入一定量FeSO4。
①若将FeSO4一次性加入废水中,不利于有机污染物降解。原因是
②其他条件相同,溶液初始pH对有机物降解率的影响如图2所示。当pH>3时,有机物的降解率随初始pH升高而降低的可能原因是

(3)CuxFeyOz是一种复合催化剂,可催化活化过二硫酸盐(
 )产生
)产生 。
。①该复合催化剂晶胞结构如图3所示(A、B分别为晶胞的
 的结构),其化学式为
的结构),其化学式为
②该复合催化剂活化过二硫酸盐的过程如图4所示。请描述该催化剂参与反应并再生的过程:

您最近一年使用:0次
名校
8 . 次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列说法正确的是
| A.用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O+4e-=O2↑+4H+ |
| B.将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物可能为H3PO4 |
| C.H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-= PO23-+3H2O |
D.H3PO2溶于水的电离方程式为H3PO2 H++H2PO2- H++H2PO2- |
您最近一年使用:0次
2019-01-07更新
|
397次组卷
|
6卷引用:河北省衡水中学2016-2017学年高一下学期期末考试化学试题
9 . 弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向________ (填“正”或“逆”)反应方向移动;水的电离程度将________ (填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______ 。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____ 。
A.盐酸多B.H2A多C.一样多D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________ 。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________ (填字母)。
a. 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______ 。
(4)0.1mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中c(H2A)________ c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________ (用文字解释)。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向
(2)99℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多B.H2A多C.一样多D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是
a.
 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是
(4)0.1mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中c(H2A)
您最近一年使用:0次
名校
10 . 次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
| A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+ |
| B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O |
| C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 |
D.H3PO2溶于水的电离方程式为H3PO2 H++H2PO2- H++H2PO2- |
您最近一年使用:0次
2016-11-17更新
|
286次组卷
|
13卷引用:2016-2017学年河北石家庄一中高二上期中考试化学试卷
2016-2017学年河北石家庄一中高二上期中考试化学试卷2017届河北省武邑中学高三上调研四化学试卷2017届安徽省蚌埠二中等四校高三上10月联考化学试卷2017届湖北省荆州中学高三上第四次质检化学试卷2016-2017学年湖南省衡阳八中高二上月考五化学卷2017届湖南省衡阳市第八中学高三上质检二化学卷2017届湖南省衡阳市第八中学高三第二次质检化学试卷2016-2017学年湖北省鄂东南省级示范高中高二下学期期中联考化学试卷湖北省荆州中学2018届高三第二次月考化学试题安徽省肥东县高级中学2019届高三上学期12月调研化学试题安徽省定远重点中学2019届高三上学期第三次月考化学试题湖北省荆州中学、宜昌一中两校2019-2020学年高二上学期期末考试化学试题云南省保山市腾冲市第八中学2023-2024学年高二下学期开学化学试题