名校
1 .  可以看成一种二元弱酸,写出第一步电离的电离方程式
可以看成一种二元弱酸,写出第一步电离的电离方程式___________ 。
 可以看成一种二元弱酸,写出第一步电离的电离方程式
可以看成一种二元弱酸,写出第一步电离的电离方程式
您最近一年使用:0次
2 . NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。已知:25℃时,Ka1(H2CO3)=5.0×10-7,Ka2(H2CO3)=5.0×10-11。
① 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式___________ 。NaOH溶液吸收CO2得到的某溶液中。当c( ):c(
):c( )=2:1时,溶液的
)=2:1时,溶液的
___________ 。
②泡沫灭火器中通常装有NaHCO3溶液和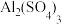 溶液,请写出这两种溶液混合时的离子反应方程式
溶液,请写出这两种溶液混合时的离子反应方程式___________ 。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NaOH+ 2NO2= NaNO3+ NaNO2+H2O。含 的水溶液与
的水溶液与 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 溶液,则两份溶液中c(
溶液,则两份溶液中c( )、c(
)、c( )和
)和 由大到小的顺序为
由大到小的顺序为___________ (已知HNO2的电离常数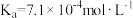 ,CH3COOH的电离常数
,CH3COOH的电离常数 。可使溶液A和溶液B的
。可使溶液A和溶液B的 相等的方法是
相等的方法是___________ (填序号)。
A.向溶液A中加适量NaOH B.向溶液A中加适量水 C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收SO2的过程中,常温下,溶液中H2SO3、 、
、 三者所占物质的量分数
三者所占物质的量分数 随
随 变化的关系如图所示:
变化的关系如图所示:

①由上图可以判断H2SO3的Ka1=___________ 。
②图中pH=7时,溶液中离子浓度关系正确的是___________ 。
A.
B.
C.
D. c(H+)=c(OH-)
c(H+)=c(OH-)
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。已知:25℃时,Ka1(H2CO3)=5.0×10-7,Ka2(H2CO3)=5.0×10-11。
①
 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式 ):c(
):c( )=2:1时,溶液的
)=2:1时,溶液的
②泡沫灭火器中通常装有NaHCO3溶液和
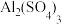 溶液,请写出这两种溶液混合时的离子反应方程式
溶液,请写出这两种溶液混合时的离子反应方程式(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NaOH+ 2NO2= NaNO3+ NaNO2+H2O。含
 的水溶液与
的水溶液与 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 溶液,则两份溶液中c(
溶液,则两份溶液中c( )、c(
)、c( )和
)和 由大到小的顺序为
由大到小的顺序为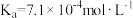 ,CH3COOH的电离常数
,CH3COOH的电离常数 。可使溶液A和溶液B的
。可使溶液A和溶液B的 相等的方法是
相等的方法是A.向溶液A中加适量NaOH B.向溶液A中加适量水 C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收SO2的过程中,常温下,溶液中H2SO3、
 、
、 三者所占物质的量分数
三者所占物质的量分数 随
随 变化的关系如图所示:
变化的关系如图所示:
①由上图可以判断H2SO3的Ka1=
②图中pH=7时,溶液中离子浓度关系正确的是
A.

B.

C.

D.
 c(H+)=c(OH-)
c(H+)=c(OH-)
您最近一年使用:0次
3 . 分布系数的概念在分析化学中非常重要。在酸碱平衡中,分布系数指酸碱以各种形式存在的平衡浓度与其分析浓度的比值。
(1)请以H3A为例,推导出分布系数公式

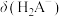
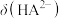
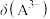
 、
、 、
、 、
、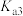 的式子表示,写出表达式即可]。
的式子表示,写出表达式即可]。(2)请用分布系数公式与电荷守恒公式,分别计算出
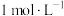 和
和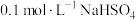 中
中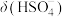 的精确值
的精确值 能否拆为H+和
能否拆为H+和
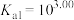 、
、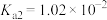 。写出计算过程)
。写出计算过程)
您最近一年使用:0次
4 . 向pH≈10的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
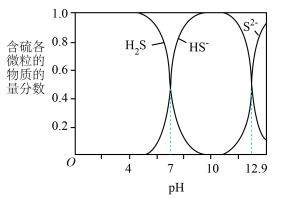
(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。
(2)pH≈10时,溶液中硫元素的主要存在形态为___________ 。
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:___________ 。
 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入
 溶液后pH降低的原因:
溶液后pH降低的原因:
您最近一年使用:0次
名校
5 . Ⅰ.非金属以其最低化合价与氢元素结合的化合物在常温常压下大多为气态,因此被称为气态氢化物。 、
、 、
、 都是我们学习过的常见气态氢化物。
都是我们学习过的常见气态氢化物。
(1)写出下列物质的电子式和结构式。
(2) 溶于水呈
溶于水呈___________ 性(填“酸”、“碱”或“中”),其电离方程式为___________ 。
(3)NH3可以使湿润的红色石蕊试纸变色,用化学方程式解释其原因:___________ 。请写出检验溶液中 的实验方法:
的实验方法:___________ 。
Ⅱ.1909年化学家哈伯在实验室首次用单质合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。
(4)用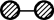 、
、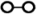 、
、 分别表示
分别表示 、
、 、
、 。观察下图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
。观察下图,判断符合在催化剂表面合成氨反应过程的顺序为___________。

(5)氨是重要的工业产品和原料,如制取硝酸。请写出氨催化氧化的反应方程式:___________ 。
(6)中学化学实验室利用复分解反应来制备氨气,写出该反应的化学方程式:___________ 。
 、
、 、
、 都是我们学习过的常见气态氢化物。
都是我们学习过的常见气态氢化物。(1)写出下列物质的电子式和结构式。
| 物质 | N2 | H2S | NH3 |
| 电子式 | |||
| 结构式 |
(2)
 溶于水呈
溶于水呈(3)NH3可以使湿润的红色石蕊试纸变色,用化学方程式解释其原因:
 的实验方法:
的实验方法:Ⅱ.1909年化学家哈伯在实验室首次用单质合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。
(4)用
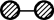 、
、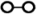 、
、 分别表示
分别表示 、
、 、
、 。观察下图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
。观察下图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
| A.②③④①⑤ | B.③②①④⑤ | C.③②④①⑤ | D.⑤④①②③ |
(6)中学化学实验室利用复分解反应来制备氨气,写出该反应的化学方程式:
您最近一年使用:0次
名校
6 . 现有下列几种物质:a.Na2O2b.CH3COOH c.NH4Cld.CO2e. NaOHf.Si。请回答下列问题:
(1)属于共价化合物的是___________ (填写编号,下同);含有非极性共价键的离子化合物是___________ 。
(2)NH4Cl溶于水需要破坏___________ (填写一种作用力名称,下同),干冰升华需要破坏___________ 。
(3)写出 CH3COOH 溶于水的电离方程式___________ 。
(4)试比较 d、e、f 三种晶体的熔点由高到低的顺序:___________ 。(填写编号)
(1)属于共价化合物的是
(2)NH4Cl溶于水需要破坏
(3)写出 CH3COOH 溶于水的电离方程式
(4)试比较 d、e、f 三种晶体的熔点由高到低的顺序:
您最近一年使用:0次
名校
7 . 下表中的物质为化学实验室常用药品:
回答下列问题:
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):_______ ;常温时,0.1mol·L-1的溶液呈碱性的是_______ (填序号)。
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=_______ ;常温时,pH=3的H2SO4溶液中,由水电离出的c水(H+)=_______ mol‧L-1;pH=10的Na2CO3溶液中由水电离出的c水(OH-)=_______ mol‧L-1。
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka_______ (填“增大”“减小”或“不变”。
(4)写出NaHCO3在生活中的一种用途:_______ 。
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | H2SO4 | CH3COOH | NaHCO3 | Na2CO3 | NH4Cl | NH3·H2O | HCl | NaCl |
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka
(4)写出NaHCO3在生活中的一种用途:
您最近一年使用:0次
2023-02-12更新
|
206次组卷
|
2卷引用:河北省石家庄市第一中学2022-2023学年高一下学期7月期末化学试题
名校
8 . 回答下列问题:
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因 水解而使其水溶液呈碱性,试写出
水解而使其水溶液呈碱性,试写出 水解的离子方程式(忽略第二步水解):
水解的离子方程式(忽略第二步水解):____ 。
②已知25℃时, 的水解常数Kh=2×10-4,则当Na2CO3溶液中c(
的水解常数Kh=2×10-4,则当Na2CO3溶液中c( ):c(
):c( )=2:1时,试求该溶液的pH=
)=2:1时,试求该溶液的pH=____ 。
③0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=____ [用含c( )、c(H2CO3)的关系式表示]。
)、c(H2CO3)的关系式表示]。
④向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:____ 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1的CH3COONa溶液,则两溶液中c( )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为____ (已知:HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,可使溶液A和溶液B的pH相等的方法是____ (填选项字母)。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因
 水解而使其水溶液呈碱性,试写出
水解而使其水溶液呈碱性,试写出 水解的离子方程式(忽略第二步水解):
水解的离子方程式(忽略第二步水解):②已知25℃时,
 的水解常数Kh=2×10-4,则当Na2CO3溶液中c(
的水解常数Kh=2×10-4,则当Na2CO3溶液中c( ):c(
):c( )=2:1时,试求该溶液的pH=
)=2:1时,试求该溶液的pH=③0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=
 )、c(H2CO3)的关系式表示]。
)、c(H2CO3)的关系式表示]。④向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1的CH3COONa溶液,则两溶液中c(
 )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
您最近一年使用:0次
9 . 按要求填写下列问题:
(1)某些共价化合物(如 、
、 、
、 等)在液态时会发生微弱的电离,如
等)在液态时会发生微弱的电离,如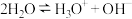 ,则液态
,则液态 的电离方程式为
的电离方程式为_______ 。
(2)已知水溶液中 和
和 的关系如图所示,试回答下列问题:
的关系如图所示,试回答下列问题:

图中五点对应的 的关系是
的关系是_______ 。若从A点到D点,可采用的措施是_______ (填序号)。
a.升温
b.加入少量的盐酸
c.加入少量的NaOH
(3)25℃时, 的HA溶液中
的HA溶液中 。请回答下列问题:
。请回答下列问题:
①HA是_______ (填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_______ (填序号)。
A.c(HA) B.溶液的pH
C. 与
与 的乘积 D.
的乘积 D.
(4)现有浓度均为 的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的
的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是_______ (用序号表示)。
(1)某些共价化合物(如
 、
、 、
、 等)在液态时会发生微弱的电离,如
等)在液态时会发生微弱的电离,如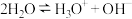 ,则液态
,则液态 的电离方程式为
的电离方程式为(2)已知水溶液中
 和
和 的关系如图所示,试回答下列问题:
的关系如图所示,试回答下列问题:
图中五点对应的
 的关系是
的关系是a.升温
b.加入少量的盐酸
c.加入少量的NaOH
(3)25℃时,
 的HA溶液中
的HA溶液中 。请回答下列问题:
。请回答下列问题:①HA是
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是
A.c(HA) B.溶液的pH
C.
 与
与 的乘积 D.
的乘积 D.
(4)现有浓度均为
 的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的
的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是
您最近一年使用:0次
名校
10 . “84”消毒液,它是一种以次氯酸钠(NaClO)为有效成分的高效消毒剂。已知:Ka(HClO)=4.7×10-8Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)“84”消毒液溶液呈_______ 性,其原因是_______ 。
(2)浓度均为0.1mo/LNaClO、Na2CO3、NaHCO3的pH由大到小的是_______ 。
(3)测定“84"消毒液中NaCIO的物质的量浓度。
量取10.00mL“84"消毒液于锥形瓶中,加入过量的KI溶液,用足量的乙酸酸化,加入几滴指示剂,用0.5000mol/LNa2S2O3溶液滴定,滴定终点时耗Na2S2O3溶液25.00mL(三次平均值)。
①滴定时所用指示剂是_______ ,终点时的现象_______ 。
②该“84”清毒液中NaClO的物质的量浓度_______ mol/L。
(1)“84”消毒液溶液呈
(2)浓度均为0.1mo/LNaClO、Na2CO3、NaHCO3的pH由大到小的是
(3)测定“84"消毒液中NaCIO的物质的量浓度。
量取10.00mL“84"消毒液于锥形瓶中,加入过量的KI溶液,用足量的乙酸酸化,加入几滴指示剂,用0.5000mol/LNa2S2O3溶液滴定,滴定终点时耗Na2S2O3溶液25.00mL(三次平均值)。
①滴定时所用指示剂是
②该“84”清毒液中NaClO的物质的量浓度
您最近一年使用:0次



