名校
1 . 已知常见的酸的电离平衡常数如下(均为常温下的数据):
回答下列问题。
(1)下列事实能证明草酸是弱电解质的是______(填标号)。
(2)同浓度的 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是______ 。
(3)常温下 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
(4)向 溶液中加入少量
溶液中加入少量 溶液,反应
溶液,反应 离子方程式为
离子方程式为____________ 。
(5)常温下,向 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,溶液中
,溶液中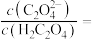
______ 。
(6) 的
的 溶液和
溶液和 的
的 溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:____________ 。
| 化学式 |  | HClO |  |  |
| 电离平衡常数 |  |  | 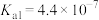  | 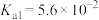 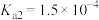 |
(1)下列事实能证明草酸是弱电解质的是______(填标号)。
A.草酸能使酸性 溶液褪色 溶液褪色 |
B.常温下, 的 的 溶液的 溶液的 |
C.相同条件下,浓度均为 的 的 溶液的导电能力比硫酸的导电能力弱 溶液的导电能力比硫酸的导电能力弱 |
D. 溶液中存在 溶液中存在 分子,呈酸性 分子,呈酸性 |
 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是(3)常温下
 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。A. | B. | C. | D. |
 溶液中加入少量
溶液中加入少量 溶液,反应
溶液,反应 离子方程式为
离子方程式为(5)常温下,向
 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,溶液中
,溶液中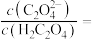
(6)
 的
的 溶液和
溶液和 的
的 溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
您最近一年使用:0次
2 . 回答下列问题:
(1)某温度时,测得 的
的 溶液浓度是
溶液浓度是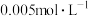 。该温度下水的离子积常数
。该温度下水的离子积常数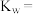
___________ 。
(2)已知25℃时二元酸 的
的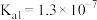 ,
,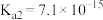 。向
。向 的
的 溶液通入HCl气体(忽略溶液体积的变化)至
溶液通入HCl气体(忽略溶液体积的变化)至 ,则
,则 的电离度约为
的电离度约为___________ 。
(3)室温下,向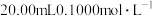 盐酸中滴加
盐酸中滴加 溶液,溶液的pH随NaOH溶液体积的变化如图。已知
溶液,溶液的pH随NaOH溶液体积的变化如图。已知 。下列说法
。下列说法正确 的是___________

(4)铁炭混合物在水溶液中可以形成许多微电池。将含有 的酸性废水通过铁炭混合物在微电池正极上
的酸性废水通过铁炭混合物在微电池正极上 转化为
转化为 ,其电极反应式为
,其电极反应式为___________
(5)研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。

①25℃时,在10~30min内,R的分解平均速率为___________ 。
②从哪两条曲线的对比中能说明R的分解平均速率随温度升高而增大___________ 。
(1)某温度时,测得
 的
的 溶液浓度是
溶液浓度是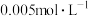 。该温度下水的离子积常数
。该温度下水的离子积常数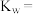
(2)已知25℃时二元酸
 的
的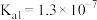 ,
,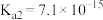 。向
。向 的
的 溶液通入HCl气体(忽略溶液体积的变化)至
溶液通入HCl气体(忽略溶液体积的变化)至 ,则
,则 的电离度约为
的电离度约为(3)室温下,向
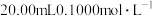 盐酸中滴加
盐酸中滴加 溶液,溶液的pH随NaOH溶液体积的变化如图。已知
溶液,溶液的pH随NaOH溶液体积的变化如图。已知 。下列说法
。下列说法
A.NaOH与盐酸恰好完全反应时, |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
D.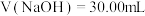 时, 时, |
 的酸性废水通过铁炭混合物在微电池正极上
的酸性废水通过铁炭混合物在微电池正极上 转化为
转化为 ,其电极反应式为
,其电极反应式为(5)研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。

①25℃时,在10~30min内,R的分解平均速率为
②从哪两条曲线的对比中能说明R的分解平均速率随温度升高而增大
您最近一年使用:0次
解题方法
3 . 氨水和 均可用于脱除烟气中
均可用于脱除烟气中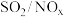 。
。
(1)以氨水作为吸收剂吸收 。25℃时,氨水中
。25℃时,氨水中 、
、 的物质的量分数随pH的分布如图所示。
的物质的量分数随pH的分布如图所示。
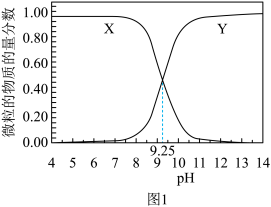
①氨水与 反应生成
反应生成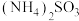 的离子方程式为
的离子方程式为___________ 。
②25℃时,氨水的电离常数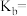
___________ 。(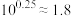 )
)
(2)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
① 溶液的水解平衡常数
溶液的水解平衡常数
___________ 。
②现有25℃时等浓度的5种溶液:A. ;B.
;B. ;C.
;C. ;D.
;D. ; E.
; E. ;F.(NH4)2CO3,这6种溶液中
;F.(NH4)2CO3,这6种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:___________ (填字母)。
(3) 可对烟气中NOx、
可对烟气中NOx、 进行协同脱除。
进行协同脱除。
①电解 溶液制备
溶液制备 气体的装置如图2所示。
气体的装置如图2所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为___________ 。

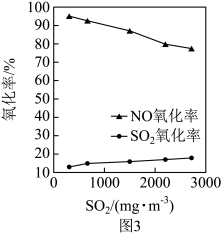
②保持其他条件不变,调节烟气中SO2初始浓度,将烟气按一定流速通入反应器与 反应,测得NO、SO2氧化率随SO2初始浓度的变化如图3所示。SO2氧化率始终低于NO氧化率的原因可能是
反应,测得NO、SO2氧化率随SO2初始浓度的变化如图3所示。SO2氧化率始终低于NO氧化率的原因可能是___________ 。
 均可用于脱除烟气中
均可用于脱除烟气中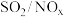 。
。(1)以氨水作为吸收剂吸收
 。25℃时,氨水中
。25℃时,氨水中 、
、 的物质的量分数随pH的分布如图所示。
的物质的量分数随pH的分布如图所示。
①氨水与
 反应生成
反应生成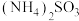 的离子方程式为
的离子方程式为②25℃时,氨水的电离常数
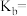
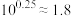 )
)(2)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
| 化学式 |  |  | HSCN |
| 电离平衡常数 |  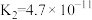 | 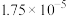 | 0.13 |
 溶液的水解平衡常数
溶液的水解平衡常数
②现有25℃时等浓度的5种溶液:A.
 ;B.
;B. ;C.
;C. ;D.
;D. ; E.
; E. ;F.(NH4)2CO3,这6种溶液中
;F.(NH4)2CO3,这6种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:(3)
 可对烟气中NOx、
可对烟气中NOx、 进行协同脱除。
进行协同脱除。①电解
 溶液制备
溶液制备 气体的装置如图2所示。
气体的装置如图2所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
②保持其他条件不变,调节烟气中SO2初始浓度,将烟气按一定流速通入反应器与
 反应,测得NO、SO2氧化率随SO2初始浓度的变化如图3所示。SO2氧化率始终低于NO氧化率的原因可能是
反应,测得NO、SO2氧化率随SO2初始浓度的变化如图3所示。SO2氧化率始终低于NO氧化率的原因可能是
您最近一年使用:0次
名校
4 . 向 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图

(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____
(2) 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为_____
(3)用化学平衡移动原理解释向 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:_____ 。
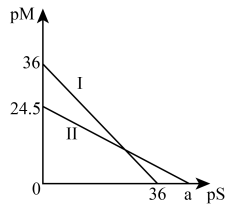
(4)某温度下,CuS和 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,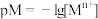 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为(3)用化学平衡移动原理解释向
 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:(4)某温度下,CuS和
 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,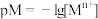 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
A.曲线Ⅱ代表的是 | B. |
C.此温度下CuS的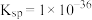 | D.此温度下的饱和溶液中 |
您最近一年使用:0次
名校
5 . NaClO溶液具有漂白能力,已知25℃时, ,向含有NaOH的NaClO溶液中逐滴滴入
,向含有NaOH的NaClO溶液中逐滴滴入 溶液,滴加过程中溶液的pH随
溶液,滴加过程中溶液的pH随 溶液的体积的变化曲线及实验现象见下表。
溶液的体积的变化曲线及实验现象见下表。
(1)NaClO的电子式是_____ ,次氯酸钠溶液中离子浓度大小顺序是:_____ 。
(2)下列关于NaClO溶液说法正确的是_____(双选)。
(3)25℃, 的NaClO和HClO的混合溶液中,[HClO]
的NaClO和HClO的混合溶液中,[HClO]_____ 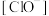 (填<,>或=)。
(填<,>或=)。
(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
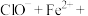


 。
。
①_____ 。
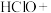


 +
+ 。
。
②_____ 。
(5)已知
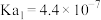 ,
,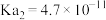 ,少量
,少量 通入NaClO溶液中发生的离子反应方程式为:
通入NaClO溶液中发生的离子反应方程式为:_____ 。
 ,向含有NaOH的NaClO溶液中逐滴滴入
,向含有NaOH的NaClO溶液中逐滴滴入 溶液,滴加过程中溶液的pH随
溶液,滴加过程中溶液的pH随 溶液的体积的变化曲线及实验现象见下表。
溶液的体积的变化曲线及实验现象见下表。| 变化曲线 | 实验现象 |
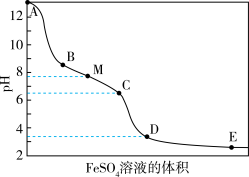 | ⅰ.A→B产生红褐色沉淀 ⅱ.B→C红褐色沉淀的量增多 ⅲ.C→D红褐色沉淀的量增多 ⅳ.D点附近产生有刺激性气味的气体 ⅴ.D→E红褐色沉淀的量略有增多 |
(2)下列关于NaClO溶液说法正确的是_____(双选)。
A.0.01mol/L溶液中, |
B.长期露置在空气中,释放 ,漂白能力减弱 ,漂白能力减弱 |
C.通入过量 ,反应的离子方程式为 ,反应的离子方程式为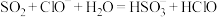 |
D.25℃, 的NaClO和HClO的混合溶液中, 的NaClO和HClO的混合溶液中, |
 的NaClO和HClO的混合溶液中,[HClO]
的NaClO和HClO的混合溶液中,[HClO]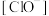 (填<,>或=)。
(填<,>或=)。(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
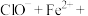


 。
。①
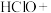


 +
+ 。
。②
(5)已知

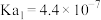 ,
,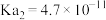 ,少量
,少量 通入NaClO溶液中发生的离子反应方程式为:
通入NaClO溶液中发生的离子反应方程式为:
您最近一年使用:0次
名校
6 . 食醋的有效成分主要为醋酸(用HAc表示)。25℃时,HAc的,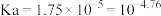 。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变
。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变 浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为
浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为 的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
(1)配制:250ml 的HAc溶液,需要的定量仪器是
的HAc溶液,需要的定量仪器是_____ ,需 HAc溶液的体积为
HAc溶液的体积为_____ mL。
(2)根据表中信息,补充数据:a=_____ ,b=_____ 。
(3)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡_____ (填“正”或“逆”)向移动;结合表中数据,给出判断理由:_____ 。
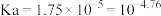 。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变
。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变 浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为
浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为 的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。| 序号 |  |  |  |  |  |
| Ⅰ | 40.00 | 0 | 2.86 | ||
| Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
| … | |||||
| Ⅶ | 4.00 | a | b | 3:4 | 4.53 |
| Ⅷ | 4.00 | 4.00 | 32.00 | 1:1 | 4.65 |
 的HAc溶液,需要的定量仪器是
的HAc溶液,需要的定量仪器是 HAc溶液的体积为
HAc溶液的体积为(2)根据表中信息,补充数据:a=
(3)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡
您最近一年使用:0次
7 . 完成下列问题。
I.食醋的有效成分主要为醋酸(用HAc表示)。25℃时,HAc的 。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变
。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变 浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为0.1
浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为0.1 的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
(1)配制250ml 0.1000  的HAc溶液,需要的定量仪器是
的HAc溶液,需要的定量仪器是___________ ,需5 HAc溶液的体积为
HAc溶液的体积为___________ mL。
(2)根据表中信息,补充数据:
___________ ,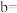
___________ 。
(3)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡___________ (填”正”或”逆”)向移动;结合表中数据,给出判断理由:___________ 。
II.查阅资料获悉:一定条件下,按 配制的溶液中,
配制的溶液中, 的值等于HAc的
的值等于HAc的 对比数据发现,实验Ⅷ中pH=4.65与资料数据
对比数据发现,实验Ⅷ中pH=4.65与资料数据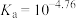 存在一定差异;推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。
存在一定差异;推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。
(4)用移液管取20.00ml HAc溶液于锥形瓶中,加入2滴酚酞溶液,用0.1000 mol/L NaOH溶液滴定至终点,判断滴定至终点的现象是___________ 。
(5)若测定结果偏低,可能原因是___________(双选)
(6)滴定过程共消耗NaOH体积为22.08ml,则该HAc溶液的浓度为___________  。
。
I.食醋的有效成分主要为醋酸(用HAc表示)。25℃时,HAc的
 。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变
。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变 浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为0.1
浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为0.1 的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。| 序号 |  |  |  | 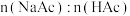 | pH |
| Ⅰ | 40.00 | 0 | 2.86 | ||
| Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
| … | |||||
| Ⅶ | 4.00 | a | b | 3∶4 | 4.53 |
| Ⅷ | 4.00 | 4.00 | 32.00 | 1∶1 | 4.65 |
 的HAc溶液,需要的定量仪器是
的HAc溶液,需要的定量仪器是 HAc溶液的体积为
HAc溶液的体积为(2)根据表中信息,补充数据:

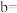
(3)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡
II.查阅资料获悉:一定条件下,按
 配制的溶液中,
配制的溶液中, 的值等于HAc的
的值等于HAc的 对比数据发现,实验Ⅷ中pH=4.65与资料数据
对比数据发现,实验Ⅷ中pH=4.65与资料数据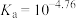 存在一定差异;推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。
存在一定差异;推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。(4)用移液管取20.00ml HAc溶液于锥形瓶中,加入2滴酚酞溶液,用0.1000 mol/L NaOH溶液滴定至终点,判断滴定至终点的现象是
(5)若测定结果偏低,可能原因是___________(双选)
| A.滴定管用蒸馏水洗净后未用氢氧化钠润洗 |
| B.盛装待测液的锥形瓶水洗后未烘干 |
| C.滴定过程中振荡锥形瓶时不慎有少量液体溅出 |
| D.滴定前滴定管内无气泡,滴定后滴定管内出现气泡。 |
 。
。
您最近一年使用:0次
名校
解题方法
8 . 按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因_______ 。
(2)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如下表所示:
①根据表中数据,将pH=2的下列四种酸的溶液分别稀释100倍,pH变化最小的是_______ 。
A. HCN B. HClO C. H2CO3 D. CH3COOH
②根据以上数据,判断下列反应可以成立的是_______ 。(填字母)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
①若向该溶液中滴加NaOH溶液,则离子沉淀先后顺序是_______ (填离子符号)。
②已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH=_______ 时,溶液中Cu2+沉淀完全。[已知1g2=0.3]
③下列说法不正确的是_______ (填字母)。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
B.一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
C.除去溶液中的Mg2+,用OH-沉淀比用CO 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因
(2)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如下表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A. HCN B. HClO C. H2CO3 D. CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
②已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH=
③下列说法不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
B.一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
C.除去溶液中的Mg2+,用OH-沉淀比用CO
 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
您最近一年使用:0次
2023-06-07更新
|
57次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题(日新班)
名校
9 . 部分元素在周期表的位置如图所示:
(1)G元素在周期表中的位置可表示为___________ ;
(2)BH2的电子式为___________ ;
(3)G与H元素最高价氧化物所对应的水化物,酸性较强的是___________ (填化学式);
(4)DF2属于___________ 晶体;
(5)CA4的分子空间构型为___________ ;
(6)物质EA4H存在的微粒间作用力有___________ ;
(7)AHF的电离方程式为___________ ;
(8)将A2F2的酸性溶液与M2G的水溶液混合可生成G的单质,发生反应的离子方程式为___________ 。

(1)G元素在周期表中的位置可表示为
(2)BH2的电子式为
(3)G与H元素最高价氧化物所对应的水化物,酸性较强的是
(4)DF2属于
(5)CA4的分子空间构型为
(6)物质EA4H存在的微粒间作用力有
(7)AHF的电离方程式为
(8)将A2F2的酸性溶液与M2G的水溶液混合可生成G的单质,发生反应的离子方程式为
您最近一年使用:0次
2023-04-26更新
|
86次组卷
|
2卷引用:福建省莆田第一中学2022-2023学年高一下学期第一学段(期中)考试化学试题
名校
10 . 水溶液中的离子反应和平衡状态与生活、生产及环境保护等息息相关。请回答下列问题:
(1)25℃时,
___________ ;
(2)已知25℃时,HCN的 ,则NaCN溶液显
,则NaCN溶液显___________ (填“酸性”、“中性”或“碱性”),结合离子反应方程式 分析其原因是___________ 。
(3)25℃时,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为___________ 。
(4)已知25℃时, 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
___________ ,溶液中各离子物质的量浓度由大到小的顺序为___________ 。
(5)25℃时, 的①
的① ②
② ③NaCN④
③NaCN④ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是___________ (填序号)。
(6)某同学用 的NaOH溶液分别滴定
的NaOH溶液分别滴定 的HCl溶液和
的HCl溶液和 的
的 溶液,得到如图所示的两条滴定曲线,请回答有关问题:
溶液,得到如图所示的两条滴定曲线,请回答有关问题:

①NaOH溶液滴定 溶液的曲线是
溶液的曲线是___________ (填“图1”或“图2”)曲线。
②图1和图2中的a=___________ 。
(7)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各含氯元素微粒的组成分数 [
[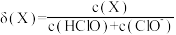 ,X为HClO或
,X为HClO或 ]与pH的关系如图所示。HClO的电离常数
]与pH的关系如图所示。HClO的电离常数 值为
值为___________ 。

(1)25℃时,

(2)已知25℃时,HCN的
 ,则NaCN溶液显
,则NaCN溶液显(3)25℃时,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(4)已知25℃时,
 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
(5)25℃时,
 的①
的① ②
② ③NaCN④
③NaCN④ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是| 电解质 |  |  | HCN |  |
| 电离常数 | 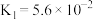  |  | 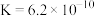 |  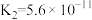 |
(6)某同学用
 的NaOH溶液分别滴定
的NaOH溶液分别滴定 的HCl溶液和
的HCl溶液和 的
的 溶液,得到如图所示的两条滴定曲线,请回答有关问题:
溶液,得到如图所示的两条滴定曲线,请回答有关问题:
①NaOH溶液滴定
 溶液的曲线是
溶液的曲线是②图1和图2中的a=
(7)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各含氯元素微粒的组成分数
 [
[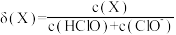 ,X为HClO或
,X为HClO或 ]与pH的关系如图所示。HClO的电离常数
]与pH的关系如图所示。HClO的电离常数 值为
值为
您最近一年使用:0次



