1 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.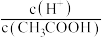 C.
C.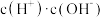 D.
D. E.
E. 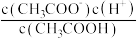
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
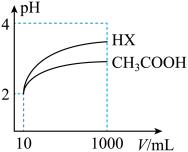
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
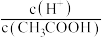 C.
C.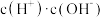 D.
D. E.
E. 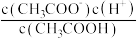
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
您最近一年使用:0次
名校
2 .  是大气的主要污染物。研究消除
是大气的主要污染物。研究消除 的方法和机理一直是环境专家不断追求的目标。
的方法和机理一直是环境专家不断追求的目标。
I二氧化硫在 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。
(1)二氧化硫在 催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
①
②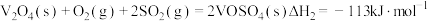
③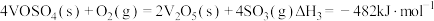
则
_______ 。
(2)硫酸生产中, 催化氧化生成
催化氧化生成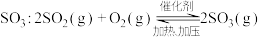 。某温度下,
。某温度下, 的平衡转化率(
的平衡转化率( )与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
)与体系总压强(p)的关系如下图所示。根据图示回答下列问题: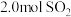 和
和 置于10L密闭容器中,反应达平衡后,体系总压强为
置于10L密闭容器中,反应达平衡后,体系总压强为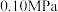 。该反应的平衡常数等于
。该反应的平衡常数等于_______ 。
②平衡状态由A变到B时,平衡常数
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅱ.二氧化硫在一定条件下可以发生如下反应:
 。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定
进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率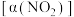 。部分实验结果如图所示:
。部分实验结果如图所示:_______ 。
(4)若A点对应实验中,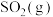 的起始浓度为
的起始浓度为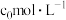 ,经过
,经过 达到平衡状态,则该时段化学反应速率
达到平衡状态,则该时段化学反应速率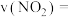
_______  。
。
(5)图中C、D两点对应的实验温度分别为 和
和 ,通过计算判断:
,通过计算判断:
_______  (填或“<” “=”或“<”)。
(填或“<” “=”或“<”)。
Ⅲ.东南大学化工团队在酸性的条件下,以电化学原理消除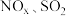 ,同时又变废为宝。
,同时又变废为宝。
(6)写出 转化的电极反应方程式:
转化的电极反应方程式: _______ 。
 。
。 的稀硫酸中,
的稀硫酸中,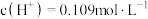 ,求硫酸第二步电离的电离常数:
,求硫酸第二步电离的电离常数:_______ (结果保留三位有效数字)。
 是大气的主要污染物。研究消除
是大气的主要污染物。研究消除 的方法和机理一直是环境专家不断追求的目标。
的方法和机理一直是环境专家不断追求的目标。I二氧化硫在
 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。(1)二氧化硫在
 催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:①

②
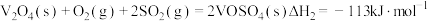
③
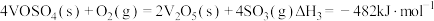
则

(2)硫酸生产中,
 催化氧化生成
催化氧化生成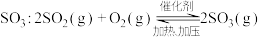 。某温度下,
。某温度下, 的平衡转化率(
的平衡转化率( )与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
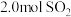 和
和 置于10L密闭容器中,反应达平衡后,体系总压强为
置于10L密闭容器中,反应达平衡后,体系总压强为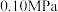 。该反应的平衡常数等于
。该反应的平衡常数等于②平衡状态由A变到B时,平衡常数

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。Ⅱ.二氧化硫在一定条件下可以发生如下反应:
 。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定
进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率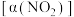 。部分实验结果如图所示:
。部分实验结果如图所示: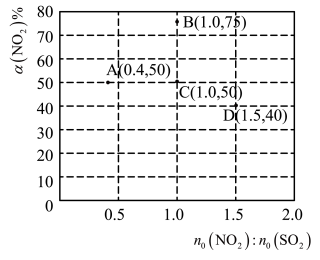
(4)若A点对应实验中,
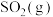 的起始浓度为
的起始浓度为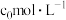 ,经过
,经过 达到平衡状态,则该时段化学反应速率
达到平衡状态,则该时段化学反应速率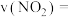
 。
。(5)图中C、D两点对应的实验温度分别为
 和
和 ,通过计算判断:
,通过计算判断:
 (填或“<” “=”或“<”)。
(填或“<” “=”或“<”)。Ⅲ.东南大学化工团队在酸性的条件下,以电化学原理消除
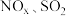 ,同时又变废为宝。
,同时又变废为宝。(6)写出
 转化的电极反应方程式:
转化的电极反应方程式: 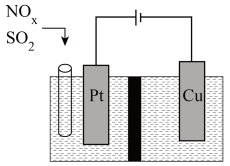

 。
。 的稀硫酸中,
的稀硫酸中,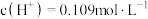 ,求硫酸第二步电离的电离常数:
,求硫酸第二步电离的电离常数:
您最近一年使用:0次
名校
解题方法
3 . Ⅰ、按要求回答下列问题:
(1)常温下,有关下列四种溶液的说法正确的是___________。
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=___________ mol·L−1。
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:___________ (填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和H2平衡转化率的措施:___________ 。
③保证该压强不变,向T1温度下, =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡___________ (填“正向”“逆向”或“不”)移动。
(1)常温下,有关下列四种溶液的说法正确的是___________。
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
| A.由水电离出的c(H+):③>① |
| B.①稀释到原来的100倍,pH与②相同 |
C.①与③混合,若溶液pH=7,则溶液中c(NH )>c(Cl-) )>c(Cl-) |
| D.②与④等体积混合,混合溶液的pH>7 |
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示: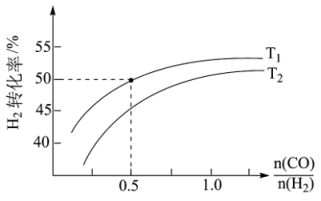
②写出一条可同时提高反应速率和H2平衡转化率的措施:
③保证该压强不变,向T1温度下,
 =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
您最近一年使用:0次
4 . Ⅰ.太空很神秘,水的世界也深不可测,从水作溶剂、水分子运动到水的电离、水与活泼金属反应等等。结合书本知识,回答下列问题:
(1)标准状况下,0.01 的NaOH溶液的pH
的NaOH溶液的pH_______ (填“>”“<”或“=”,下同)12,该温度下,水的离子积常数
_______  。
。
(2)T℃下,水的离子积曲线如图所示。_______ (填字母)。
a.T℃小于25℃
b.A点溶液pH=8
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将 L pH=a NaOH溶液与
L pH=a NaOH溶液与 L
L 硫酸混合。
硫酸混合。
若所得混合溶液呈中性,且a=12,b=1,则
_______ ;若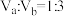 ,且a=11,b=3,则所得混合溶液的pH=
,且a=11,b=3,则所得混合溶液的pH=_______ 。
(3)现有以下五种电解质溶液,回答下列问题:
① ②NaOH ③
②NaOH ③ ④
④ ⑤
⑤
①浓度均为0.1 的五种溶液中导电能力最强的是
的五种溶液中导电能力最强的是_______ (填序号)。
②浓度均为0.1 的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为_______ (填序号)。
Ⅱ. 、
、 、
、 是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
回答下列问题:
(4)常温下,下列事实能说明 是弱电解质的是
是弱电解质的是_______ (填写序号)
① 与水能以任意比互溶
与水能以任意比互溶
②0.1mol/L 溶液导电能力比0.1mol/L盐酸弱
溶液导电能力比0.1mol/L盐酸弱
③常温下pH=3的 溶液稀释十倍后pH<4
溶液稀释十倍后pH<4
④ 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大
⑥大小相同的锌片与同体积同浓度的盐酸和 反应,产生
反应,产生 的物质的量相同
的物质的量相同
(5)已知 ,则常温下
,则常温下
 溶液的pH=
溶液的pH=_______ 。用水缓慢稀释该氨水的过程中,溶液中随着水量的增加,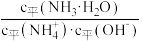
_______ 。(填“增大”“减小”或“不变”)
(1)标准状况下,0.01
 的NaOH溶液的pH
的NaOH溶液的pH
 。
。(2)T℃下,水的离子积曲线如图所示。
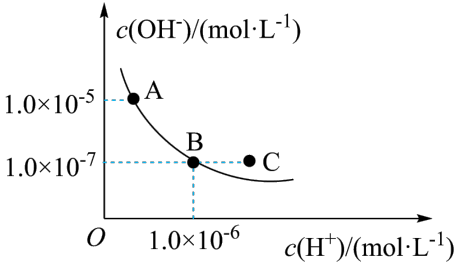
a.T℃小于25℃
b.A点溶液pH=8
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将
 L pH=a NaOH溶液与
L pH=a NaOH溶液与 L
L 硫酸混合。
硫酸混合。若所得混合溶液呈中性,且a=12,b=1,则

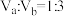 ,且a=11,b=3,则所得混合溶液的pH=
,且a=11,b=3,则所得混合溶液的pH=(3)现有以下五种电解质溶液,回答下列问题:
①
 ②NaOH ③
②NaOH ③ ④
④ ⑤
⑤
①浓度均为0.1
 的五种溶液中导电能力最强的是
的五种溶液中导电能力最强的是②浓度均为0.1
 的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为Ⅱ.
 、
、 、
、 是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
是中学化学中常见的物质,常温下,有关物质的电离常数如下表:| 物质 |  |  |  |
| 电离常数 | 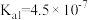 , ,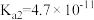 | 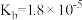 |  |
(4)常温下,下列事实能说明
 是弱电解质的是
是弱电解质的是①
 与水能以任意比互溶
与水能以任意比互溶②0.1mol/L
 溶液导电能力比0.1mol/L盐酸弱
溶液导电能力比0.1mol/L盐酸弱③常温下pH=3的
 溶液稀释十倍后pH<4
溶液稀释十倍后pH<4④
 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向
 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大⑥大小相同的锌片与同体积同浓度的盐酸和
 反应,产生
反应,产生 的物质的量相同
的物质的量相同(5)已知
 ,则常温下
,则常温下
 溶液的pH=
溶液的pH=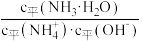
您最近一年使用:0次
名校
解题方法
5 . 化学上的缓冲溶液就是外加少量酸、碱后而pH值基本不变的溶液。
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式___________ 、___________ 。
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为___________ ,反应后溶液中c(H+)=___________ mol/L。
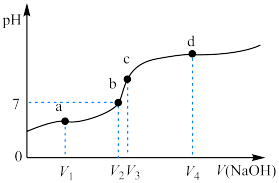
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为___________ ;c点恰好完全反应,该处溶液呈碱性的原因为___________ 。
4.CO2的电子式为___________ ,其分子极性为___________ ;电负性C___________ Si(填“>”“=”或者“<”)。
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是___________ 。
a.代谢产生的H+被 结合形成H2CO3
结合形成H2CO3
b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为
4.CO2的电子式为
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是
a.代谢产生的H+被
 结合形成H2CO3
结合形成H2CO3b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
您最近一年使用:0次
6 . 已知25℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为物质
(1)碳酸一级电离的平衡常数表达式为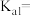
_______ 。
(2)下列四种离子结合 能力最强的是_______。
能力最强的是_______。
(3)酸性强弱:醋酸_______ 次氯酸(填“>”或“<”,下同);经测定,常温下0.1 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,_______ (填“能”或“不能”)说明两者的酸性强弱关系。
(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
(5) 和
和 的混合溶液中,
的混合溶液中,
_______ (用微粒符号表示)。
(6)25℃时,pH=1的硫酸与0.02
 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为_______ 。
| 物质 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 |  |  | 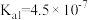 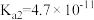 | 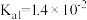 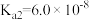 |
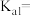
(2)下列四种离子结合
 能力最强的是_______。
能力最强的是_______。A. | B. | C. | D. |
 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
A. | B. | C.醋酸的电离平衡常数 | D.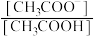 |
 和
和 的混合溶液中,
的混合溶液中,
(6)25℃时,pH=1的硫酸与0.02

 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为
您最近一年使用:0次
7 . 在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响。
 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数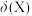 随pH的变化如图所示:
随pH的变化如图所示: )在水中的电离方程式:
)在水中的电离方程式:___________ 。
(2)要使溶液中草酸的电离程度增大,采取的措施为___________ 。(写两点)
(3)草酸溶液中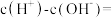
___________ 。(用含碳微粒表示)
(4)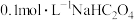 溶液中
溶液中
___________  。(填“<”“>”“=”)
。(填“<”“>”“=”)
(5) 时,
时,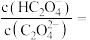
___________ 。

 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数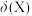 随pH的变化如图所示:
随pH的变化如图所示: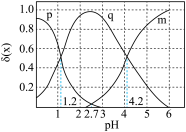
 )在水中的电离方程式:
)在水中的电离方程式:(2)要使溶液中草酸的电离程度增大,采取的措施为
(3)草酸溶液中
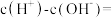
(4)
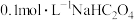 溶液中
溶液中
 。(填“<”“>”“=”)
。(填“<”“>”“=”)(5)
 时,
时,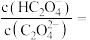
您最近一年使用:0次
8 . 按要求填空
(1)NaHCO3的水溶液呈___________ (填“酸”、“中”、“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用___________ 塞,原因___________ (写出有关的离子方程式,下同);Al2(SO4)3显酸性,溶液蒸干最后得到的固体产物是___________ 。
(2)常温下,下列溶液中,c(H+)由小到大的排列顺序是___________ 。
①0.1mol/LHCl溶液 ②0.1mol/LH2SO4溶液 ③0.1mol/LNaOH溶液 ④0.1mol/LCH3COOH溶液。
(3)25℃时,有 的盐酸和
的盐酸和 的
的 溶液中由水电离出的c(H+)之比为
溶液中由水电离出的c(H+)之比为___________ 。
(4)已知: :
: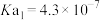 ;
; ,
, :
: 。
。
①相同条件下,试比较 、
、 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为___________ 。
②则将 气体通入足量的
气体通入足量的 溶液中的离子反应方程式为
溶液中的离子反应方程式为___________ 。
(1)NaHCO3的水溶液呈
(2)常温下,下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/LHCl溶液 ②0.1mol/LH2SO4溶液 ③0.1mol/LNaOH溶液 ④0.1mol/LCH3COOH溶液。
(3)25℃时,有
 的盐酸和
的盐酸和 的
的 溶液中由水电离出的c(H+)之比为
溶液中由水电离出的c(H+)之比为(4)已知:
 :
: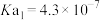 ;
; ,
, :
: 。
。①相同条件下,试比较
 、
、 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为②则将
 气体通入足量的
气体通入足量的 溶液中的离子反应方程式为
溶液中的离子反应方程式为
您最近一年使用:0次
解题方法
9 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
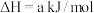
②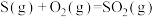
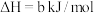
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数
_______ (填数值)。
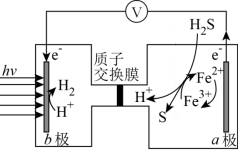
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

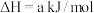
②
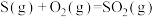
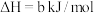
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数

(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
您最近一年使用:0次
名校
解题方法
10 . 推动 的综合利用实现碳中和是党中央作出的重大战略决策。
的综合利用实现碳中和是党中央作出的重大战略决策。
Ⅰ. 催化加氢法:以下是
催化加氢法:以下是 催化加氢合成二甲醚发生的两个主要反应:
催化加氢合成二甲醚发生的两个主要反应:
反应Ⅰ:
反应Ⅱ:
(1)反应
___________ 。
(2)在恒压、 和
和 起始量一定的条件下,
起始量一定的条件下, 平衡转化率和平衡时
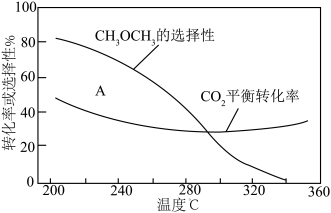
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中: 的选择性
的选择性
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是___________ 。
②220℃时,在催化剂作用下 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为:
的选择性为: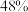 (图中
(图中 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高 选择性的措施有:
选择性的措施有:___________ 。(答1点即可)
Ⅱ. 催化加氢法:高炉气中捕集
催化加氢法:高炉气中捕集 制
制 的综合利用示意图如图所示。
的综合利用示意图如图所示。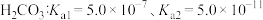 。
。
(3)T℃时,当吸收池中溶液的 时,此时该溶液中
时,此时该溶液中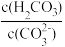 =
=___________ 。
(4)电解池中 电催化还原为
电催化还原为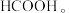
① 在铂电极反应方程式为
在铂电极反应方程式为___________ 。
②铂电极上的副反应除析氢外,没有其它放电过程。若生成 的电解效率
的电解效率 ,当电路中转移
,当电路中转移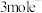 时,阴极室溶液的质量增加
时,阴极室溶液的质量增加___________  。定义:
。定义: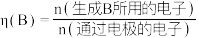
 的综合利用实现碳中和是党中央作出的重大战略决策。
的综合利用实现碳中和是党中央作出的重大战略决策。Ⅰ.
 催化加氢法:以下是
催化加氢法:以下是 催化加氢合成二甲醚发生的两个主要反应:
催化加氢合成二甲醚发生的两个主要反应:反应Ⅰ:

反应Ⅱ:

(1)反应

(2)在恒压、
 和
和 起始量一定的条件下,
起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中: 的选择性
的选择性
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是②220℃时,在催化剂作用下
 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为:
的选择性为: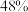 (图中
(图中 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高 选择性的措施有:
选择性的措施有:Ⅱ.
 催化加氢法:高炉气中捕集
催化加氢法:高炉气中捕集 制
制 的综合利用示意图如图所示。
的综合利用示意图如图所示。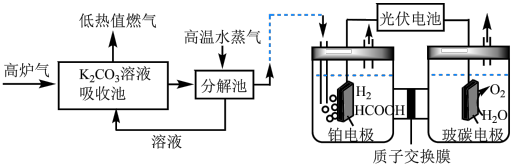
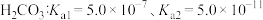 。
。(3)T℃时,当吸收池中溶液的
 时,此时该溶液中
时,此时该溶液中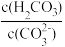 =
=(4)电解池中
 电催化还原为
电催化还原为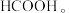
①
 在铂电极反应方程式为
在铂电极反应方程式为②铂电极上的副反应除析氢外,没有其它放电过程。若生成
 的电解效率
的电解效率 ,当电路中转移
,当电路中转移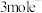 时,阴极室溶液的质量增加
时,阴极室溶液的质量增加 。定义:
。定义: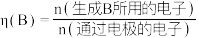
您最近一年使用:0次



